Herzinsuffizienz
Synonyme: Herzschwäche, Herzleistungsschwäche, Herzleistungsminderung
Englisch: congestive heart failure, chronic heart failure (CHF)
Definition
Eine Herzinsuffizienz liegt vor, wenn das Herz unfähig ist, das vom Organismus benötigte Herzzeitvolumen bei normalem enddiastolischen Ventrikeldruck bereitzustellen. Es handelt sich um ein klinisches Syndrom, das unterschiedliche Ursachen haben kann.
Die WHO definiert die Herzinsuffizienz als verminderte körperliche Belastbarkeit aufgrund einer ventrikulären Funktionsstörung.
Epidemiologie
Die Herzinsuffizienz ist weltweit eine der bedeutendsten chronischen Erkrankungen des Herz-Kreislauf-Systems. Aufgrund der demografischen Entwicklung und der verbesserten Akutversorgung kardiovaskulärer Erkrankungen spielt sie im klinischen Alltag eine immer wichtigere Rolle. In Deutschland ist sie nicht nur eine der häufigsten Ursachen für Krankenhausaufenthalte, sondern auch eine der führenden Todesursachen.
Prävalenz
Die Prävalenz der Herzinsuffizienz steigt stark mit zunehmendem Alter. In der Gesamtbevölkerung liegt sie bei etwa 2–3 %, in der Altersgruppe der über 70-Jährigen jedoch bei über 10 %. Die einjährige Prävalenz im Jahr 2023 betrug 4,97 % in der Bevölkerung ab 30 Jahren, wobei Männer mit 5,15 % etwas häufiger betroffen waren als Frauen mit 4,80 %. Besonders hoch ist die Prävalenz bei sehr alten Menschen: Bei den 65- bis 69-Jährigen beträgt sie etwa 6–7 %, bei den 80- bis 84-Jährigen rund 24 % und bei über 95-Jährigen nahezu 50 %. Insgesamt sind in Deutschland nach aktuellen Schätzungen bis zu vier Millionen Menschen von einer chronischen Herzinsuffizienz betroffen.
Inzidenz
Auch die Inzidenz der Herzinsuffizienz ist hoch: Jährlich treten in Deutschland über 500.000 Neuerkrankungen auf. Aufgrund der steigenden Lebenserwartung und der Zunahme von Risikofaktoren wie arterieller Hypertonie, Adipositas und Diabetes mellitus ist in den kommenden Jahren mit einem weiteren Anstieg zu rechnen. Die Herzinsuffizienz war im Jahr 2020 die häufigste Hauptdiagnose bei stationären Krankenhausaufenthalten in Deutschland und ist damit ein wesentlicher Faktor für die Belastung des Gesundheitssystems.
Mortalität
Hinsichtlich der Mortalität zeigt sich ein weiterhin hohes Sterberisiko: Im Jahr 2022 starben 37.570 Menschen in Deutschland an Herzinsuffizienz. Männer sind etwas häufiger betroffen als Frauen; die altersstandardisierte Mortalitätsrate lag 2022 bei 39,4 pro 100.000 Männern gegenüber 36,0 pro 100.000 Frauen. Etwa die Hälfte aller Patienten mit diagnostizierter Herzinsuffizienz verstirbt innerhalb von sechs Jahren, wobei die Prognose stark von der Ätiologie und der linksventrikulären Funktion abhängt. Außerdem ist die Herzinsuffizienz eine der wichtigsten Ursachen für den plötzlichen Herztod: In Deutschland werden jährlich mehr als 65.000 Fälle plötzlichen Herztodes registriert, ein erheblicher Anteil davon bei Patienten mit fortgeschrittener systolischer Dysfunktion.
Die Herzinsuffizienz gehört inzwischen zu den häufigsten Todesursachen überhaupt: Bei Frauen handelt es sich um die zweithäufigste, bei Männern um die vierthäufigste Todesursache.[1] Frauen werden im klinischen Alltag oft später diagnostiziert.
Ursachen
Die Herzinsuffizienz ist ein klinisches Endstadium verschiedener kardialer oder systemischer Erkrankungen. Sie entsteht in der Regel infolge einer strukturellen oder funktionellen Schädigung des Myokards oder der Herzklappen, die eine Störung von Füllung und/oder Auswurf der Ventrikel verursacht. Häufig liegt eine Kombination mehrerer ätiologischer Faktoren vor.
Häufige Ursachen
KHK und Myokardinfarkt
Die mit 50–60 % häufigste Ursache einer Herzinsuffizienz in industrialisierten Ländern ist die koronare Herzkrankheit (KHK). Rezidivierende Myokardischämien oder ein durchgemachter Myokardinfarkt führen zu einer irreversiblen Schädigung der Kardiomyozyten und damit zu systolischer Dysfunktion und ventrikulärem Remodelling. Besonders relevant ist die chronische ischämische Herzkrankheit, die über Jahre zu einer fortschreitenden Verschlechterung der Pumpfunktion führt (Herzinsuffizienz mit reduzierter Ejektionsfraktion) (HFrEF).
Arterielle Hypertonie
Die arterielle Hypertonie ist die zweithäufigste Ursache (ca. 15–20 %). Sie führt langfristig zu einer Druckbelastung des linken Ventrikels, kompensatorischer linksventrikulärer Hypertrophie und später zur diastolischen Dysfunktion. Sie ist die Hauptursache der Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF).
Herzklappenerkrankungen
Herzklappenerkrankungen (Valvulopathien) machen ungefähr 10 bis 15 % der Fälle aus. Sie können sowohl angeboren als auch erworben sein und führen durch chronische Druck- oder Volumenbelastung der Ventrikel zur Herzinsuffizienz. Typische Beispiele sind die Aortenklappenstenose und -insuffizienz sowie die Mitralklappenstenose und die -insuffizienz. In westlichen Ländern sind sie meist degenerativ bedingt, weltweit häufig noch rheumatisch bedingt.
Tachyarrhythmien
Persistierende Tachykardien verursachen eine tachykardie-induzierte Kardiomyopathie. Vorhofflimmern kann außerdem sowohl Ursache als auch Folge einer Herzinsuffizienz sein. Persistierendes Vorhofflimmern begünstigt durch Tachykardie-induziertes Myokardremodelling die Entwicklung einer systolischen Dysfunktion. Umgekehrt fördert die Herzinsuffizienz die Entstehung von Vorhofflimmern durch atriale Dilatation und Fibrose, sodass ein Circulus vitiosus entsteht.
Kardiomyopathien
Ungefähr 10 bis 15 % der Fälle sind bedingt durch eine Kardiomyopathie:
- Die dilatative Kardiomyopathie ist charakterisiert durch eine fortschreitende Dilatation der Herzhöhlen und eine systolische Pumpstörung. Neben genetischen Ursachen kommen toxische Schädigungen (z.B. chronischer Alkoholabusus, Chemotherapeutika wie Anthrazykline, Drogen wie Kokain) sowie virale oder immunologische Ursachen infrage.
- Die hypertrophe Kardiomyopathie (HCM) tritt oft familiär gehäuft auf und kann mit oder ohne Obstruktion des linksventrikulären Ausflusstrakts auftreten.
- Die restriktive Kardiomyopathie (RCM) ist selten und entsteht beispielsweise im Rahmen systemischer Erkrankungen wie Amyloidose oder Sarkoidose.
- Arrhythmogene Kardiomyopathie (ACM): genetisch bedingt, mit ventrikulären Rhythmusstörungen.
- Peripartale Kardiomyopathie: tritt im letzten Schwangerschaftsdrittel oder post partum auf.
- Tako-Tsubo-Kardiomyopathie
Seltenere Ursachen
Zu den seltenen Ursachen zählt die Myokarditis. Sie kann zu einer akuten Herzinsuffizienz führen und in eine dilatative Kardiomyopathie (DCM) übergehen. Virale Myokarditiden, insbesondere durch Coxsackie-, Adeno- oder Parvoviren, sind in industrialisierten Ländern die häufigsten entzündlichen Ursachen. Seltener ist die Myokarditis autoimmun (z.B. systemischer Lupus erythematodes oder Riesenzellmyokarditis) oder bakteriell (z.B. Borreliose, Diphtherie) bedingt.
Weitere seltenere Ursachen sind:
- Perikarderkrankungen wie die konstriktive Perikarditis oder ein Perikardtamponade können durch Einschränkung der diastolischen Füllung eine Herzinsuffizienz verursachen. Typische Ursachen sind Tuberkulose, Herzoperationen und Strahlentherapie.
- Akute Lungenembolien können durch eine massive Rechtsherzbelastung zur akuten Rechtsherzinsuffizienz führen.
- Chronische pulmonale Hypertonie (Cor pulmonale)
- High-Output-Herzinsuffizienz: entsteht bei Zuständen mit massiv gesteigertem Herzzeitvolumen und kann durch eine bestehende Herzschädigung dekompensieren. Ursachen sind unter anderem schwere Anämien, Thyreotoxikose, Beriberi oder große arteriovenöse Fisteln.
- Systemische Stoffwechselstörungen: Hämochromatose, bestimmte Glykogenosen (z.B. Morbus Pompe) sowie andere Speicherkrankheiten, die das Myokard infiltrieren und strukturell verändern (Morbus Fabry, Amyloidose)
- Endokrine Ursachen: Thyreotoxikose, Hypothyreose (selten), Cushing-Syndrom, Phäochromozytom.
- Infektiöse Sonderformen: HIV-assoziierte Kardiomyopathie, Chagas-Kardiomyopathie (Südamerika, Trypanosoma cruzi).
- Angeborene Herzfehler: Ventrikelseptumdefekt, persistierender Ductus arteriosus, komplexe Zyanosevitien.
Wenn trotz umfassender Diagnostik keine Ursache gefunden werden kann, spricht man von einer idiopathischen Herzinsuffizienz. Häufig liegen bislang nicht identifizierte genetische Kardiomyopathien zugrunde.
Verstärkende Faktoren
Diese Erkrankungen sind nicht immer primär auslösend, spielen jedoch eine entscheidende Rolle für Entstehung und Progression der Herzinsuffizienz:
- Diabetes mellitus (DM): Die Stoffwechselerkrankung erhöht das Risiko für Herzinsuffizienz unabhängig von KHK und Hypertonie. Sie führt zu einer diabetischen Kardiomyopathie mit Myokardfibrose, mikrovaskulärer Dysfunktion und gestörter Relaxation. Besonders relevant ist der DM für HFpEF und bei Patienten mit metabolischem Syndrom.
- Obstruktive Schlafapnoe (OSA): Wiederholte Hypoxie- und Druckschwankungen führen zu Sympathikusaktivierung, pulmonaler Hypertonie und arterieller Hypertonie. Sie erhöhen das Risiko für rechtsventrikuläre Dysfunktion und Progression bestehender Herzinsuffizienz. Häufig tritt die OSA bei adipösen Patienten auf, besonders mit HFpEF.
- Chronisch obstruktive Lungenerkrankung (COPD): Sie führt über Hypoxie und pulmonale Hypertonie zu chronischer Rechtsherzbelastung (Cor pulmonale). In Kombination mit Linksherzinsuffizienz ist sie oft schwer differenzierbar. Es besteht ein stark erhöhtes Risiko für eine akute Dekompensation.
Einteilung
Die Herzinsuffizienz lässt sich nach unterschiedlichen Kriterien klassifizieren. Dies dient der klinischen Diagnostik, Prognoseeinschätzung und Therapieplanung. Aktuelle Leitlinien empfehlen v.a. die Einteilung nach klinischem Schweregrad, linksventrikulärer Funktion und Pathophysiologie.
...nach Kompensation
Die Herzinsuffizienz lässt sich klinisch grob unterteilen in
- kompensierte Herzinsuffizienz, die nur unter Belastung Beschwerden verursacht und
- dekompensierte Herzinsuffizienz, die sich bereits in körperlicher Ruhe bemerkbar macht.
...nach NYHA
Die NYHA-Klassifikation ist international die am häufigsten verwendete Einteilung zur Beschreibung der klinischen Symptomatik. Sie beschreibt ausschließlich den klinischen Funktionsstatus und nicht die strukturelle Schwere der Herzerkrankung.
| Stadium | Symptomatik |
|---|---|
| I | Diagnostizierte Herzkrankheit ohne Symptome und ohne Einschränkung der Belastbarkeit. |
| II | Leichte Einschränkung der Belastbarkeit. Keine Symptome in Ruhe, sondern erst bei stärkerer Belastung. |
| III | Starke Einschränkung der Belastbarkeit. Keine Symptome in Ruhe, jedoch bereits bei leichter Belastung. |
| IV | Persistierende Symptomatik auch in Ruhe. |
...nach AHA/ACC
Die AHA/ACC-Klassifikation berücksichtigt die Entstehung und Progression der Herzinsuffizienz und wird häufig ergänzend zur NYHA-Klassifikation genutzt:
| Stadium | Kriterien |
|---|---|
| A | Erhöhtes Risiko für Herzinsuffizienz (z.B. Hypertonie, Diabetes, Adipositas, KHK), aber keine strukturelle Herzerkrankung und keine Symptome. |
| B | Strukturelle Herzerkrankung, die eng mit der Entstehung einer Herzinsuffizienz assoziiert ist (LV-Hypertrophie, Myokardinfarktnarbe), bisher keine Herzinsuffizienzsymptome. |
| C | Strukturelle Herzerkrankung mit aktuellen oder früheren Symptomen der Herzinsuffizienz. |
| D | Fortgeschrittene strukturelle Herzerkrankung mit schweren Herzinsuffizienzsymptomen in Ruhe trotz maximaler medikamentöser Therapie (spezielle Therapie erforderlich, z. B. Herztransplantation, Katecholamine i.v., Kunstherz) |
...nach Lokalisation
Je nach primär betroffener Herzkammer unterscheidet man:
- Linksherzinsuffizienz: Typisch bei KHK, Hypertonie, Aorten- oder Mitralklappenvitien. Klinisch vor allem pulmonale Stauung (Dyspnoe, Orthopnoe, Lungenödem).
- Rechtsherzinsuffizienz: Häufig Folge einer Linksherzinsuffizienz, Cor pulmonale oder Pulmonalklappenerkrankung. Klinisch systemische Stauung (Ödeme, Aszites, Halsvenenstauung, Hepatomegalie).
- Globalherzinsuffizienz: Kombination aus Links- und Rechtsherzinsuffizienz, häufig in fortgeschrittenen Stadien.
...nach Krankheitsverlauf
- Akute Herzinsuffizienz: Entwickelt sich im Verlauf von Stunden bis Tagen. Typische Ursachen sind: ** akutes Koronarsyndrom bzw. Myokardinfarkt
- akute Klappendestruktion oder Shuntvitium (z.B. Ventrikelseptumruptur)
- akute mechanische Behinderung der Ventrikelfüllung (z.B. Perikardtamponade)
- akute Tachy- oder Bradyarrhythmien
- akute Myokarditis
- Chronische Herzinsuffizienz: Entwickelt sich im Verlauf von Monaten bis Jahren
...nach Pathomechanismus
Diese Einteilung orientiert sich an der primären Funktionsstörung:
- Systolische Herzinsuffizienz: Verminderte Kontraktionskraft führt zu reduzierter Ejektionsfraktion. Häufig bei KHK, DCM, Myokarditis.
- Diastolische Herzinsuffizienz: Gestörte Relaxation oder erhöhte Steifigkeit des Ventrikels führt zu einer beeinträchtigen Füllung in der Diastole. Typisch bei Hypertonie, HFpEF, HCM.
In der klinischen Praxis besteht oft ein Mischbild aus systolischer und diastolischer Dysfunktion.
...nach Pathophysiologie
Diese moderne Einteilung basiert auf der linksventrikulären Ejektionsfraktion (LVEF) und ist entscheidend für die Therapie:
- HFrEF (engl.: heart failure with reduced ejection fraction): EF ≤ 40 %
- HFmrEF (eng.: heart failure with mid-range ejection fraction): EF 41–49 %
- HFpEF (engl.: heart failure with preserved ejection fraction): EF ≥ 50 % und Nachweis struktureller Herzerkrankung oder diastaolischer Dysfunktion
- HFrecEF (engl.: heart failure with recovered ejection fraction): Ursprünglich reduzierte EF, die sich unter Therapie deutlich gebessert hat (> 10 % Anstieg und > 40 %).
...nach Hämodynamik
- Vorwärtsversagen: Unzureichende Organperfusion aufgrund zu geringen Herzzeitvolumens. Klinisch: Hypotonie, Schock, Oligurie, kalte Extremitäten.
- Rückwärtsversagen: Rückstau vor den betroffenen Ventrikeln, daher pulmonale oder systemische Stauung. Klinisch: Dyspnoe, Lungenödem, Ödeme, Aszites.
In der Praxis treten Vorwärts- und Rückwärtsversagen oft kombiniert auf.
...nach Herzzeitvolumen
- Low-Output-Failure: Reduziertes Herzzeitvolumen, typisch bei systolischer Dysfunktion. Häufigste Form.
- High-Output-Failure: Herzzeitvolumen stark gesteigert, aber dennoch nicht ausreichend für den erhöhten metabolischen Bedarf. Ursachen: schwere Anämie, Thyreotoxikose, große AV-Fisteln, Beriberi.
Pathogenese
Eine Herzinsuffizienz entsteht, wenn die Pumpleistung nicht mehr ausreicht, um das Herz selbst und extrakardiale Organstromgebiete adäquat mit Blut, Sauerstoff und Substraten zu versorgen. Initial steht eine primäre Myokardschädigung oder eine chronische Druck- oder Volumenbelastung im Vordergrund. Zunächst reagiert der Herzmuskel mit kompensatorischen Anpassungsmechanismen, die eine normale Herzleistung aufrechterhalten sollen. Hierzu gehören myozytäre Hypertrophie, Steigerung der Herzfrequenz sowie eine vorübergehende neurohormonelle Aktivierung. Solange diese Mechanismen wirken, bleibt die Herzinsuffizienz klinisch kompensiert. Kommt es jedoch zu einer anhaltenden Überlastung oder fortschreitenden Myokardschädigung, werden diese Anpassungsreaktionen maladaptiv und tragen selbst zur Progression der Erkrankung bei. Histologisch finden sich:
- Hypertrophie der Kardiomyozyten als Zeichen des erhöhten Druck- oder Volumenstresses.
- Zellverlust durch Apoptose und Nekrose, ausgelöst durch Ischämie, oxidativen Stress und Entzündungsprozesse.
- Fibrose und Umbau der extrazellulären Matrix, welche die diastolische Relaxation beeinträchtigen.
Diese strukturellen Veränderungen führen zum sogenannten ventrikulären Remodelling, also einer dauerhaften morphologischen und funktionellen Umgestaltung des Herzens. Die linksventrikuläre Dilatation verstärkt sich selbst, da die erhöhte Wandspannung (Laplace-Gesetz) den Sauerstoffbedarf des Myokards steigert und die Pumpkraft weiter sinkt, sodass ein Circulus vitiosus entsteht. Im weiteren Verlauf kommt es zu einer Aktivierung des neuroendokrinen Systems (Sympathikus, RAAS, ADH), die anfangs kompensatorisch wirkt, langfristig jedoch eine zentrale Rolle bei der Verschlechterung der Herzinsuffizienz spielt.
Pathophysiologie
Die klinischen Manifestationen der Herzinsuffizienz resultieren aus einem komplexen Zusammenspiel von hämodynamischen Störungen, neurohormoneller Aktivierung, zellulären Umbauprozessen und systemischen Veränderungen. Was zunächst eine kompensatorische Anpassung des Organismus an eine eingeschränkte Pumpfunktion ist, entwickelt sich bei chronischer Aktivierung zu einem selbstverstärkenden Kreislauf, der die Herzinsuffizienz fortschreiten lässt.
Hämodynamische Störung
Das Herzzeitvolumen kann nicht mehr an die Anforderungen des Körpers angepasst werden. Es kommt zu zwei pathophysiologischen Prozessen:
- Vorwärtsversagen: unzureichende Organperfusion
- Rückwärtsversagen: Rückstau vor den betroffenen Herzkammern
- Linksherzinsuffizienz → pulmonaler Rückstau → Lungenstauung, Dyspnoe, Orthopnoe, Lungenödem.
- Rechtsherzinsuffizienz → systemischer Rückstau → Ödeme, Aszites, Stauungsleber, Halsvenenstauung.
In der klinischen Realität treten Vorwärts- und Rückwärtsversagen häufig kombiniert auf.
Neuroendokrine Aktivierung
Die neuroendokrine Aktivierung kann die Funktionsminderung in der Frühphase der Herzinsuffizienz auffangen. In späteren Krankheitsstadien führen die Kompensationsmechanismen jedoch zu einer Verschlechterung der hämodynamischen Situation und verstärken die Krankheitsdynamik, sodass therapeutisch interveniert werden muss.
Sympathikusaktivierung und Katecholaminausschüttung
Sympathikusaktivierung und Katecholaminausschüttung (Noradrenalin) führen anfangs zur Steigerung der Herzfrequenz (chronotrop) und der Kontraktionskraft (inotrop). Gleichzeitig erhöht sich der periphere Gefäßwiderstand (Afterload). Die chronische Katecholaminexposition führt zu
- Reduktion der Zahl der kardialen Betarezeptoren (Downregulation).
- erhöhtem myokardialen Sauerstoffverbrauch
- induzierter Apoptose der Kardiomyozyten
- arrhythmogener Wirkung.
Aktivierung des RAA-Systems
Die reduzierte Nierenperfusion aktiviert das Renin-Angiotensin-Aldosteron-System: Die erhöhte Bildung von Angiotensin II resultiert in einer Vasokonstriktion und Erhöhung der Nachlast. Dieser Effekt wird durch Aldosteron verstärkt, das eine Natrium- und Wasserretention und somit eine Erhöhung der Vorlast sowie eine Verstärkung der Ödeme und Lungenstauung bewirkt. Außerdem stimuliert Aldosteron die kardiale Fibrosierung, was die diastolische Funktion verschlechtert.
ADH-Aktivierung
Bei niedriger Herzleistung wird verstärkt ADH (Vasopressin) freigesetzt. Es fördert die Wasserretention unabhängig von Natrium. Die Folgen sind Hyponatriämie und Hypervolämie, somit Erhöhung der Vorlast, Ödeme, Pleuraergüsse und Aszites.
Endotheliale Dysfunktion und andere Mediatoren
Die erhöhte Produktion von Endothelin-1 (potenter Vasokonstriktor) und entzündlichen Zytokinen (TNF-α, IL-6) verschlechtert die periphere Perfusion und fördert die Myokardschädigung. Die chronische Inflammation begünstigt den Katabolismus und die kardiale Kachexie.
Natriuretische Peptide
Die Natriuretischen Peptide (NP) sind die wichtigsten Gegenspieler des Renin-Angiotensin-Aldosteron-Systems (RAAS):
- ANP (atrial natriuretic peptide) - Stimulierung der Natriurese
- BNP (brain natriuretic peptide) - Stimulierung der Natriurese, bei höheren Konzentrationen Stimulierung des renalen Blutflusses und der GFR (Glomeruläre Filtrationsrate)
- CNP (C-type natriuretic peptide) - Regulation Gefäßtonus (Vasodilatation)
- DNP (dendroaspis natriuretic peptide) - Hemmung der tubulären Natriumrückresorption
- Urodilatin - Hemmung der tubulären Natriumrückresorption
Mit ihrer Hauptfunktion, der Reduktion des Plasmavolumens und der Senkung des Blutdrucks, schützen sie das gesunde Herz vor einer übermäßigen Volumen- und Druckbelastung. NPs werden z.B. bei erhöhtem Druck und durch Überdehnung der Vorhöfe ausgeschüttet. BNP und sein biologisch inaktives Signalpeptid NT-proBNP sind daher bei Herzinsuffizienz ein guter Parameter zur Diagnosesicherung und Prognoseabschätzung.
Ventrikuläres Remodelling
Das ventrikuläre Remodelling bezeichnet den strukturellen und funktionellen Umbau des Herzens als Reaktion auf chronische Überlastung. Man unterscheidet:
- Exzentrische Hypertrophie: durch Volumenbelastung (z.B. Mitralinsuffizienz, Aorteninsuffizienz). Gekennzeichnet durch Dilatation der Herzkammern und Hypertrophie in Serie. Führt langfristig zu systolischem Pumpversagen.
- Konzentrische Hypertrophie: durch Druckbelastung (z.B. Aortenstenose, arterielle Hypertonie). Gekennzeichnet durch Verdickung der Ventrikelwand ohne initiale Dilatation. Führt primär zu diastolischer Dysfunktion (HFpEF).
Auf molekularer Ebene entsteht das Remodeling durch Aktivierung von Fibroblasten, die vermehrt Kollagen synthetisieren und somit eine Myokardfibrose bedingen. Außerdem spielt die Apoptose und Nekrose der Kardiomyozyten sowie eine "fetale Gen-Expression" (z.B. Reaktivierung von β-MHC eine Rolle.
Systemische Folgen
Die chronische Herzinsuffizienz betrifft nicht nur das Herz, sondern führt zu Funktionsstörungen vieler anderer Organe bzw. Organsysteme:
- Nieren: prärenales Nierenversagen, kardiorenales Syndrom.
- Lunge: pulmonale Stauung, Pleuraergüsse, sekundäre pulmonale Hypertonie.
- Leber: Stauungshepatopathie, Leberfibrose ("Cirrhose cardiaque").
- Skelettmuskulatur: Muskelschwund, reduzierte mitochondriale Kapazität, belastungsabhängige Fatigue.
- Metabolisch: Insulinresistenz, Dyslipidämie, sekundärer Hyperaldosteronismus.
- Kachexie: Gewichtsverlust > 6 % durch Katabolismus und Entzündungsprozesse.
Symptome
Die Symptomatik der Herzinsuffizienz ist sehr vielgestaltig und hängt vom betroffenen Herzabschnitt, der Schwere der Erkrankung sowie der zugrunde liegenden Ursache ab. Frühe Stadien bleiben oft asymptomatisch oder zeigen nur unspezifische Zeichen wie Leistungsminderung. Im fortgeschrittenen Verlauf treten charakteristische kardiale und systemische Symptome auf, die häufig von Beschwerden der Grunderkrankung überlagert werden.
Kardiale Leitsymptome
Dyspnoe
Die Dyspnoe ist das Leitsymptom der Herzinsuffizienz. Sie entsteht durch eine pulmonale Stauung und ein interstitielles Lungenödem bei Linksherzinsuffizienz. Es wird unterschieden zwischen:
- Belastungsdyspnoe: Frühsymptom, zunächst nur bei stärkerer körperlicher Anstrengung.
- Ruhedyspnoe: Zeichen fortgeschrittener Herzinsuffizienz (NYHA III–IV).
- Orthopnoe: Auftreten oder Zunahme der Atemnot im Liegen, Besserung im Sitzen; häufiges nächtliches Symptom.
- Paroxysmale nächtliche Dyspnoe (PND): plötzliche schwere Atemnotattacken in der Nacht, durch Rückfluss von Ödemen aus den Beinen ins Lungengefäßsystem.
- Bendopnoe: Atemnot beim Vorbeugen, z.B. beim Schuhe binden – relativ spezifisch für fortgeschrittene Herzinsuffizienz.
Müdigkeit und reduzierte Leistungsfähigkeit
Müdigkeit und reduzierte Leistungsfähigkeit sind Folge eines Vorwärtsversagens mit unzureichender Organperfusion und eingeschränkter Skelettmuskelfunktion. Patienten berichten über rasche Erschöpfung, Schwäche, Lethargie und eingeschränkte Belastbarkeit selbst bei Alltagsaktivitäten.
Flüssigkeitsretention und Ödeme
Ödeme stellen zentrales Symptom dar, besonders bei Rechtsherzinsuffizienz und globaler Herzinsuffizienz:
- Periphere Ödeme: zunächst Knöchel- und Unterschenkelödeme, im Verlauf generalisiert.
- Aszites: fortgeschrittene systemische Stauung mit Bauchumfangszunahme und Völlegefühl.
- Gewichtszunahme: rasch bei Volumenretention, dient in der klinischen Praxis als Verlaufsparameter.
- Nykturie: verstärkte nächtliche Urinausscheidung durch Umlagerung von Flüssigkeit im Liegen.
Palpitationen, Schwindel, Synkopen
- Palpitationen: häufig durch Vorhofflimmern oder ventrikuläre Tachykardien.
- Schwindel/Synkopen: Ausdruck von niedrigem Herzzeitvolumen, arrhythmogen oder medikamentenbedingt.
Pulmonale Symptome
- Trockener Reizhusten: besonders nachts oder im Liegen. Folge der interstitiellen Lungenstauung und vermehrter Flüssigkeit im Bronchialsystem.
- Nächtliche Dyspnoe und Hustenanfälle: häufig frühes Symptom.
- Hämoptysen: selten, bei starkem Lungenstau und Ruptur kleiner Gefäße.
Gastrointestinale und abdominale Symptome
Bei Rechtsherzinsuffizienz und systemischem Rückstau:
- Stauungsgastritis: Appetitlosigkeit, Übelkeit, Völlegefühl, epigastrische Schmerzen.
- Hepatomegalie und Druckschmerz: durch Stauungsleber.
- Meteorismus und Obstipation: durch Darmhypoperfusion und Stauung.
- Abdominelle Schmerzen: bei Leberkapselspannung oder Aszites.
- Gewichtsverlust/Kachexie: im Spätstadium durch chronische Entzündung und Katabolismus.
Neurologische und kognitive Symptome
Neurologische und kognitive Symptome finden sich häufig bei älteren Patienten mit fortgeschrittener Herzinsuffizienz. Sie sind Ausdruck einer eingeschränkten zerebralen Perfusion. Symptome sind:
Vegetative Symptome
Vegetative Symptome treten häufig bei fortgeschrittener Herzinsuffizienz und begleitend zu nächtlichen Dyspnoeattacken auf. Die Folgen der Sympathikusaktivierung sind:
Unspezifische Frühsymptome
Zu Beginn können die Beschwerden sehr unspezifisch sein:
- Leistungsknick, reduzierte Belastungstoleranz.
- Allgemeines Krankheitsgefühl, Müdigkeit.
- Geringe Belastungsdyspnoe, die oft fälschlich als Trainingsmangel interpretiert wird.
- Frühe Wasserretention oft nur am Gewicht erkennbar.
Symptomkonstellationen nach Lokalisation
- Linksherzinsuffizienz: Dyspnoe, Orthopnoe, paroxysmale nächtliche Dyspnoe, Husten, Lungenödem, Zyanose
- Rechtsherzinsuffizienz: Ödeme, Aszites, Nykturie, Stauungsleber, Stauungsgastritis, Völlegefühl, Appetitverlust
- Globale Herzinsuffizienz: Kombination aus beiden oben genannten Symptomgruppen
Diagnostik
Die Diagnostik der Herzinsuffizienz verfolgt drei zentrale Ziele:
- Bestätigung der Diagnose und Einschätzung der Schwere der Erkrankung,
- Abklärung der Ätiologie und möglicher auslösender Faktoren,
- Erkennung von Komorbiditäten und Verlaufsparameter zur Prognoseeinschätzung.
Körperliche Untersuchung
Die körperliche Untersuchung kann bereits wertvolle Hinweise auf das Vorliegen einer Herzinsuffizienz liefern. Sie dient sowohl der Diagnosestellung als auch der Abschätzung der Stauungssituation und des Schweregrades. Typische Befunde:
- Erhöhter Jugularvenendruck: sichtbar bei 45° Oberkörperhochlagerung, Zeichen systemischer Stauung.
- positiver hepatojugulärer Reflux, Hepatomegalie: Ausdruck der Rechtsherzinsuffizienz.
- Verlagerter und verbreiterter Herzspitzenstoß: Hinweis auf Linksherzvergrößerung oder Dilatation.
- Dritter Herzton (S3): typisch bei fortgeschrittener systolischer Dysfunktion.
- Pulmonale Rasselgeräusche, die nach Husten nicht verschwinden: Zeichen einer Lungenstauung oder eines Lungenödems.
- Tachykardie, irregulärer Puls, Tachypnoe (> 20/Min.).
- Periphere Ödeme, zunächst Knöchel- und Unterschenkelödeme, bei Bettlägerigkeit sakral. Kardiale Ödeme sind weich und leicht eindrückbar – im Gegensatz zu Lymphödemen.
- Pleuraergüsse, Aszites und Gewichtszunahme bei fortgeschrittener systemischer Stauung.
- Zeichen von Kachexie, Zyanose, kalte Extremitäten bei reduziertem Herzzeitvolumen.
Apparative Diagnostik
Die apparative Diagnostik dient der Funktionsbeurteilung, Ursachenklärung und Prognoseeinschätzung.
EKG
- Basis-EKG: Erfassung von Rhythmusstörungen (z.B. Vorhofflimmern, ventrikuläre Tachykardien). Nachweis von Infarktnarben, Hypertrophiezeichen, Leitungsstörungen (z.B. Linksschenkelblock).
- Belastungs-EKG: Beurteilung der Belastbarkeit und Nachweis belastungsinduzierter Ischämien. Bei fortgeschrittener Herzinsuffizienz oft nicht durchführbar.
Bildgebung
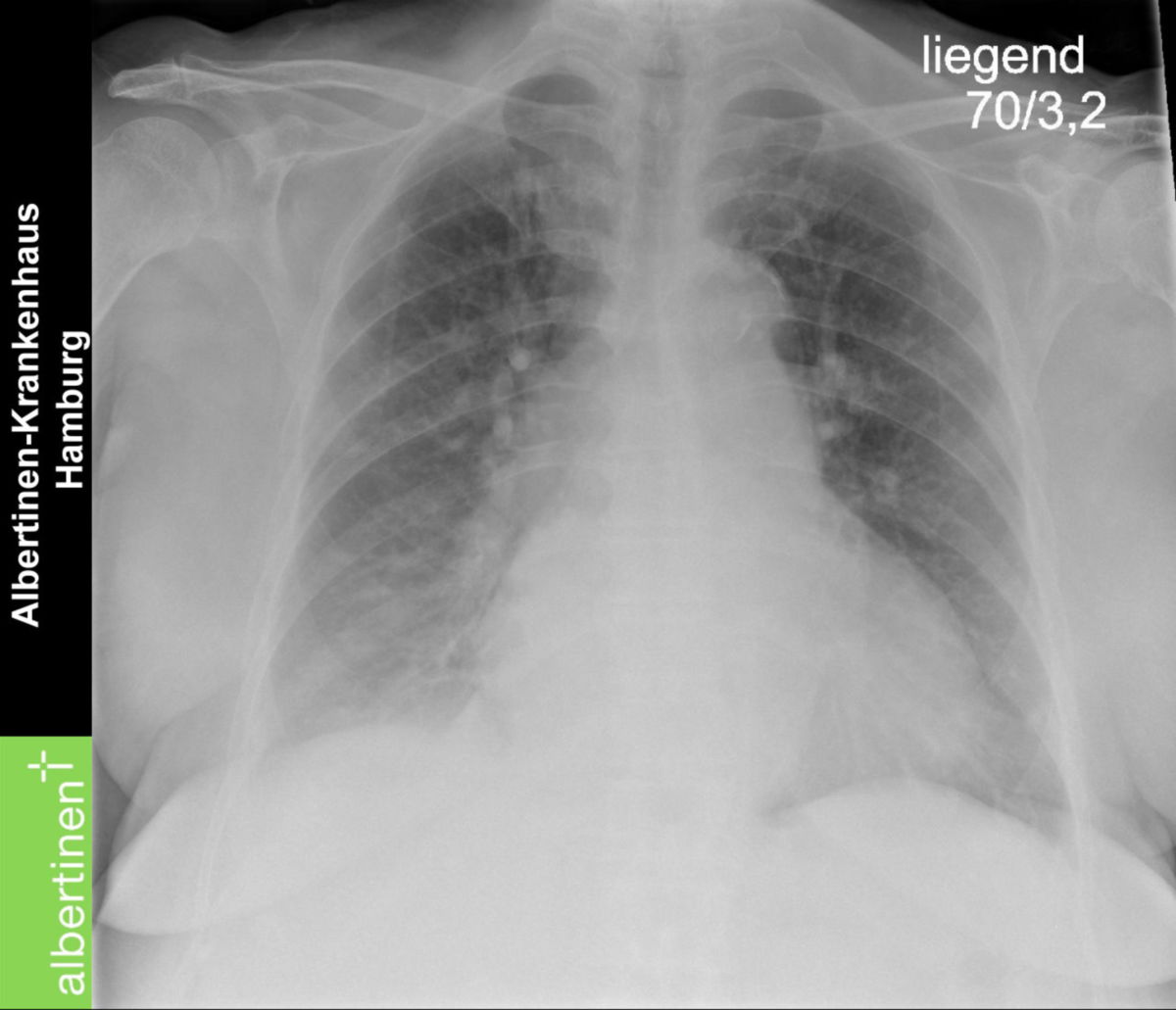
- Röntgen-Thorax: Beurteilung von Herzgröße (Herz-Thorax-Quotient), pulmonaler Stauung (vermehrte Gefäßzeichnung, Kerley-B-Linien), Pleuraergüssen, interstitiellem oder alveolärem Lungenödem.
- Echokardiographie: Beurteilung der systolischen und distaolischen Funktion, Bestimmung der Ejektionsfraktion, Detektion von Klappenvitien, Wandbewegungsstörungen und Myokarddicke. Myokardiale Strain-Analyse (Früherkennung subtiler Funktionsstörungen)
- Stress-Echokardiographie: Nachweis von Wandbewegungsstörungen und Ischämien oder Beurteilung der Kontraktilitätsreserve.
- Kardio-MRT: Goldstandard zur quantitativen Ventrikelfunktionsanalyse und Gewebecharakterisierung (z.B. Narben, Myokarditis, Amyloidose).
Labordiagnostik
Laboruntersuchungen dienen nicht nur der Diagnose, sondern auch der Ätiologieabklärung, Therapiekontrolle und Prognoseeinschätzung. Schlüsselmarker bei Verdacht auf eine Herzinsuffizienz sind BNP bzw. NT-proBNP. Hohe Werten stützen die Diagnose, niedrige Werte schließen sie weitgehend aus. Der Normbereich ist vom Alter und Geschlecht abhängig. Wichtige Einflussfaktoren sind:
- falsch-niedrig: Adipositas mit BMI > 30
- falsch-hoch: Niereninsuffizienz, COPD, Myokarditis, Lungenembolie.
BNP dient auch als Prognosemarker und dient der Therapiekontrolle.
In der Akutsituation wird außerdem eine Blutgasanalyse (BGA) durchgeführt. Sie dient der Beurteilung der arteriellen Oxygenierung und des Säure-Basen-Status bei Dyspnoe und vermuteter pulmonaler Beteiligung.
Empfohlene Laboruntersuchungen bei V.a. Herzinsuffizienz
| Untersuchungsverfahren | Begründung |
|---|---|
| Blutbild |
|
| Harnstoff und Kreatinin |
|
| Ferritin und Transferrinsättigung (TSAT) |
|
| Elektrolyte |
|
| y-GT (ggf. GOT, GPT) |
|
| TSH |
|
| Gesamteiweiß, Albumin |
|
| Blutuntersuchungen, die für seltenere und speziellere Fragestellungen eingesetzt werden können: | |
| Glucose, HbA1c |
|
| CK, LDH, Troponin |
|
| Cholesterin, HDL, LDL, Triglyzeride |
|
| Virustiter |
|
| Autoantikörper |
|
| Kälteagglutinine |
|
Invasive Diagnostik
- Koronarangiographie (Herzkatheter-Untersuchung): Nachweis oder Ausschluss einer obstruktiven KHK mit der Möglichkeit zur sofortigen Intervention von Stenosen (PTCA, Ballondilatation und ggf. Stenteinlage). Fast immer empfohlen bei Patienten < 85 Jahren mit neu diagnostizierter systolischer Herzinsuffizienz (Alternativ: Kardio-CT).
- Myokardbiopsie: nur bei unklarer Genese oder Verdacht auf spezifische Erkrankungen wie Myokarditis, Amyloidose, Speicherkrankheiten.
Differenzialdiagnosen
Bei Dyspnoe und Ödemen müssen andere Ursachen ausgeschlossen werden:
- COPD, Asthma bronchiale, interstitielle Lungenerkrankungen (ILD)
- Nephrotisches Syndrom, Leberzirrhose, Hypoproteinämie.
- Anämie, Sepsis, Thyreotoxikose (High-Output-Failure).
- Adipositas-Hypoventilationssyndrom, obstruktive Schlafapnoe.
Therapie
Die Therapie der Herzinsuffizienz zielt darauf ab, Symptome zu lindern, Lebensqualität zu verbessern, Krankenhausaufenthalte zu reduzieren und vor allem die Mortalität zu senken.
Sie basiert auf drei Säulen:
- Behandlung der Grunderkrankung und Beseitigung auslösender Faktoren,
- nicht-medikamentöse Basismaßnahmen,
- leitliniengerechte Pharmakotherapie und apparative/interventionelle Verfahren.
Risikokontrolle und Behandlung der Grunderkrankung
Bevor eine reine Herzinsuffizienztherapie beginnt, müssen ursächliche Erkrankungen erkannt und behandelt werden:
- Kontrolle einer arteriellen Hypertonie (Ziel < 130/80 mmHg)
- Revaskularisation bei nachweisbarer ischämischer KHK (PCI, Bypass-Operation)
- Behandlung hämodynamisch relevanter Herzklappenfehler (operativer Klappenersatz, TAVI, MitraClip).
- Schrittmachertherapie bzw. antiarrhythmische Therapie bei arrhythmieinduzierter Herzinsuffizienz
- Korrektur von endokrinen Störungen (z.B. Hyperthyreose)
- Anämiediagnostik und -korrektur
- Alkoholentzugsbehandlung bei alkoholtoxischer Kardiomyopathie
- Therapie von Perikarderkrankungen (z.B. Perikardektomie bei konstriktiver Perikarditis)
- Behandlung von Begleiterkrankungen wie Diabetes, COPD, Schlafapnoe.
Basistherapie
Die nicht-medikamentöse Basistherapie der Herzinsuffizienz besteht aus einer Reihe von Allgemeinmaßnahmen, welche die Arbeitslast des Herzens reduzieren, das Volumenmanagement verbessern und die Prognose unterstützen:
- Gewichtsreduktion bei Adipositas
- Kochsalzreduktion: ca. 5–6 g NaCl pro Tag; bei schwerer HI < 3 g
- Flüssigkeitsrestriktion auf 1,5–2 Liter/Tag bei fortgeschrittener Herzinsuffizienz oder Hyponatriämie.
- Alkohol- und Tabakrestriktion.
- Tägliche Gewichtskontrolle: frühzeitige Erkennung von Volumenüberladung.
- Angepasste körperliche Aktivität: moderates Training verbessert Belastbarkeit und Prognose.
- Schulung und Patientenedukation: Erkennen von Warnzeichen, richtige Medikamenteneinnahme, Selbstmanagement.
- Grippe- und Pneumokokkenimpfung, COVID-19-Impfung.
- Behandlung von Schlafapnoe, ggf. CPAP-Therapie.
Medikamentöse Therapie
Die Pharmakotherapie richtet sich primär nach der linksventrikulären Ejektionsfraktion (LVEF) und dem klinischen Stadium. Für die HFrEF (LVEF ≤ 40 %) sind vier Wirkstoffgruppen grundlegend und sollten leitliniengerecht jedem Patienten frühzeitig verordnet werden (ESC 2021, DGK 2021):
| Wirkstoffgruppe | Wirkstoffe (Auswahl) | Indikation | Besonderheiten |
|---|---|---|---|
| ACE-Hemmer | Enalapril, Ramipril, Lisinopril | NYHA I-IV: Bei allen Patienten mit LVEF < 40 % auch ohne Symptome | Mittel der Wahl, senken Mortalität und Hospitalisierungsrate um bis zu 25 %. |
| Angiotensin-Rezeptor-Neprilysin-Inhibitor (ARNI) | Sacubitril (in Kombination mit Valsartan) | NYHA II-IV: bei persistierenden Symptomen trotz ACE-Hemmer oder initial als primäre Option | Überlegen wirksamer als ACE-Hemmer (PARADIGM-HF-Studie). 36 Std. ACE-Hemmer-Pause vor Umstellung nötig; hohe Kosten |
| Betablocker | Bisoprolol, Carvedilol, Metoprolol-Succinat, Nebivolol | NYHA I: nach Myokardinfarkt oder bei tachykarden Rhythmusstörungen | Reduzieren Mortalität und plötzlichen Herztod; einschleichen; bei Dekompensation nicht beginnen |
| NYHA II-IV: bei allen Patienten mit symptomatischer HFrEF | |||
| Aldosteronantagonisten bzw. Mineralokortikoid-Rezeptorantagonisten (MRAs) | Spironolacton, Eplerenon | NYHA II-IV: bei Patienten mit persistierenden Symptomen trotz ACE-Hemmer/Betablocker | Reduzieren Mortalität und verhindern Remodelling; Vorsicht bei Hyperkaliämie oder eGFR < 30 ml/min |
| SGLT-2-Inhibitoren | Dapagliflozin, Empagliflozin | NYHA II-IV: bei allen Patienten mit HFrEF, unabhängig vom Diabetesstatus | Reduzieren Mortalität und Hospitalisierungen (DAPA-HF, EMPEROR-Reduced)[2] |
Erweiterte medikamentöse Optionen sind:
| Wirkstoffgruppe | Wirkstoffe (Auswahl) | Indikation | Besonderheiten |
|---|---|---|---|
| sGC-Stimulator | Vericiguat | NYHA II-IV: bei HFrEF nach kürzlicher Dekompensation trotz optimaler Standardtherapie | Reduktion von Rehospitalisierungen (VICTORIA-Studie) |
| Kombination aus ISDN und Hydralazin | - | NYHA II-IV: bei Intoleranz gegenüber ACE-Hemmer/ARNI/AT1-Blocker oder zusätzlich bei schwarzer Ethnie mit persistierenden Symptomen | Prognoseverbesserung v.a. bei afrikanischstämmigen Patienten (A-HeFT-Studie) |
| Diuretika (Schleifen-, Thiazid- oder Kombination) | Furosemid, Torasemid, Xipamid | bei Stauungszeichen unabhängig vom NYHA-Stadium | Nur zur Symptomlinderung, kein Einfluss auf Mortalität |
| Carboanhydrasehemmer | Acetazolamid | Akute Dekompensation mit starker Überwässerung (NYHA IV, stationär) | beschleunigt Entstauung in Kombination mit Schleifendiuretikum |
| Herzglykoside | Digoxin, Digitoxin | bei tachykardem Vorhofflimmern + HFrEF: Frequenzkontrolle, wenn Betablocker nicht ausreichen oder kontraindiziert sind | Nur Symptomkontrolle; kein Einfluss auf Mortalität |
| Reservemedikament bei therapierefraktärer HI mit NYHA III-IV | |||
| GLP-1-RA | Semaglutid | bei HFpEF + Adipositas (v.a. BMI > 30) | verbessert Symptome und Gewichtsreduktion; Daten zu harten Endpunkten noch (2025) limitiert |
| Myosin-Aktivatoren | Omecamtiv-Mecarbil. | Experimentell, derzeit nur in Studien | Kann systolische Pumpkraft steigern ohne den Sauerstoffbedarf zu erhöhen |
| Phosphodiesterase-III-Hemmstoffe | Milrinon | Einsatz nur kurzfristig bei akut dekompensierter HI/Low-Output als Überbrückung | nicht nicht zur Dauertherapie |
Pharmaka, die bei Herzinsuffizienz vermieden werden sollen
- Kalziumantagonisten vom Nifedipin-, Verapamil- und Diltiazem-Typ, da negativ inotrop. Ausnahme sind langwirksame Dihydropyridine (z.B. Amlodipin) bei gleichzeitig symptomatischer Angina pectoris oder Hypertonie.
- Nichtsteroidale Antirheumatika (NSAR) inkl. COX-2-Hemmer (cave Selbstmedikation!), da Natrium- und Wasserretention sowie Risiko für Nierenfunktionsverschlechterung. Ausnahme: niedrig dosierte Acetylsalicylsäure (ASS) bei KHK oder pAVK
- Antiarrhythmika Klasse I und III (Ausnahme Amiodaron), da stark negativ inotrop und proarrhythmogen.
- Carbamazepin: Nur wenn unbedingt notwendig und unter strenger Kontrolle, da negativ inotrop, Bradykardie, Hyponatriämie.
- trizyklische Antidepressiva: möglichst vermeiden, da QT-Verlängerung, Tachyarrhythmien und negativ inotrop.
- Azol-Antimykotika (z.B. Itraconazol): kontraindiziert, da negativ inotrop und Risiko für schwere Dekompensation
- Alpha-Blocker (z.B. Doxazosin, Terazosin): nur als letzte Option bei Hypertonie, da periphere Vasodilatation mit folglicher Hypotonie, reflektorischer Tachykardie und Flüssigkeitsretention
- Thiazolidindione (Glitazone) (z.B. Pioglitazon): nicht einsetzen bei bestehender Herzinsuffizienz da starke Flüssigkeitsretention und Dekompensationsgefahr
- Metformin: erhöhte Gefahr der Laktatazidose bei schwerer Niereninsuffizienz, Hypoxie und akuter Dekompensation bzw. schwerer HI (NYHA III-IV)
- Hochdosierte Glukokortikoide: nur wenn zwingend notwendig, da Natrium- und Wasserretention mit folglicher Volumenbelastung
- Unkontrollierte Phytopharmaka und Nahrungsergänzungsstoffe, da unvorhersehbare Effekte und Medikamenteninteraktionen
Herzunterstützungssysteme
Indikationen eines implantierbaren Kardioverter-Defibrillator (ICD) sind:
- Primärprävention: LV-EF < 35 % trotz mindestens 3 Monate optimaler medikamentöser Therapie
- Sekundärprävention: nach überlebtem plötzlichen Herztod oder dokumentierten ventrikulären Tachykardien bzw. Kammerflimmern.
Die kardiale Resynchronisation durch biventrikuläre Schrittmachersysteme ist indiziert bei Patienten mit einer LV-EF < 35 %, NYHA II-IV, erhaltenem Sinusrhythmus und QRS > 150 ms mit Linksschenkelblock. Bei QRS 130–149 ms kann eine CRT erwogen werden.
Weitere Therapien sind:
- CardioMEMS: implantierter Pulmonalarteriendrucksensor zur frühzeitigen Dekompensationswarnung
- Linksventrikuläre Unterstützungssysteme (LVAD): Überbrückung zur Transplantation oder als Dauerlösung
Chirurgische Optionen
- Ventrikelreduktionsplastik bei schwerer Dilatation
- Klappenoperationen oder minimalinvasive Klappeninterventionen
- Herztransplantation: Ultima ratio bei terminaler Herzinsuffizienz ohne andere Option. Aufgrund des Mangels an geeigneten menschlichen Spenderorganen, wird experimentell auch die Transplantation gentechnisch veränderter xenogener Organe (Schweineherz) erprobt.
Besonderheiten bei HFmrEF und HFpEF
Die Evidenzlage zur Therapie der Herzinsuffizienz ist am stärksten für die HFrEF (LVEF ≤ 40 %). Für HFmrEF und HFpEF sind die Studiendaten schwächer, jedoch liegen mittlerweile auch hier relevante Ergebnisse vor, insbesondere für SGLT2-Inhibitoren.
HFmrEF
HFmrEF stellt ein Übergangsspektrum zwischen HFrEF und HFpEF dar. Aktuelle Leitlinien empfehlen, Patienten mit HFmrEF grundsätzlich wie HFrEF zu behandeln, da Subgruppenanalysen einen ähnlichen, wenn auch abgeschwächten Nutzen zeigen.
- SGLT2-Inhibitoren (Empagliflozin, Dapagliflozin): Stärkste Evidenz für diese Gruppe. In der EMPEROR-Preserved-Studie zeigte sich eine signifikante Reduktion von kardiovaskulärem Tod und Hospitalisierung bereits im Bereich LVEF 40–49 %. Sollten bei allen HFmrEF-Patienten mit Symptomen eingesetzt werden.
- ARNI (Sacubitril/Valsartan): Moderate Evidenz aus der PARAGON-HF-Studie. Besonders wirksam bei LVEF nahe 40 %, bei Frauen und bei Patienten mit arterieller Hypertonie.
- ACE-Hemmer und AT1-Blocker: Evidenz primär aus älteren Studien und Subgruppenanalysen. Nutzen v.a. bei EF nahe 40 % und/oder bei begleitender KHK oder Hypertonie.
- Betablocker: Moderate Evidenz. Deutlicher Nutzen vor allem bei EF nahe 40 % oder gleichzeitigem Vorhofflimmern.
- Spironolacton: Hinweise auf einen Vorteil, insbesondere in Subgruppen mit EF 40–49 % und erhöhtem BNP
HFpEF
Lange galt HFpEF als therapieresistent, da klassische Herzinsuffizienzmedikamente in dieser Gruppe keine Mortalitätsvorteile zeigten. Neuere Studien – insbesondere EMPEROR-Preserved (2021) und DELIVER (2022) – haben erstmals wirksame Therapieansätze identifiziert. Therapieziele sind:
- Prognoseverbesserung mittels SGLT2-Inhibitoren. Erste Wirkstoffgruppe mit klarer Evidenz. Reduktion des kombinierten Endpunkts aus kardiovaskulärem Tod und Hospitalisierung. Sollten bei allen HFpEF-Patienten mit Symptomen eingesetzt werden
- Symptomlinderung mittels Diuretika bei Volumenüberladung und Stauungssymptomen: Einzige Maßnahme mit gesichertem symptomatischem Nutzen.
- Konsequente Behandlung von Komorbiditäten (Hypertonie, Vorhofflimmern, Adipositas, Diabetes mellitus, Schlafapnoe, COPD, Anämie, Niereninsuffizienz)
- HFpEF-spezifische Optionen (individuell):
- ARNI: In PARAGON-HF moderater Nutzen v.a. bei EF im Bereich 50–57 %, Frauen und Hypertonie.
- Spironolacton: TOPCAT-Studie zeigte Vorteile in Subgruppen mit leichter EF-Reduktion und hohen BNP-Werten. Kann bei ausgewählten Patienten erwogen werden.
Quiz
Leitlinien
Literatur
- Fischer, Denise / Kindermann, I. u.a.: Kognitive Einschränkungen bei Herzinsuffizienz. In: herzmedizin 26 (2009). H.2, S.63-68. Volltext abrufen
- Leitlinie: Evidenzbasierte Leitlinie zu Diagnose und Therapie der Herzinsuffizienz (evidence.de, Universität Witten/Herdecke)
Quellen
- ↑ Epidemiologie, Risiko- und Prognosefaktoren. NVL Chronische Herzinsuffizienz, 3. Aufl., Abgerufen am 22.08.2023
- ↑ Anker et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction New England Journal of Medicine 2021
Bildquelle
- Bildquelle Flexikon-Quiz: ©Herbert Goetsch / Unsplash
- Bildquelle für Flexikon-Quiz II: © Designed by Freepik