Glukokortikoid
von altgriechisch: γλυκυσ ("glykys") - süß und lateinisch: cortex - Rinde
Synonyme: Glucocorticoid, Glucocortin, Glukokortikosteroid, umgangssprachlich "Cortison"
Englisch: glucocorticoid
Definition
Glukokortikoide gehören zu den Hormonen, genauer gesagt zu den Steroidhormonen. Der Name weist einerseits auf die Herkunft der natürlichen Glukokortikoide (die Nebennierenrinde), andererseits auf eine ihrer Wirkungen (die Beeinflussung des Glukosestoffwechsels) hin.
Physiologie
Synthese
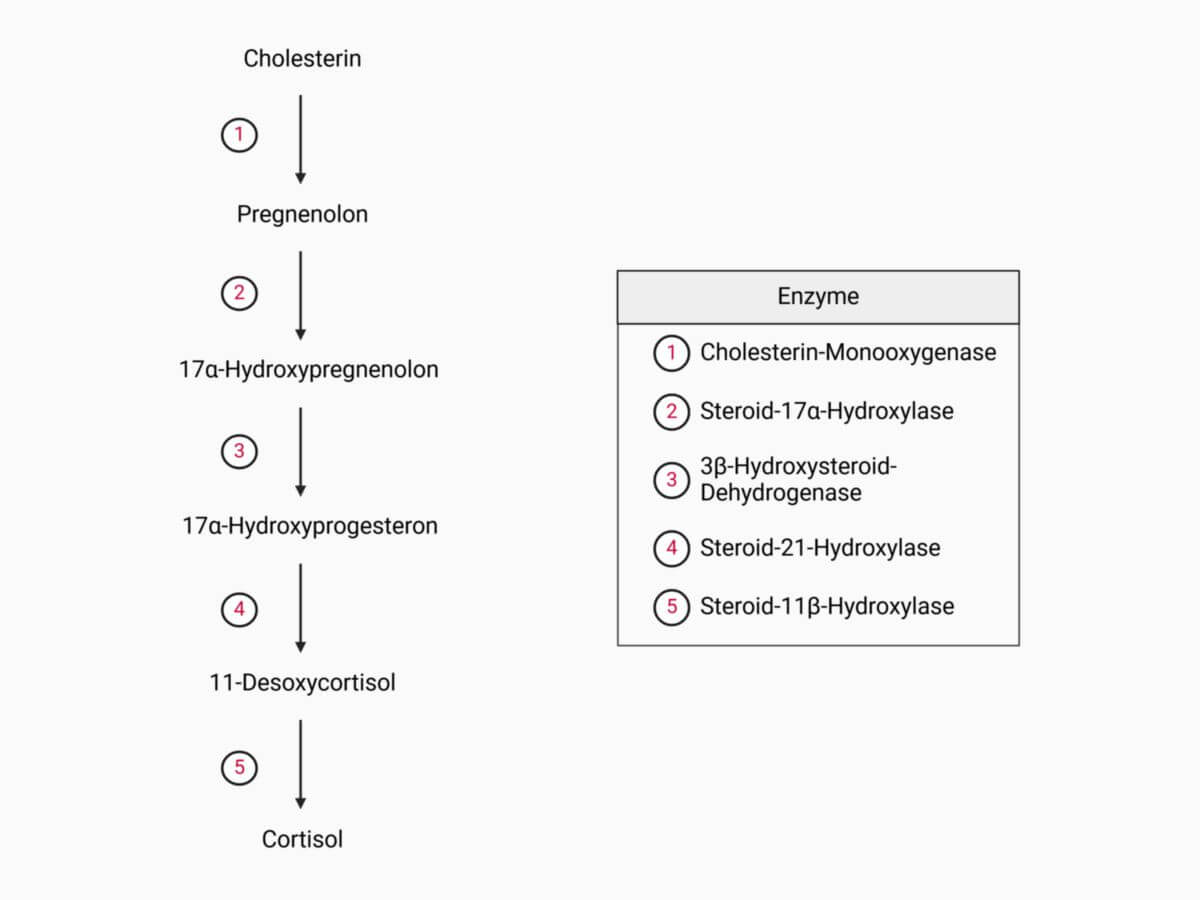
Die Ausgangssubstanz der natürlichen Glukokortikoide ist das Cholesterin, das entweder aus der Nahrung stammt oder aus Acetyl-CoA in der Leber gebildet wird. Cortisol entsteht dann über die Zwischenstufen Pregnenolon, Progesteron, 17-Hydroxyprogesteron und 11-Desoxycortisol in den Mitochondrien und im endoplasmatischen Retikulum der Zona fasciculata der Nebennierenrinde.
Die Synthese der Glukokortikoide im Körper unterliegt einer zirkadianen Rhythmik. Das Minimum der Produktion wird während des Schlafes erreicht, das Maximum in den frühen Morgenstunden.
Wirkmechanismus
Glukokortikoide beeinflussen fast alle Zellen und Organe des menschlichen Organismus. Ihre Wirkung wird intrazellulär über spezielle Glukokortikoid-Rezeptoren (GR)im Zytoplasma vermittelt. Sie kommen quasi ubiquitär vor, sind jedoch hauptsächlich in der Muskulatur, im Fettgewebe, in der Haut sowie in der Leber und im lymphatischen Gewebe zu finden. Der Glukokortikoid-Rezeptor kommt in zwei Isoformen vor, die man GRα und GRβ nennt. Nur die GRα-Variante kann das Hormon binden. Durch den aktivierten Glukokortikoid-Rezeptor wird im Zellkern die Transkription Glukokortikoid-abhängiger Gene beeinflusst.
Darüber hinaus wird die Existenz von Glukokortikoid-Rezeptoren auf der Zellmembran angenommen, welche die Wirkung über einen Second Messenger vermitteln. Diese Rezeptoren wurden in den letzten Jahren unter anderem in Leberzellen, glatten Muskelzellen, Nervengewebe sowie auf Monozyten und T-Lymphozyten nachgewiesen.
An Makrophagen konnte gezeigt werden, dass Glukokortikoide durch eine Beeinflussung des mitochondrialen Stoffwechsels eine erhöhte und anhaltende Synthese des Metaboliten Itaconat bewirken. Dieser Metabolit blockiert seinerseits die Synthese inflammatorischer Zytokine.[1]
Einteilung
Glukokortikoide lassen sich grundsätzlich in natürliche Glukokortikoide, die physiologisch im Körper vorkommen, und synthetische Glukokortikoide, die für die medikamentöse Therapie chemisch hergestellt werden, unterscheiden. Die synthetischen Glukokortikoide lassen sich weiter in halogenierte und nicht-halogenierte Substanzen differenzieren.
Hinsichtlich ihres Wirkprofil lassen sich innerhalb der synthetischen Glukokortikoide weiterhin die sogenannten dissoziativen Glukokortikoide (z.B. Vamorolon) abgrenzen.
Natürliche Glukokortikoide
Synthetische Glukokortikoide
Aufgrund der Vielzahl der verfügbaren Substanzen ist diese Aufzählung nicht vollständig.
- Halogenierte Glukokortikoide
- Nicht-halogenierte Glukokortikoide
Pharmakologie
Glukokortikoide zählen zu den katabolen Steroiden, das heißt sie mobilisieren die im Körper gespeicherten Ressourcen. Sie spielen deshalb bei der biologischen Reaktion des Körpers auf Stress eine große Rolle.
Metabolische Effekte
Glukokortikoide steigern den Blutzuckerspiegel durch verschiedene Mechanismen, z.B. durch:
- Stimulation der zellulären Glucoseproduktion (Gluconeogenese, vor allem in der Leber)
- Stimulation der Fettmobilisierung aus Adipozyten (Lipolyse)
- Stimulation der Glucagon-Sekretion
- Stimulation der Proteolyse im Muskelgewebe und Induktion von Aminotransferasen in der Leber
- Stimulation der Katecholaminsynthese
- Hemmung der zellulären Glucoseaufnahme
- Hemmung der Insulin-Sekretion
Antiphlogistische Effekte
Zu den wichtigsten pharmakologischen Eigenschaften der Glukokortikoide gehört ihre antiphlogistische bzw. antiinflammatorische Wirkung. Glukokortikoide können eine Entzündungsreaktion auf nahezu allen Ebenen hemmen, indem sie den Zellstoffwechsel der beteiligten Zellen steuern.
Als Steroidhormone sind Glukokortikoide in der Lage, die Zellmembran zu durchqueren. Sie binden intrazellulär an spezielle Glukokortikoid-Rezeptoren, mit denen sie einen Komplex bilden. Dieser Komplex beeinflusst im Zellkern die Synthese zahlreicher Proteine, die den Entzündungsprozess unterhalten. Ein zweiter Weg der Entzündungshemmung, für den die Glukokortikoide verantwortlich sind, ist die Aktivierung von Lipocortinen.
Eine wichtige Grundlage der immunsuppressiven Wirkung von Glukokortikoiden ist die Hemmung von NF-κB. Simultan wird durch den Glukokortikoidrezeptor die Transkription des NF-κB-inhibierenden Proteins IκBα induziert.[2]
Sonstige Effekte
Neben den oben genannten Effekten haben die Glukokortikoide auch mineralokortikoide Wirkungen, die den Elektrolythaushalt beeinflussen. Diese Komponente ist bei den natürlichen Glukokortikoiden stärker ausgeprägt als bei den synthetischen.
Relative Wirkungsstärke
Die beiden Nebennierenrinden des Menschen produzieren täglich etwa 15 bis 25 mg Cortisol. In der klinischen Praxis ergeben sich die Wirkungsstärke und die Äquivalenzdosis verschiedener Glukokortikoide wie folgt:[3][4]
| Steroid | Plasma-Halbwertzeit (Minuten) | Relative gluko-kortikoide Potenz | Relative mineralo-kortikoide Potenz | Cushing-Schwelle (mg/die) |
|---|---|---|---|---|
| Cortisol | 90 | 1 | 1 | 30 |
| Cortison | 90 | 0,8 | 0,8 | 40 |
| Cloprednol | 120 | 2 | ? | 5 |
| Prednison | > 200 | 4 | 0,6 | 7,5 |
| Prednisolon | > 200 | 4 | 0,6 | 7,5 |
| Deflazacort | 90 | 4 | ? | 9 |
| Methylprednisolon | > 200 | 5 | 0 | 6 |
| Fluocortolon | > 200 | 5 | 0 | 7,5 |
| Triamcinolon | > 200 | 5 | 0 | 6 |
| Betamethason | > 300 | 30 | 0 | 1 |
| Dexamethason | > 300 | 30 | 0 | 1,5 |
| Budesonid | 150 | >30 000 | ? | 0,001 |
| Fluticason | > 400 | >90 000 | ? | 0,0003 |
| Aldosteron | < 30 | 0 | 1000 | ∞ |
| Fludrocortison | 240 | 10 | 125 | 3 |
Topisch angewandte Glukokortikoide werden nach Niedner vereinfacht in vier Wirkstärkeklassen eingeordnet:
- Klasse 1 – schwach wirksam
- Klasse 2 – mittelstark wirksam
- Klasse 3 – stark wirksam
- Klasse 4 – sehr stark wirksam
Metabolismus
Glukokortikoide werden überwiegend in der Leber durch Kopplung der OH-Gruppen mit Sulfaten oder Glukuronsäure verstoffwechselt. Danach werden sie biliär oder renal ausgeschieden.
Ausschleichen
Bei Erreichen der Cushing-Schwelle und/oder einer Therapiedauer von über drei Wochen müssen Glukokortikoide ausgeschlichen werden, da die körpereigene Glukokortikoidproduktion durch die exogene Zufuhr supprimiert wird. Im Maximalfall droht eine sekundäre Nebenniereninsuffizienz.
Indikationen
In der Pharmakotherapie werden Glukokortikoide in einer Dosis, die meist oberhalb der jeweiligen Cushing-Schwelle liegt, systemisch oder topisch bei einer Vielzahl verschiedener Krankheiten eingesetzt, unter anderem bei:
Hydrocortison wird darüber hinaus in einer Dosis unterhalb der Cushing-Schwelle (üblicherweise 15 bis 25 mg/d) als Substitutionstherapie bei einer Nebennierenrindeninsuffizienz (M. Addison) eingesetzt.
Patienten, bei denen Glukokortikoide trotz kontinuierlich hoher Dosierung über mehrere Wochen keine ausreichende therapeutische Wirkung mehr erzeugen, bezeichnet man als steroidrefraktär.
Darreichungsformen
Glukortikoide sind abhängig von ihrer Indikation in vielen verschiedenen Darreichungsformen verfügbar. Sie können systemisch oder topisch appliziert werden. Die systemische Gabe erfolgt meist oral oder - vor allem in Notfallindikationen intravenös. Die topische Gabe in Form von Salben oder Creme ist in der Dermatologie verbreitet.
In der Therapie des Asthmas haben inhalative Glukokortikoide eine große Bedeutung.
Typische Darreichungsformen sind:
- Tablette
- Creme oder Salbe
- Kristallsuspension
- Injektionslösung
- Suppositorium
- Aerosol
- Augentropfen
Nebenwirkungen
Mit der potenten pharmakologischen Wirkung des Glukokortikoide sind auch zahlreiche mögliche Nebenwirkungen verbunden, die vor allem bei einer länger andauernden Therapie auftreten. Eine kurzfristige Gabe ist in der Regel nicht problematisch. Die Definition der Nebenwirkung ist dabei abhängig vom Einsatzziel; bei bestimmten Erkrankungen gehört die Immunsuppression beispielsweise zu den gewünschten Wirkungen.
Weitere Nebenwirkungen sind:
- Muskelatrophie
- Osteoporose
- Hyperglykämie
- Duodenalulzera: durch Intensivierung der Magensäuresekretion[5]
- Hautatrophie
- Vollmondgesicht
- Striae rubrae
- Katarakt
- Glaukom
- Wachstumsstörungen
- Immunsuppression
- Psychische Veränderungen (Euphorie, Manie, Unruhe, Aggressivität, Schlafstörungen, Appetitsteigerung)
Eine wenig bekannte, aber klinisch relevante Nebenwirkung sind Typ-IV-Allergien, selten auch Typ-I-Allergien auf Glukokortikoide (siehe Glukokortikoid-Allergie).
Kontraindikationen
Liegen Behandlungsindikationen vor, bei denen das Leben des Patienten akut in Gefahr ist, wird das mögliche Auftreten schwerer Nebenwirkungen von Glukokortikoiden toleriert. In diesem Fall gibt es nur relative Kontraindikationen. Zu diesen zählen:[6]
- Osteoporose
- Ulkus
- Infektionskrankheiten, insbesondere Tuberkulose, Pilz- und Virusinfektionen (immunsupprimierende Wirkung)
- Schwer einstellbare Hypertonie
- Diabetes mellitus (Erhöhung des Blutzuckers)
- Glukokortikoidinduzierte Myopathie
- Schwangerschaft, v.a. Frühschwangerschaft
Zudem sollten Glukokortikoide nicht im Zeitraum von 8 Wochen vor bis 2 Wochen nach Verabreichung einer Schutzimpfung angewendet werden.
Literatur
- ↑ Auger JP et al. Metabolic rewiring promotes anti-inflammatory effects of glucocorticoids. Nature. 2024
- ↑ Deroo et al. Glucocorticoid Receptor Activation of the IκBα Promoter within Chromatin Mol Biol Cell. 2001
- ↑ Kaiser et al., Cortisontherapie: Corticoide in Klinik und Praxis. Thieme Verlag, 11. Auflage, 2011
- ↑ Forth et al., Allgemeine und spezielle Pharmakologie und Toxikologie. BI und F.A. Brockhaus, 1987
- ↑ Apotheken.de –Kortisontherapie, abgerufen am 10.05.2023
- ↑ Gelbe Liste – Glukokortikoide (Kortikosteroide); abgerufen am 29.07.2022