Multiple Sklerose
Synonyme: Encephalomyelitis disseminata, disseminierte Enzephalomyelitis, demyelinisierende Enzephalomyelitis, Entmarkungs-Enzephalomyelitis, Polysklerose, Sclerosis multiplex, Sclerose en plaque disseminée
Abkürzung: MS, ED
Englisch: multiple sclerosis, disseminated sclerosis
Definition
Die Multiple Sklerose, kurz MS, ist eine chronische, entzündlich-demyelinisierende Erkrankung des zentralen Nervensystems (ZNS).
Epidemiologie
Die Multiple Sklerose ist in Mitteleuropa die häufigste entzündliche Erkrankung des ZNS. Sie tritt meist bei jungen Menschen zwischen dem 20. und 40. Lebensjahr auf. Frauen sind dreimal so häufig betroffen wie Männer. Die Prävalenz variiert in Europa stark und reicht von etwa 40 Fällen pro 100.000 Einwohner in Griechenland bis zu über 370 in Schottland. Die jährliche Inzidenz beträgt je nach Region zwischen 6 und 19 Neuerkrankungen pro 100.000 Einwohner.[1] In Deutschland gibt es etwa 300.000 Erkrankte.[2]
In der äquatorialen Zone gibt es weniger MS-Erkrankungen als in den nördlichen bzw. südlichen Breiten. Zuwanderungsstudien zeigen, dass Kinder und Jugendliche bis zum 15. Lebensjahr bei einem Umzug das Erkrankungsrisiko des Aufnahmelandes annehmen, während ältere Jugendliche ihr ursprüngliches Risiko aus dem Herkunftsland beibehalten.[3] Daher wird diskutiert, ob die Multiple Sklerose als Spätfolge einer frühkindlichen Infektion entsteht. Untersuchungen an Adoptivkindern belegen, dass eine direkte Übertragbarkeit der Krankheit jedoch nicht besteht.
Genetik
Die Erkrankung tritt familiär gehäuft auf. Für Verwandte 1. Grades erhöht sich das Risiko, im Laufe des Lebens ebenfalls zu erkranken, um das 25-fache, bei Eineiigkeit auf 25–30 %. Zudem besteht eine Assoziation mit HLA-DR2.
Ätiologie
Die Ursache für die Entstehung einer MS ist aktuell (2025) noch nicht vollständig geklärt. Ein zentraler Auslösemechanismus ist wahrscheinlich eine persistierende bzw. latente Virusinfektion, die zu einer Autoimmunreaktion gegen Bestandteile des Nervengewebes führt. Dabei kommt es zur Bildung kreuzreagierender Antikörper. Die Virusinfektion stimuliert eine CD8+‑T‑Zell-Antwort, die eigentlich zur Viruselimination führen soll, jedoch unbeabsichtigt ZNS-Schäden verursacht. In diesem Zusammenhang wird von einem "bystander damage" gesprochen.[4] Ebenso gibt es Hinweise, dass eine Reaktivierung der Viren eine Rolle beim Auslösen von MS-Schüben spielt.[5] Im Zusammenhang mit EBV-Infektionen wurde als verantwortliches Virusantigen EBNA1 identifiziert, das zu einer immunologischen Kreuzreaktion gegen das körpereigene Protein GlialCAM führt.[6] Als zusätzliche Risikofaktoren werden in Zusammenhang mit MS diskutiert:
- Vitamin D: Eine Erhöhung der Vitamin-D-Serumkonzentration bei niedrigen Ausgangsspiegeln verringert das Schubrisiko.
- Rauchen: bedingt eine relative Risikoerhöhung sowie eine negative Auswirkung auf die Prognose.
- Mikrobiota: Der Einfluss der Darmflora auf die Erkrankung ist derzeit Bestandteil aktueller Forschung.
- Kochsalz: erhöhter Salzkonsum wird als Teilursache für das Auftreten von MS diskutiert.
Pathogenese
Das wesentliche Merkmal der MS ist die im Gehirn und im Rückenmark verstreut auftretende Entzündung, die durch den Angriff körpereigener Abwehrzellen auf die Myelinscheiden der Nerven entsteht. Die dadurch ausgelöste Demyelinisierung bedingt zunächst eine Verlangsamung der Nervenleitgeschwindigkeit, danach einen Untergang der Axone. Anfänglich kommt es häufig noch zu Remyelinisierungen mit gliöser Vernarbung. Die Prädilektionsstellen für das Auftreten solcher Herde sind: Nervus opticus, periventrikuläre Hirnsubstanz, Hirnstamm, Kleinhirn, Frontallappen und die Hinterstränge, besonders im Zervikalmark. Der genaue Pathomechanismus der MS ist noch nicht vollständig geklärt. In den Gehirnen erkrankter Versuchstiere ließ sich eine erhöhte Konzentration des Proteins CD44 nachweisen. Es scheint dafür verantwortlich zu sein, dass die zerstörten Myelinscheiden nicht mehr ersetzt werden.
Verlaufsformen
Es wird zwischen mehreren Verlaufsformen unterschieden:
| Form/Abkürzung | Kürzel | Beschreibung |
|---|---|---|
| Klinisch isoliertes Syndrom bzw. clinically isolated syndrome |
KIS, CIS | Erste klinische Manifestation einer möglichen Multiplen Sklerose (MS). |
| Schubförmig remittierende MS bzw. relapsing remitting MS |
RRMS | Beginn meist zwischen 15 und 29 Jahren; gekennzeichnet durch klar abgrenzbare Schübe mit vollständiger Remission. In den Schubintervallen keine Krankheitsprogression. Betrifft etwa 85–90 % aller Patienten zu Krankheitsbeginn. |
| Sekundär progrediente MS | SPMS | Beginn meist zwischen 40 und 49 Jahren. Häufig geht eine schubförmige MS voraus; im Verlauf progredienter Verlauf mit oder ohne Schübe und geringer Remission. Betrifft etwa 50–60 % der initial schubförmigen MS-Fälle. |
| Primär progrediente MS | PPMS | Erkrankungsbeginn typischerweise im Alter von 39–41 Jahren. Von Beginn an langsame, stetige Verschlechterung der Symptomatik ohne erkennbare Schübe. Männer sind häufiger betroffen; oft Paraparese der Beine als Erstsymptom, spinale Betonung der Läsionen. |
| Akute maligne MS (Typ Marburg) | AMS | Sehr seltene, hochmaligne Verlaufsform, die vor allem junge Patienten betrifft. |
Der ältere Begriff "schubförmig progrediente MS" (PRMS) wird in aktuellen (2025) Einteilungen nicht mehr verwendet.
Zudem kann das sogenannte Uhthoff-Phänomen auftreten. In Zusammenhang mit erhöhter Körpertemperatur (etwa bei Fieber, körperlicher Anstrengung, heißen Bädern oder heißem Wetter) kommt es zu einer passageren Verschlechterung der Symptomatik. Es handelt sich hierbei jedoch lediglich um einen "Pseudoschub". Als Schub wird generell die subjektive oder objektive Verschlechterung der Symptome bezeichnet. Sie müssen eine Dauer von mindestens 24 Stunden und einen Mindestabstand von 30 Tagen zum vorherigen Schub haben und dürfen nicht während einer Infektion vorliegen. Ein Teil der Behinderungsprogression bei MS entsteht unabhängig von Schüben. Dieses Phänomen wird als schubunabhängige Progression (engl. Abkürzung PIRA) bezeichnet und spielt sowohl bei progredienten Verlaufsformen als auch bereits in frühen Phasen der schubförmigen MS eine Rolle.
Symptomatik
Die Symptomatik manifestiert sich zumeist zwischen dem 15. und 45. Lebensjahr in Form von Frühsymptomen wie:
- Sensibilitätsstörungen (30–40 %)
- Retrobulbärneuritis (20–30 %)
- Chronisches Erschöpfungssyndrom, Fatigue (> 50 %)
Im weiteren Verlauf sind u.a. folgende Symptome anzutreffen:
- Motorische Störungen: spastische Mono-, Hemi- oder Paraparese
- Sensibilitätsstörungen: Parästhesien, Dysästhesien
- Zerebelläre Störung: Standataxie, Gangataxie, Zeigeataxie, Nystagmus, Intentionstremor, Dysarthrie
- Augensymptome: Augenmuskelparese, internukleäre Ophthalmoplegie (INO)
- Blasenstörung: Imperativer Harndrang, Inkontinenz, erektile Dysfunktion, Harnretention
- Schnelle Ermüdbarkeit und chronisches Erschöpfungssyndrom (Fatigue)
- Kognitive Störungen: verminderte Aufmerksamkeit und Konzentrationsfähigkeit
- Pseudoneuritis vestibularis
Begleitend können psychische Symptome wie Depressionen und emotionale Labilität auftreten. Während die Entzündungen beim schubförmigen Verlauf in akuten Phasen auftreten und nach Abklingen der Inflammation meistens auch die Symptome wieder verschwinden, geht die Verstärkung der Symptome beim progredienten und sekundär progredienten Verlauf schleichend und beim fulminanten Typ sehr schnell vor sich. Bei einem schubweisen Verlauf kommt es meist im Frühjahr und Sommer zu einer Verschlechterung der Symptomatik, während Schübe im Winter seltener sind. Diese Saisonalität hängt mit der erhöhten Melatonin-Produktion des Körpers in den dunkleren Wintermonaten zusammen.[7]
Diagnose
Da die Symptomatik häufig keine zweifelsfreie Diagnosestellung zulässt, werden zusätzliche neurologische und radiologische Untersuchungen durchgeführt. Als Hilfsmittel für die Einstufung des Behinderungsgrads hat sich die EDSS-Skala bewährt.
Neurologische Untersuchungen
- Neurologischer Status
- Nachweis von motorischen, sensiblen oder zerebellären Symptomen
- positive Pyramidenbahnzeichen: Die Schädigung des 1. Motoneuron geht einher mit gesteigerten Reflexen, Spastik und einem positiven Babinski-Zeichen
- positives Lhermitte-Zeichen: "Stromschläge" entlang der Wirbelsäule bei Kopfbewegungen, vor allem bei Inklination
- positives McArdle-Zeichen: reversible Kraftminderung der geprüften Muskelgruppe bei Halsflexion, mit rascher Normalisierung in Neutral- oder Extensionsstellung (motorisches Gegenstück zum Lhermitte-Zeichen)[8]
- fehlende Bauchhautreflexe
- Evozierte Potentiale: Eine Verzögerung der Latenzzeiten weist auf eine gestörte Erregungsleitung hin.
- Visuell evozierte Potenziale (VEP): pathologische Verzögerung bei bis zu 80 %.
- Somatosensorisch evozierte Potentiale des Nervus tibialis und Nervus medianus (SEP)
- Akustisch evozierte Potenziale (AEP)
- Transkranielle Magnetstimulation (TMS)
- Untersuchung des Liquors:
- Zellzahl: bei 50 % normal, bei den Übrigen diskret erhöht (im Mittel 11/μl)
- Albumin: Blut-Liquor-Schranke bei 90 % intakt
- Intrathekale Immunreaktion: V.a. intrathekale IgG-Synthese. Nachweis mittels IgG-Index (>0,7), nach dem Reiber-Schema und mittels Nachweis von oligoklonalen IgG-Banden (OKB). Zusätzlich finden sich meist intrathekale Antikörper gegen Masern und/oder Röteln und/oder Varizella Zoster Viren (positive MRZ-Reaktion). Ebenfalls möglich ist eine intrathekale Zwei- (IgG und IgM) oder Drei-Klassen-Synthese (IgG, IgM, IgA). Als neue Methode wird die Bestimmung von freien Kappa-Leichtketten im Liquor propagiert.
- Biomarker
Magnetresonanztomographie
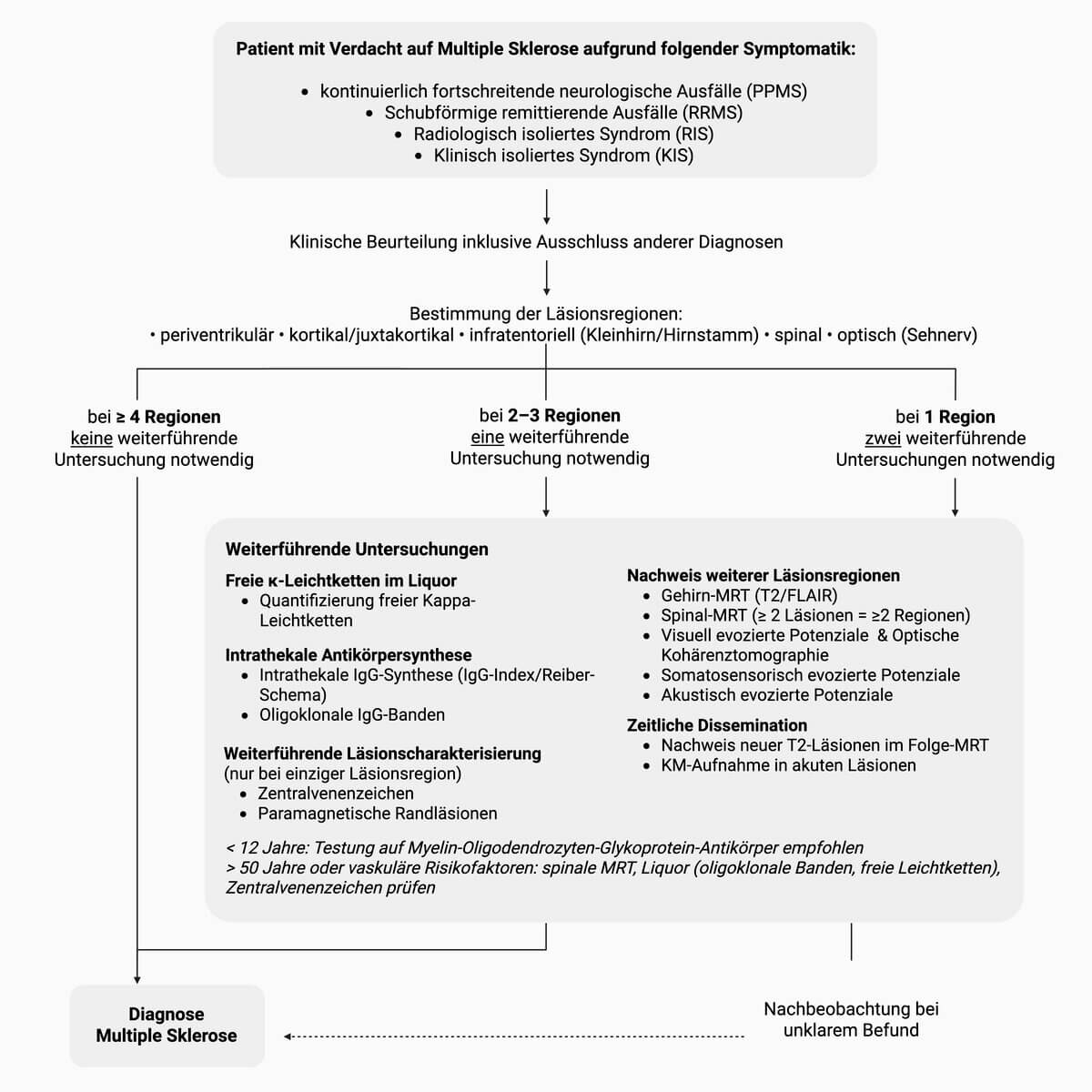
Die Magnetresonanztomographie (MRT) ist bei Multipler Sklerose die primäre Bildgebung zur Diagnostik und Verlaufsbeobachtung. Sie ermöglicht eine Beurteilung der Krankheitsaktivität im Spontanverlauf oder unter Therapie. Hochauflösende T2-gewichtete Bildsequenzen eignen sich wegen ihrer hohen Sensitivität am besten dazu, das Läsionsausmaß zu erfassen. T1-gewichtete Aufnahmen mit Kontrastmittel (Gadolinium-DTPA) erleichtern das Erkennen neu aufgetretener aktiver Läsionen. Typisch sind hyperintense Läsionen in T2-gewichteten Bildern oder in FLAIR-Sequenzen, die im periventrikulären Marklager (Dawson-Finger) und im Balken lokalisiert sind. Sie können auch juxtakortikal, infratentoriell oder intraspinal angesiedelt sein.[9] In der suszeptibilitätsgewichteten Bildgebung (SWI) lassen sich häufig paramagnetische Randläsionen (PRLs) nachweisen. Spinale Läsionen sind typischerweise kurzstreckig (monosegmental). Langstreckige, multisegmentale spinale Läsionen sind hinweisend für eine NMOSD oder MOGAD. Floride, aktiv-entzündliche Entmarkungsherde präsentieren sich in T1-gewichteten Bildern als Kontrastmittelaufnahme. Alte, "ausgebrannte" Herde mit zugrundeliegendem Axonverlust sind in T1-gewichteten Bildern als "black holes" zu identifizieren. Liegen typischen MRT-Befunde vor, ohne dass eine klinische Symptomatik besteht, spricht man von einem radiologisch isolierten Syndrom (RIS). Es wird heute (2025) als das früheste dokumentierte Stadium bzw. als präklinische Phase im Multiple-Sklerose-Kontinuum verstanden.[10]
Diagnosekriterien
Die Diagnose kann mittels MRT anhand der sogenannten McDonald-Kriterien aus dem Jahr 2024 gestellt werden, die auf der Beurteilung der räumlichen und zeitlichen Dissemination beruhen.[11]
- Räumliche Dissemination:
- MRT-Befund: Mindestens eine T2-hyperintense Läsion in mindestens 2 der 5 typischen Regionen (periventrikulär, kortikal/juxtakortikal, infratentoriell, spinal, Sehnerv).
- Zeitliche Dissemination:
- MRT-Befund: gleichzeitiger Nachweis KM-aufnehmender und nicht KM-aufnehmender Läsionen oder eine neue T2-hyperintense Läsion in einem Folge-MRT.
Liquorspezifische oligoklonale Banden können den Nachweis der zeitlichen Dissemination im MRT ersetzen. Zusätzlich besteht nach den Diagnosekriterien der McDonald-Kriterien von 2024 die Möglichkeit, freie Kappa-Leichtketten (κ-FLC) mit vergleichbarer Sensitivität und Spezifität zu bestimmen.[12]
siehe Hauptartikel: McDonald-Kriterien
Differenzialdiagnosen
- Neuromyelitis optica (+NMO-Spektrum Diseases): Aquaporin-4-AK im Serum (70 % positiv)
- MOG-Antikörper assoziierte Enzephalomyelitis (MOG-AK in 100% positiv)
- Akute disseminierte Enzephalomyelitis (ADEM)
- chronische Neuroborreliose
- Neurolues
- AIDS
- Neurosarkoidose
- zerebrale Vaskulitis, zerebraler Lupus, Granulomatose mit Polyangiitis
Therapie
Obwohl eine vollkommene Heilung der MS bis jetzt (2025) noch nicht möglich ist, sind in den vergangenen Jahren eine Reihe von Medikamenten entwickelt worden, die den Verlauf der MS positiv beeinflussen können.[13]
Akuter Schub
In der Therapie des akuten Schubes kommt bei klinisch deutlicher Beeinträchtigung bzw. Behinderung eine Hochdosis-Glukokortikoidtherapie als Mittel der 1. Wahl zum Einsatz. Sie führt zu einer Verkürzung und Milderung des Schubes sowie zu einer verlangsamten Progression der Erkrankung. Bevorzugt wird Methylprednisolon verabreicht, da es eine geringere mineralkortikoide Wirkung, eine hohe Rezeptoraffinität und eine gute Liquorgängigkeit aufweist. Vor jeder Glukokortkoidtherapie sollten Infekte ausgeschlossen und eine Ulkusprophylaxe durchgeführt werden. Risikopatienten sollten zudem eine Thromboseprophylaxe erhalten. Die erste Durchführung oder eine Eskalation der Hochdosistherapie sollte stationär erfolgen: Verabreicht werden 500 bis 1.000 mg Methylprednisolon als Kurzinfusion morgens i.v. für drei bis fünf Tage. Seltener wird eine Therapie mit einer täglichen Prednisondosis von 1.250 mg p.o. angewandt. Unter der Therapie ist auf regelmäßige Elektrolyt- und Blutzuckerkontrollen zu achten. Nach Beendigung der Therapie muss das Kortikosteroid langsam ausgeschlichen werden.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation. Bei persistierender Symptomatik kann im Einzelfall die Dauer der Therapie auf zehn Tage verlängert oder zwei Wochen nach Ende der Therapie ein Versuch mit einer erhöhten Dosis unternommen werden. Als Therapie der 2. Wahl kommt die Plasmapherese oder Immunadsorption zum Einsatz. Beachte: Nicht jeder leichte Schub ist behandlungsbedürftig!
Verlaufsmodifizierende Therapie
Die verlaufs- oder krankheitsmodifizierende Therapie erfolgt mit Immunmodulatoren und Immunsuppressiva als Monotherapie. Eine Kombinationstherapie erfolgt lediglich bei einer zusätzlichen Schubtherapie mit Glukokortikoiden. Ziel ist eine Verminderung vom Schubfrequenz und Krankheitsprogression sowie ein Rückgang der klinisch und kernspintomografisch messbaren Krankheitsaktivität. Die Auswahl der Medikamente erfolgt individuell auf den jeweiligen Patienten abgestimmt und unterscheidet sich je nach Verlaufsform und Aktivität der Erkrankung. Bei vielen der Therapiemöglichkeiten sind Zusatzuntersuchungen notwendig.
| Milde/Moderate Verlaufsform | (Hoch)aktive Verlaufsform | ||
|---|---|---|---|
| Klinisch isoliertes Syndrom (KIS) | Glatirameracetat s.c. IFN-β 1a i.m./s.c. IFN-β 1b s.c. |
||
| Schubförmig remittierende MS (RRMS) | Dimethylfumarat p.o. Glatirameracetat s.c. IFN-β 1a i.m./s.c. IFN-β 1b s.c. PEG-IFN-β 1a s.c. Teriflunomid p.o. Ozanimod p.o. Ponesimod p.o. Diroximelfumarat p.o. Azathioprin p.o. (2. Wahl) Immunglobuline i.v. (IVIG) (2. Wahl) |
Cladribin p.o. Fingolimod p.o. Natalizumab i.v. Ocrelizumab i.v. Ozanimod p.o. Ofatumumab s.c. Mitoxantron i.v. (2. Wahl) Alemtuzumab i.v. (2. Wahl) | |
| Sekundär chronisch progrediente MS (SPMS) | Mit aufgesetzten Schüben: IFN-β 1a/b s.c., Mitoxantron i.v., Siponimod p.o., Cyclophosphamid i.v. (2. Wahl) Ohne aufgesetzte Schübe: Mitoxantron i.v., Cyclophosphamid i.v. (2. Wahl) | ||
| Primär chronisch progrediente MS (PPMS) | Ocrelizumab i.v. | ||
Der monoklonale Antikörper Daclizumab wurde 2018 wegen des Verdachts schwerer unerwünschter Effekte vom Markt genommen und ist daher keine Therapieoption mehr. Kommt es zu keiner Besserung unter einer immunmodulierenden Behandlung, kann alternativ ein Versuch mit einer monatlichen intravenösen Immunglobulingabe erfolgen.
Nebenwirkungen
Neben den spezifischen Nebenwirkungen der jeweiligen Medikamente ist das erhöhte Risiko einer progressiven multifokalen Leukenzephalopathie unter Behandlung mit Natalizumab, Fingolimod und Dimethylfumarat zu beachten. Bei Einnahme eines dieser Wirkstoffe sollte unbedingt ein Neurologe mit entsprechender Spezialisierung hinzugezogen werden. Um das Risiko einer PML möglichst gering zu halten, sind vor Beginn der Therapie und therapiebegleitend Antikörperkontrollen des auslösenden JC-Virus indiziert. Kommt es in Rahmen der Behandlung zu neurologischen Auffälligkeiten wie Aphasien, Ataxien, Hemianopsien oder psychischen Veränderungen, die auf eine PML hindeuten, sollte sofort eine Kontroll-MRT sowie eine Lumbalpunktion zum Ausschluss einer JC-Virus-Infektion erfolgen.
Schwangerschaft
Für MS-Patientinnen ergaben sich während der Schwangerschaft und bis 24 Monate danach im Krankheitsverlauf keine Unterschiede, die auf spezifische Behandlungen zurückgeführt werden konnten. Interferone, Glatirameracetat oder Natalizumab erhöhten das Risiko für Spontanaborte, Frühgeburten oder angeborene Fehlbildungen nicht.[14][15] Wirkstoffe mit bekannter Teratogenität (Fingolimod, Teriflunomid) sollten nicht eingesetzt werden. Bei Cladribin, Alemtuzumab und Ocrelizumab müssen die empfohlenen Absetzzeiten eingehalten werden.[16]
Stillzeit
In einer klinischen Studie wurde die Entwicklung von Säuglingen während der ersten 36 Lebensmonate untersucht, deren Mütter während der Stillzeit mit monoklonalen Antikörpern (Natalizumab, Ocrelizumab, Rituximab und Ofatumumab) behandelt wurden. In Bezug auf die Gewichtsentwicklung der Kinder, ihre allgemeine Entwicklung sowie jährlich notwendige Krankenhausaufenthalte oder eine systemische Antibiotikatherapie wurden keine negativen Auswirkungen festgestellt.[17] Der Einsatz von Interferon beta und Glatirameracetat in der Stillzeit wird als sicher betrachtet.[18][19] Teriflunomid und Fingolimod werden in der Stillzeit nicht empfohlen.[16]
Symptomatische Therapie
Neben der medikamentösen Therapie können folgende Anwendungen durchgeführt werden, um die Symptome günstig zu beeinflussen:
- Physiotherapie
- Medikamentöse symptomatische Therapie
- Antispastische Therapie: Baclofen, Tizanidin, Cannabinoide, Botulinumtoxin A
- Verbesserung der Gehfähigkeit: Fampridin/4-Aminopyridin
- Schmerzen: Gabapentin/Pregabalin, TCA, Antikonvulsiva, Opioide
- Psychische Symptome: Antidepressiva
- Müdigkeit: Amantadin, Modafinil, Armodafinil, Amphetamine
- Vitamin D (vermindert die Krankheitsprogression und das Osteoporoserisiko)
- Ergotherapie
- Logopädie
- Ausdauer-/Bewegungstraining
- Psychotherapie
- Hilfsmittelversorgung
Experimentelle Therapie
In klinischen Studien der Phase III werden zur Zeit (2025) Tyrosinkinasehemmer aus der Klasse der BTK-Inhibitoren auf ihre Wirksamkeit bei MS überprüft. Dazu zählen die Wirkstoffe Evobrutinib und Tolebrutinib. Neuere Studien zeigen, dass der Einsatz autologer oder allogener zytotoxischer T-Zellen, die sich gegen EBV richten, signifikante klinische Resultate erzielt. Sollten sich die Ergebnisse bestätigen, wäre erstmals eine Kausaltherapie der MS möglich. Zudem gibt es erste Hinweise, dass Statine – bislang als Cholesterinsenker verwendet – die Anzahl der Krankheitsschübe deutlich reduzieren könnten.
Alternativmedizin
Für die Wirksamkeit von Ultrahochdosen von Vitamin D3 ("Coimbra-Protokoll") gibt es keine wissenschaftlliche Evidenz.[20] Klinische Studien, welche die Wirksamkeit und insbesondere die Sicherheit von hochdosiertem Vitamin D3 bei Multipler Sklerose belegen, liegen nicht vor (Stand 2025). Bei unkontrollierter Anwendung in hoher Dosierung (> 4.000 IE/d) entwickelt sich eine Vitamin-D-Hypervitaminose mit Hyperkalziämie, die in ein Nierenversagen als Folge einer Nephrokalzinose münden kann. Aufgrund der langen Halbwertszeit von Vitamin D (> 3 Wochen) können die Nebenwirkungen auch nach dem Absetzen persistieren.[21]
Prognose
Bislang ist es zu Beginn der Erkrankung kaum möglich, eine Prognose über den weiteren Verlauf zu stellen, was die betroffenen Patienten sehr belastet. Es gibt mehrere Faktoren, die mit einer eher schlechteren Prognose assoziert sein könnten. Hierzu zählen initial zahlreiche Herde in der MRT mit vielen Schüben, ein polysymptomatischer Beginn mit Beteiligung pyramidaler oder zerebellärer Funktionssysteme, Krankheitsbeginn nach dem 35. Lebensjahr sowie männliches Geschlecht. Eine prognostische Bedeutung von Antikörpern gegen Bestandteile des Myelins wie MBP und MOG konnte bei neueren Untersuchungen nicht bestätigt werden.[22] Nach 15 Jahren sind etwa 50 % aller MS-Patienten auf eine Gehhilfe angewiesen. Nach 25 Jahren ist ein Drittel nicht mehr gehfähig und der Großteil nicht mehr arbeitsfähig.
Quiz
Leitlinien
- AWMF-Leitlinie Multiple Sklerose und verwandte Erkrankungen, abgerufen am 22.10.2025
- S2-Leitlinie Multiple Sklerose im Kindesalter, abgerufen am 22.10.2025
Weblinks
Quellen
- ↑ Portaccio et al., Multiple sclerosis: emerging epidemiological trends and redefining the clinical course, The Lancet Regional Health – Europe, 2024
- ↑ MS-Registerbericht 2024, abgerufen am 22.10.2025
- ↑ Multiple Sklerose Gesellschaft Wien - Weltweite Verbreitung der MS, abgerufen am 22.04.2021
- ↑ Paradigmenwechsel: Ist EBV die Ursache von MS?, DocCheck News, abgerufen am 22.10.2019
- ↑ Steelman, Infection as an Environmental Trigger of Multiple Sclerosis Disease Exacerbation, Front Immunol, 2015
- ↑ Lanz et al., Clonally expanded B cells in multiple sclerosis bind EBV EBNA1 and GlialCAM, Nature, 2022
- ↑ Farez et al., Melatonin Contributes to the Seasonality of Multiple Sclerosis Relapses, Cell, 2015
- ↑ O'Neill et al., McArdle's sign in multiple sclerosis, J Neurol Neurosurg Psychiatry, 1987
- ↑ Grehl et al., Checkliste Neurologie, 5. Auflage, 2013
- ↑ Lebrun-Frenay, The Confavreux lecture: The radiologically isolated syndrome diagnosis, prognosis and perspectives, Multiple Sclerosis Journal, 2025
- ↑ Montalban et al., Diagnosis of multiple sclerosis: 2024 revisions of the McDonald criteria, Lancet Neurol, 2025
- ↑ Practical Neurology, McDonald Criteria Updates for MS Diagnosis Announced, abgerufen am 02.10.2024
- ↑ Faissner und Gold, Stufentherapie der multiplen Sklerose, Psychopharmakotherapie, 2023
- ↑ Ferrero et al., Fetal risks related to the treatment of multiple sclerosis during pregnancy and breastfeeding, Expert Rev Neurother, 2006
- ↑ Lopez-Leon et al., A systematic review and meta-analyses of pregnancy and fetal outcomes in women with multiple sclerosis: a contribution from the IMI2 ConcePTION project, J Neurol, 2020
- ↑ 16,0 16,1 Varytė et al., Pregnancy and multiple sclerosis: an update, Curr Opin Obstet Gynecol, 2021
- ↑ Witt et al., Child development after exposure to monoclonal antibodies during breastfeeding, Am Acad Neurol 76th ANNUAL MEETING 2024
- ↑ Multiple Sklerose: Einnahme des Wirkstoffs Glatirameracetat mit dem Stillen vereinbar. RUB, abgerufen am 5.4.2024
- ↑ Embryotox: Interferon beta-1a, abgerufen am 5.4.2024
- ↑ Coimbraprotokoll. Abgerufen am 12.10.2023
- ↑ Vitamin D3-Überdosierung nach Anwendung exzessiver Dosen im Rahmen des Coimbra-Protokolls. AkdÄ Drug Safety Mail 2023–48. Abgerufen am 12.10.2023
- ↑ Kuhle et al., Lack of association between antimyelin antibodies and progression to multiple sclerosis, N Engl J Med, 2007
Bildquelle
- Bildquelle für Flexikon-Quiz: ©Bret Kavanaugh / Unsplash