Antikörper
Synonyme: Immunglobulin, Gammaglobulin
Englisch: antibody, immune globulin
Definition
Ein Antikörper, kurz Ak, ist ein Protein, das nach dem Schlüssel-Schloss-Prinzip spezifisch an das Epitop eines bestimmten Antigens binden kann.
Nomenklatur
Ursprünglich waren mit dem Begriff "Antikörper" nur von Plasmazellen sezernierte Proteine gemeint, die aufgrund ihrer biochemischen Eigenschaften auch als Immunglobuline bezeichnet werden. Diese sezernierten Antikörper sind Y-förmige Proteine, die man in der Serumelektrophorese in der sogenannten γ-Fraktion findet. Darauf beruht der Name Gammaglobulin.
Heutzutage wird die Bezeichnung "Antikörper" wesentlich weiter gefasst, da sie ebenso auf eine zunehmende Anzahl gentechnisch hergestellter Proteine angewendet wird, deren Struktur teilweise deutlich von den natürlichen Antikörpern abweicht.
Struktur
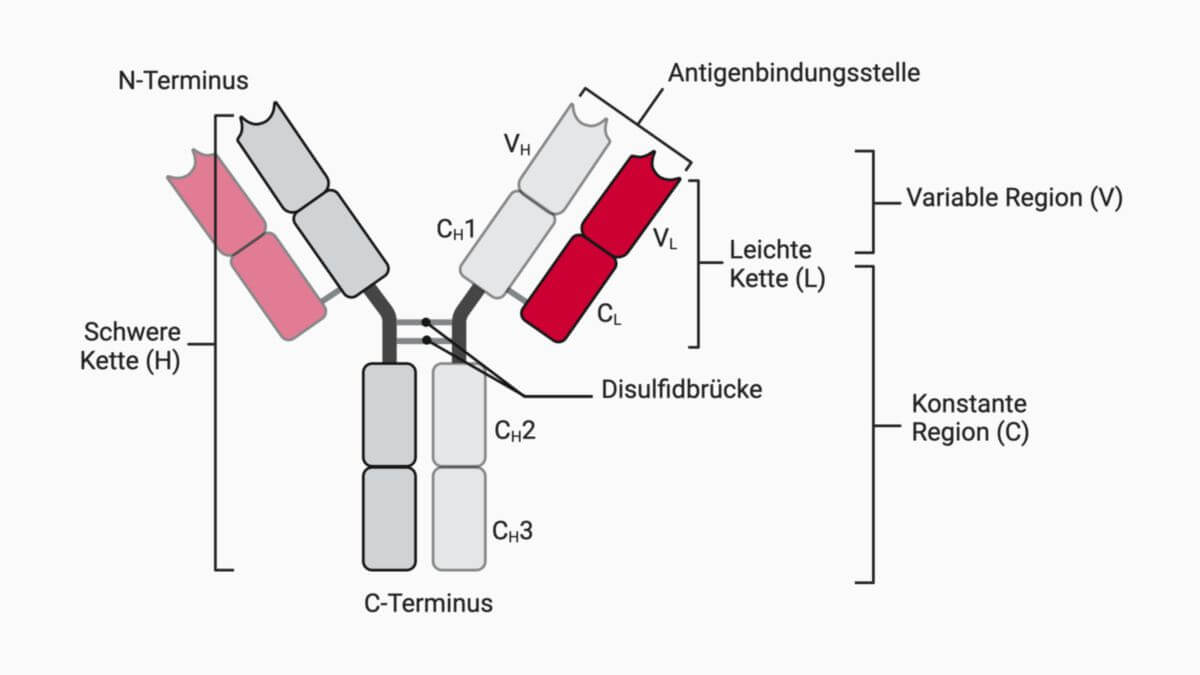
Prototypische Antikörper sind aus 4 Ketten aufgebaut:
- 2 identischen schweren Ketten (heavy chains)
- 2 identischen leichten Ketten (light chains)
Diese sind durch Disulfidbrücken miteinander verbunden. Jeder Antikörper besitzt eine spezifische, für ihn charakteristische Antigenbindungsstelle, die Complementarity-determining Region (CDR1, CDR2 und CDR3), auch Paratope genannt. Eingerahmt werden diese von sog. "framework regions" (FR), die relativ konserviert sind und als strukturelles Gerüst für die CDRs dienen. Die Spezifität beruht auf den variablen Teilen der Aminosäuresequenz einzelner Ketten des jeweiligen Antikörperproteins.
Zudem besitzen Antikörper in ihrem konstanten Teil (Fc-Teil) eine weitere Bindungsstelle, die beispielsweise von Phagozyten zur Erkennung und Aufnahme von antikörperbeladenen Antigenen genutzt werden kann.
Der konstante Teil der schweren Ketten wird benötigt, um der Zelle zu signalisieren, dass das Antigen gebunden hat. Dafür sind aber noch weitere Signalproteine notwendig, die nach Antigenkontakt eng mit dem konstanten Teil der Ketten assoziiert sind. Für den B-Zell-Rezeptor sind dies die invarianten Ketten Igα und Igβ, für den T-Zell-Rezeptor die vier Signalketten (zwei ε, eine δ und eine ζ-Kette), die man als CD3 zusammenfasst und zusätzlich ein Homodimer aus zwei ζ-Ketten.
Diese invarianten akzessorischen Ketten zeigen keine Antigenspezifität. Sie besitzen jedoch Sequenzen, die man als Tyrosinaktivierungssequenzen von Immunrezeptoren (Englisch: immunoreceptor tyrosine-based activation motifs), kurz ITAMs, bezeichnet. Nach Antigenbindung kommt es zur Aktivierung einer Rezeptortyrosinkinase (Scr-Kinase). Diese phosphoryliert die ITAMs der akzessorischen Ketten. Phosphorylierte akzessorische Ketten übertragen Signale in den Zellkern, indem sie weitere Kinasen aktivieren, die schließlich zur Aktivierung unterschiedlicher Transkriptionsfaktoren und entsprechender Genexpression führen.
Die Synthese der Antikörper unterliegt der somatischen Rekombination. Das heißt, dass die L-Kette (light chain) im variablen Anteil von J- und V-Gensegmenten und die H-Kette (heavy chain) im variablen Anteil von J-, V- und D-Gensegmenten kodiert wird. Durch unterschiedliche Kombinationen dieser Gensegmente wird eine sehr hohe Vielfalt der Antikörper erreicht.
Einteilung
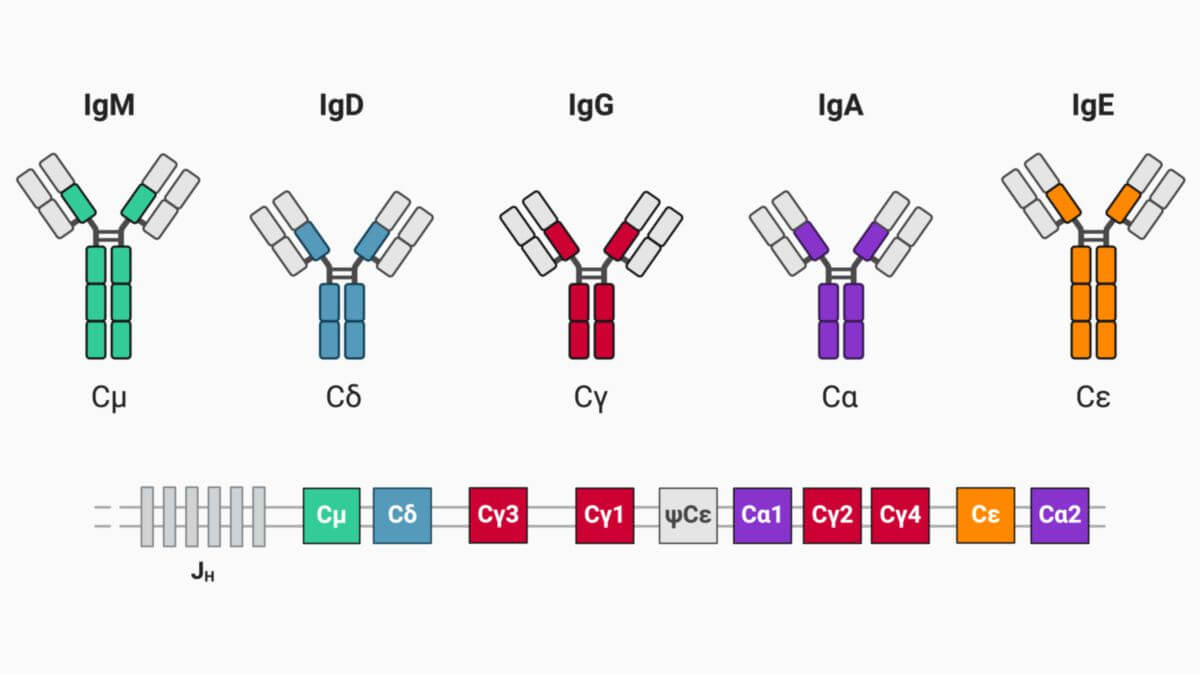
Die vom menschlichen Immunsystem produzierten Antikörper gehören zur Gammaglobulin-Fraktion der Plasmaproteine. Sie werden in fünf Isotypen bzw. Antikörperklassen eingeteilt:
- IgA: Immunglobulin A
- IgD: Immunglobulin D
- IgE: Immunglobulin E
- IgG: Immunglobulin G
- IgM: Immunglobulin M
Die schweren Ketten der humanen Antikörper werden entsprechend mit den griechischen Buchstaben α, δ, ε, γ und μ bezeichnet.
Je nach Isotyp können die Antikörper frei im Blut (z.B. IgG und IgM) oder anderen Körperflüssigkeiten (z.B. IgA im Speichel) oder aber membranständig und somit zellgebunden vorliegen (z.B. IgE auf Mastzellen). Dabei kommen IgD, IgE und IgG hauptsächlich als Monomere, IgA als Monomere oder Dimere und IgM als Pentamere vor.
Funktion
Antikörper übernehmen als Teil des humoralen Immunsystems im Rahmen der spezifischen Immunreaktion vielfältige Aufgaben:
- Neutralisation: Antikörper binden an Oberflächenstrukturen von Mikroorganismen (z.B. Viren oder Bakterien) und blockieren dort molekulare Strukturen, die für die Infektion von Zellen oder Geweben wichtig sind.
- Agglutination: Antikörper können fremde Zellen zu größeren Aggregaten verklumpen, die dann leichter von Immunzellen attackiert und phagozytiert werden können.
- Präzipitation: Antikörper können lösliche Antigene ausfällen, so dass sich Proteinkonglomerate bilden, die phagozytiert werden können.
- Komplement-Aktivierung: Antikörper, die sich an fremde Zellen heften, aktivieren das Komplementsystem und initiieren die Bildung des Membranangriffskomplexes. Dadurch kommt es zur Lyse dieser Zellen. Darüber hinaus leitet die Komplement-Aktivierung eine Entzündungsreaktion ein.
Impfungen durch aktive Immunisierung beruhen prinzipiell auf der Induktion von Antikörperantworten gegen das jeweilige Pathogen.
Klinik
Von menschlichen Spendern oder von Tieren gewonnene und/oder biotechnologisch hergestellte Antikörper können therapeutisch genutzt werden. Bekannte Beispiele sind die Rhesusprophylaxe bei Rhesus-negativen Müttern Rhesus-positiver Kinder oder auch die passive Immunisierung gegen Krankheitserreger durch Applikation von Immunglobulinpräparaten (IVIG, SCIG).
Eine weitere Anwendung von Antikörpern sind die sogenannten Biologika. Hier werden synthetisch herstellte monoklonale Antikörper oder Bruchstücke davon eingesetzt, um bestimmte Wirkungen im Körper zu erzielen. Eines der ersten Beispiele ist Rituximab, ein Antikörper, mit dem selektiv B-Lymphozyten im Körper zerstört werden können.
Ausgehend von monoklonalen Antikörpern wurde auch die Entwicklung sogenannter Immunkonjugate ("bewaffnete Antikörper") vorangetrieben, bei denen die Antikörper mit bestimmten Arzneistoffen gekoppelt werden, um eine selektivere Wirkung zu ermöglichen.
Bispezifische Antikörper sind zwei miteinander verknüpfte Antikörperfragmente (scFvs), von denen eines mit einer Tumorzelle reagiert, ein zweites mit einer zytotoxischen Effektorzelle. Beispiele sind BiTE-Antikörper wie Blinatumomab oder DART-Antikörper wie Flotetuzumab. Diese Verfahren bringen die Effektorzelle nahe an die Tumorzelle und führen so zu einer Erhöhung der immunologischen Aktivität gegen die Tumorzellen.
Diagnostik
In der Labordiagnostik haben Antikörper wesentliche Funktionen:
Die rein mengenmäßige Konzentration der Antikörper im Blut gibt Aufschluss über unterschiedliche Krankheitsbilder wie Antikörpermangelsyndrome oder Allergien.
Nachweise von spezifischen Antikörpern sind im Rahmen serologischer Untersuchungen ein wichtiges Instrument zur Diagnose und Verlaufskontrolle von Infektionskrankheiten und Autoimmunerkrankungen.
siehe auch: Antikörpernachweis, Antikörperklassenwechsel
Außerdem basieren die sogenannten Immunoassays auf künstlich hergestellten monoklonalen Antikörpern, die in der Labordiagnostik, medizinischen Forschung und Biotechnologie Anwendung finden. Durch die hohe Spezifität der Antikörper können bei entsprechender Auslegung des Testsystems sehr kleine Konzentrationen verschiedenster Substanzen gemessen werden.
In der Pathologie werden Antikörper für die Immunhistochemie eingesetzt.
Merkhilfe
Eine Merkhilfe für das Gewicht der Antikörper ist:
- Med.AG (M > E > D > A > G)
Bildquelle
- human antibody by www.sciepro.com; CC BY-ND 4.0 DE