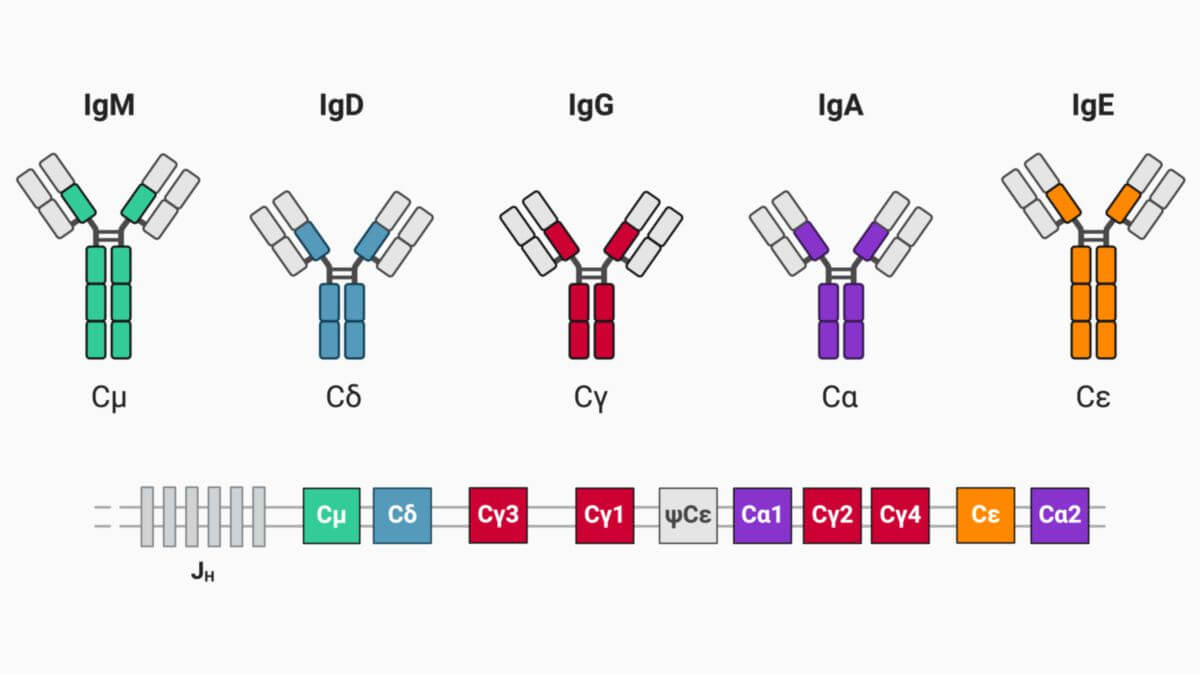
Immunglobulin M
Englisch: immunoglobulin M
Definition
Als Immunglobulin M, kurz IgM, bezeichnet man eine Unterklasse von Antikörpern.
Hintergrund
IgM wird im Rahmen der adaptiven Immunantwort gebildet, kommt aber auch als natürlicher Antikörper, d.h. ohne Antigenkontakt vor. IgM-Antikörper sind entsprechend bereits bei Neugeborenen und im Blut von keimfrei gehaltenen Mäusen nachweisbar. Sie sind somit auch ein wichtiger Bestandteil des unspezifischen Immunsystems.
Biochemie
Struktur
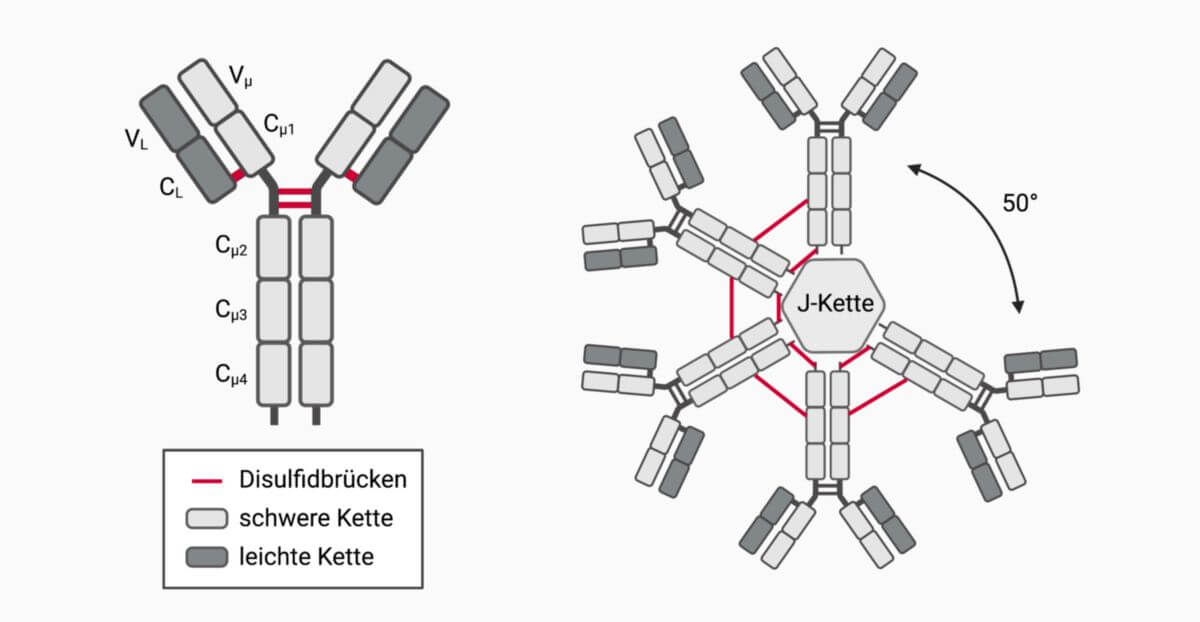
IgM besteht wie andere Antikörper aus insgesamt vier Polypeptidketten (Tetramer): zwei leichten und zwei schweren Ketten. Diese sind über Disulfidbrücken miteinander verbunden und bilden so ein Y-förmiges Gesamtmolekül. An den variablen Enden des Y befinden sich die identischen Antigenbindungsstellen.
- Die leichte Kette (λ- oder κ-Kette) setzt sich aus etwa 220 Aminosäuren (AS) zusammen und gliedert sich in eine variable (VL) und eine konstante Domäne (CL).
- Die schwere Kette (µ-Kette) besteht aus rund 580 Aminosäuren. Sie beinhaltet eine variable Domäne (Vμ) sowie 4 aufeinanderfolgende konstante Domänen: Cµ1, Cµ2, Cµ3 und Cµ4. An diese schließt sich ein kurzer C-terminaler Schwanz von etwa 20 Aminosäuren an. Die µ-Kette trägt an 5 Asparaginresten spezifische Oligosaccharide.
IgM-Antikörper lagern sich weiter zu Polymeren zusammen, die ebenfalls durch Disulfidbrücken verknüpft sind. Beim Menschen liegt IgM zu rund 75 % als Homopentamer vor, das durch eine J-Kette (für engl. joining) stabilisiert wird. Daneben kommen Homohexamere (rund 25 %) und vereinzelt Monomere vor.
Kryoelektronenmikroskopische Aufnahmen einzelner IgM-Pentamere zeigen eine asymmetrische, pilzhutförmige Anordnung mit einer Lücke von etwa 50° zwischen zwei IgM-Molekülen. In der Lücke kann das Protein Apoptosis Inhibitor of Macrophage (AIM) binden.[1] Dieser Aufbau widerspricht der bis dahin gültigen Annahme, dass es sich um ein symmetrisches, sternförmiges Pentamer handelt.
Eigenschaften
Basierend auf der polymeren Struktur weisen IgM eine sehr hohe Avidität auf. Die Plasmahalbwertszeit von sezerniertem IgM ist im Vergleich zu anderen Antikörpern eher kurz und liegt zwischen 8 und 48 Stunden.
Expression
IgMs werden bereits in frühen Stadien der Ontogenese von B-Lymphozyten exprimiert und bilden den Immunglobulin-Bestandteil der B-Zell-Rezeptoren vor Antigenkontakt. Bei Kontakt mit Antigenen werden die kurzlebigen IgM von B-Lymphozyten sezerniert.
Funktion
Immunsystem
IgM wird im Rahmen der Immunantwort der Primärantwort zugeordnet. Nach einer frischen Infektion erscheinen IgM-Antikörper als erste Immunglobulin-Subgruppe im Blut. IgM-Antikörper dienen ähnlich wie IgG-Antikörper der Agglutination und Neutralisation von Antigenen. Sie sind ebenfalls in der Lage, das Komplementsystem zu aktivieren.
In membranständiger Form fungiert IgM auf B-Lymphozyten als Antigenrezeptor. Mithilfe dieser Rezeptoren kommt es bei starken Antigensignalen (z.B. Polysaccharid-Kapsel von Bakterien) zur direkten, T-Zell-unabhängigen Aktivierung der B-Zelle. IgM beeinflussen die Produktion und Sekretion anderer Antikörper (z.B. IgG) sowie die Reifung von B-Gedächtniszellen.
Gewebe-Homöostase
IgM-Antikörper können im Gegensatz zu IgG nicht direkt opsonieren. Stattdessen induziert IgM durch die Anreicherung von Komplementfaktoren die Clearance von toten und entarteten Zellen mittels Phagozytose. Die Autoreaktivität ist entscheidend, um der Entstehung von Tumoren vorzubeugen. Gleichzeitig verhindern IgM-Antikörper damit die Stimulation einer Entzündungsreaktion.
Weitere Funktionen
Weitere Prozesse, bei denen IgM eine Rolle spielt, sind:
Interaktion
Immunglobulin M kann mit verschiedenen körpereigenen Proteinen interagieren:
- mit dem Komplementfaktor C1, wodurch der klassische Weg des Komplementsystems aktiviert wird
- mit dem polymeren Immunglobulinrezeptor (pIgR), was zur Präsenz von IgM auf Schleimhautoberflächen führt
- mit zwei weiteren Fc-Rezeptoren, Fcα/µ-R und Fcµ-R, die wahrscheinlich eine Rolle bei der Endozytose von Antigen-Antikörper-Komplexen spielen
- mit dem Apoptosis Inhibitor of Macrophage (AIM), wodurch dessen Eliminierung verringert wird; AIM verhindert die Apoptose von Makrophagen und bedingt einer verlängerten Autoantigenpräsentation.
Labormedizin
Material
Für die Untersuchung wird 1 ml Serum benötigt.
Referenzbereich
Die physiologische Serumkonzentration von IgM beim Erwachsenen beträgt:
- Für Frauen: 0,40 bis 2,80 g/L (40 bis 280 mg/dl)
- Für Männer: 0,40 bis 2,30 g/L (40 bis 230 mg/dl)
Der Referenzbereich ist altersabhängig und bei Kindern niedriger. Ausschlaggebend sind die vom jeweiligen Labor angegebenen Werte.
Interpretation
Erniedrigtes Serum-IgM
IgM im Serum ist erniedrigt bei:
- Primärem IgM-Antikörpermangelsyndrom
- Bruton-Gitlin-Syndrom (Morbus Bruton)
- selektiver IgM-Mangel
- Wiskott-Aldrich-Syndrom
- Sekundärem IgM-Antikörpermangelsyndrom
- nephrotisches Syndrom
- exsudativer Enteropathie
- Immunsuppression (z.B. Chemotherapie, Strahlentherapie)
- Verbrennungen
- monoklonaler Gammopathie anderer Immunglobulinklassen
Erhöhtes Serum-IgM
IgM im Serum ist erhöht bei:
- akuten Infektionen
- monoklonaler Gammopathie vom Typ IgM (Morbus Waldenström)
- Hepatopathien (Leberzirrhose, Hepatitis)
- Kälteagglutininkrankheit
- Autoimmunkrankheiten (z.B. Sjögren-Syndrom, SLE)
- Hyper-IgM-Syndrom
- malignen Tumoren
Serologie
Der serologische Nachweis erregerspezifischer IgM-Antikörper (z.B. Anti-HEV-IgM) ist ein wichtiges Diagnoseverfahren in der Infektiologie.
Pharmakologie
Der Einsatz von IgM-angereicherten Präparaten zur Behandlung nach einer Sepsis wurde bereits in Phase-II- und Phase-III-Studien geprüft. Auch bei neurodegenerativen Erkrankungen wie Multipler Sklerose und Alzheimer-Krankheit wird der Einsatz von therapeutischen IgM-Antikörpern derzeit erforscht.
Literatur
- Keyt et al. Structure, Function, and Therapeutic Use of IgM Antibodies Antibodies (Basel) 2020
- Blandino und Baumgarth Secreted IgM: New tricks for an old molecule J Leukoc Biol 2019
- Hiramoto et al. The IgM pentamer is an asymmetric pentagon with an open groove that binds the AIM protein Sci Adv 2018
- Laborlexikon.de; abgerufen am 29.03.2021
Quelle
- ↑ Siqi Gong; Ruth M. Ruprecht: Immunoglobulin M: An Ancient Antiviral Weapon – Rediscovered Front. Immunol., 11 August 2020 Sec. Viral Immunology