Aminosäure
Synonym: Aminocarbonsäure
Abkürzung: AS
Englisch: amino acid
Definition
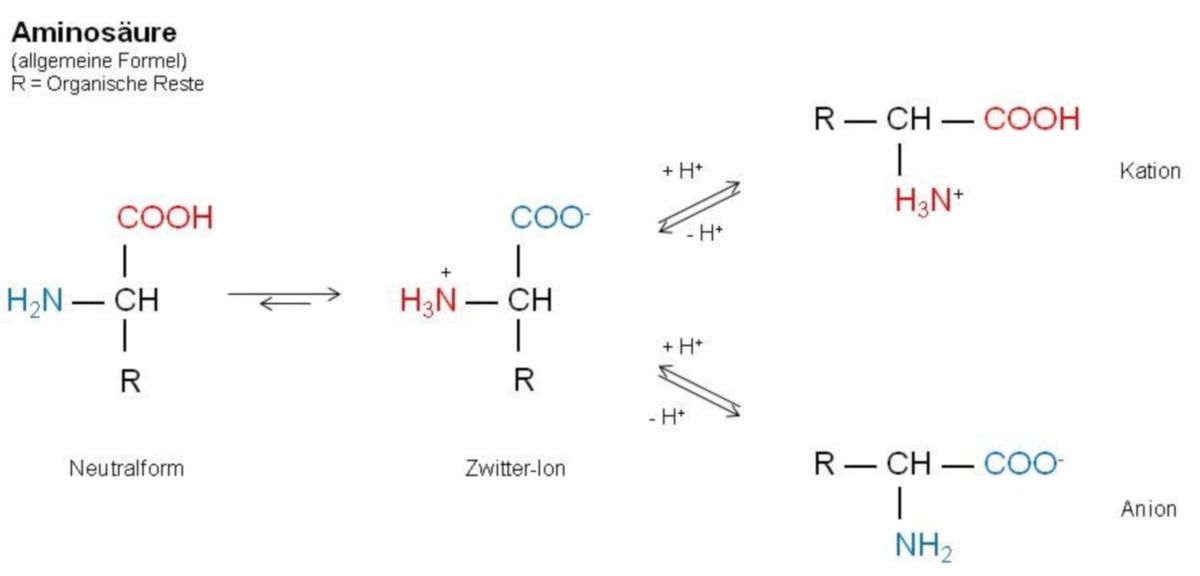
Aminosäuren, kurz AS, sind Carbonsäuren, bei denen ein alpha-ständiges Wasserstoff-Atom durch eine Aminogruppe (NH2) ersetzt ist.
Kanonische Aminosäuren
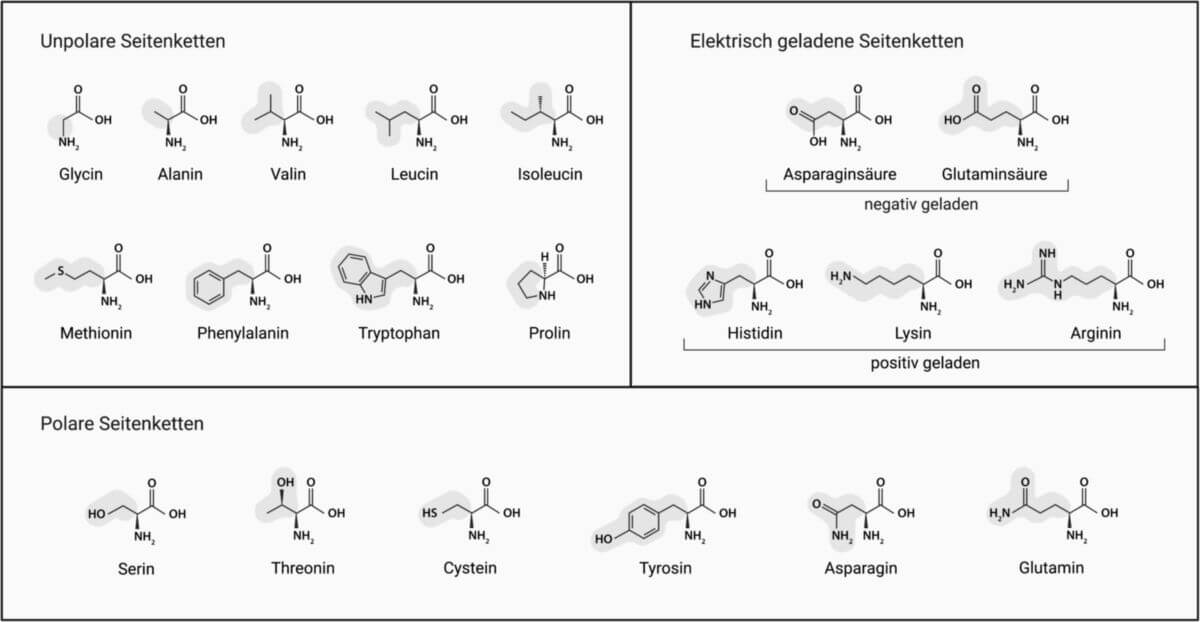
Durch die genetischen Codons in der DNA werden 20 Aminosäuren kodiert, aus denen sich die Proteine zusammensetzen. Sie werden als kanonische Aminosäuren oder Standardaminosäuren bezeichnet.
| Name | Drei- und Einbuchstabencode | Eigenschaften der Seitenkette |
|---|---|---|
| L-Alanin | Ala, A | unpolar, klein |
| L-Cystein | Cys, C | polar, SH-Gruppe |
| L-Asparaginsäure | Asp, D | negativ geladen, sauer |
| L-Glutaminsäure | Glu, E | negativ geladen, sauer |
| L-Phenylalanin | Phe, F | unpolar, aromatisch |
| L-Glycin | Gly, G | klein, keine Seitenkette |
| L-Histidin | His, H | positiv geladen, basisch |
| L-Isoleucin | Ile, I | unpolar, groß |
| L-Lysin | Lys, K | positiv geladen, basisch |
| L-Leucin | Leu, L | unpolar, groß |
| L-Methionin | Met, M | unpolar, groß |
| L-Asparagin | Asn, N | polar |
| L-Prolin | Pro, P | unpolar, Ringsystem |
| L-Glutamin | Gln, Q | polar |
| L-Arginin | Arg, R | positiv geladen, basisch |
| L-Serin | Ser, S | polar |
| L-Threonin | Thr, T | polar |
| L-Valin | Val, V | unpolar, groß |
| L-Tryptophan | Trp, W | unpolar, aromatisch |
| L-Tyrosin | Tyr, Y | polar, aromatisch |
Einteilung
Die chemische Gruppe der Aminosäuren kann nach unterschiedlichen Gesichtspunkten klassifiziert werden.
...in Bezug auf die Proteinsynthese
Man unterscheidet proteinogene und nicht-proteinogene Aminosäuren. Im engeren Sinn sind mit dem Begriff "proteinogen" meistens die 20 verschiedenen kanonischen Aminosäuren gemeint, aus denen die menschlichen Eiweiße zusammengesetzt sind. Alle proteinogenen Aminosäuren tragen am alpha-C-Atom (dem der Carboxylgruppe nächsten Kohlenstoffatom) eine Aminogruppe und liegen in der L-Form vor. Selenocystein, die 21. proteinogene Aminosäure, nimmt eine Sonderrolle ein, da sie nicht direkt in der DNA kodiert ist. Stattdessen wird der Einbau von Selenocystein über ein UGA-Codon und eine Selenocystein-Insertionssequenz (SECIS) gesteuert. Beim Menschen sind mehrere Enzyme bekannt, die Selenocystein enthalten. Die Aminosäure Pyrrolysin kommt im Menschen nicht vor, wird allerdings in einigen Bakterien- und Archeenarten zur Proteinsynthese verwendet und wird somit ebenfalls als proteinogene Aminosäure definiert.
In der Natur existieren mehrere hundert weitere Aminosäuren, die bei der Proteinsynthese keine Rolle spielen, sog. nicht-proteinogene Aminosäuren. Trotzdem erfüllen sie wichtige Funktionen im Organismus und sind an verschiedenen metabolischen Vorgängen beteiligt. Die Rolle der verschiedenen Aminosäuren unterscheidet sich bei verschiedenen Spezies. Beim Menschen gehören zu den nicht-proteinogenen AS u.a. der inhibitorische Neurotransmitter GABA, Ornithin und Citrullin aus dem Harnstoffzyklus sowie Homocystein und das Schilddrüsenhormon Thyroxin.
...in Bezug auf die Verfügbarkeit
Ferner unterscheidet man essentielle und nicht-essentielle Aminosäuren. Die nicht-essentiellen Aminosäuren können vom Organismus selbst synthetisiert werden, während die essentiellen Aminosäuren aus externen Quellen – vor allem durch Nahrungsaufnahme – zugeführt werden müssen. Diese Einteilung ist aber nicht 100%ig trennscharf, da die Verfügbarkeit einer bestimmten Aminosäure im Stoffwechsel situationsabhängig ist. Aus diesem Grund ordnet man einige Aminosäuren den bedingt-essentiellen Aminosäuren zu. Beim Menschen ergibt sich folgende Aufteilung:
Essentielle Aminosäuren
- Isoleucin
- Leucin
- Lysin
- Methionin
- Phenylalanin
- Threonin
- Tryptophan
- Valin
Nicht-essentielle Aminosäuren
- Alanin
- Arginin
- Asparaginsäure
- Asparagin
- Cystein
- Glutamin
- Glutaminsäure
- Glycin
- Histidin
- Prolin
- Serin
- Tyrosin (essentiell für Kinder)
Bedingt-essentielle Aminosäuren
Bedingt essentielle bzw. semi-essentielle Aminosäuren sind Aminosäuren, die normalerweise nicht-essentiell sind und nur in bestimmten Situationen mit der Nahrung aufgenommen werden müssen. Das ist zum Beispiel bei gesteigertem Proteinbedarf (Wachstum, Rekonvaleszenz, Schwangerschaft) oder bestimmten Stoffwechselerkrankungen der Fall. In diese Gruppe fallen unter anderem L-Arginin, L-Histidin, L-Cystein und L-Tyrosin.
... in Bezug auf den Stoffwechsel
Abhängig von ihrer Fähigkeit, zu Kohlenhydraten metabolisiert zu werden, werden glucogene und ketogene Aminosäuren unterschieden. Die Abbauprodukte glucogener Aminosäuren, können zur Gluconeogenese verwendet werden.
... in Bezug auf die chemischen Eigenschaften
Die chemischen Eigenschaften der Aminosäuren unterscheiden sich je nach dem Vorkommen weiterer funktioneller Gruppen. Sie bestimmen die Wasserlöslichkeit (hydrophile und hydrophobe Aminosäuren) und den pH-Wert in Lösung (saure und basische Aminosäuren).
Chiralität
Mit Ausnahme von Glycin sind alle Aminosäuren chiral aufgebaut. Je nach Anordnung ihrer Molekülgruppen um das asymmetrische Kohlenstoffatom kommen sie in zwei Formen vor, die sich nicht durch Drehung ineinander überführen lassen.
Zur Bezeichnung dieser beiden Formen verwendet man bei Aminosäuren meistens folgende Beschreibungen:
- L-Aminosäuren oder
- D-Aminosäuren
Nach der Cahn-Ingold-Prelog-Konvention sollte man besser von S- bzw. R-Aminosäuren sprechen, wobei (bis auf Cystein) die L-Formen den S-Formen und die D-Formen den R-Aminosäuren entsprechen. Zusätzlich zum Stereozentrum am α-C-Atom besitzen Isoleucin und Threonin in ihrem Rest (R) je ein weiteres stereogenes Zentrum. Proteinogenes Isoleucin [R = –C*H(CH3)CH2CH3] ist dort (S)-konfiguriert, Threonin [R = –C*H(OH)CH3] (R)-konfiguriert.
Die beiden Formen werden allgemein als Stereoisomere bezeichnet. Verhalten Sie sich wie Bild und Spiegelbild, spricht man von Enantiomeren. Sie verhalten sich chemisch identisch, unterscheiden sich jedoch in ihren optischen Eigenschaften. Diese ergeben sich aus der Fischer-Projektion, bei der die Aminosäuren so gedreht werden, dass die Carbonsäure nach oben und der Rest (R) nach unten zeigen. Des Weiteren ist zu beachten, dass die waagerechten Substituenten nach vorne und die senkrechten nach hinten deuten. Steht nun das Amin (NH2) auf der linken Seite, bezeichnet man diese Form als L-Aminosäure (lat. laevus – links) steht sie rechts, als D-Aminosäure (lat. dexter – rechts). In biologischen Organismen werden ausschließlich L-Aminosäuren zur Proteinsynthese verwendet. Das ist darauf zurückzuführen, dass die an der Synthese beteiligten Enzyme nur diese Form verarbeiten können.
Biochemie
Beim Abbau von Aminosäuren spielt der Harnstoffzyklus eine entscheidende Rolle zur Entgiftung des Ammoniaks, der beim Abbau von Aminosäuren durch die Aminogruppen frei wird. Durch den Harnstoffzyklus werden Aminogruppen in Harnstoff umgewandelt. Aminosäuren können aufgrund ihres Kohlenstoffgerüsts als Energieträger für den Keton- oder den Glucosestoffwechsel verwendet werden. Nach Decarboxylierung zu Biogenen Aminen werden sie zur Synthese von Neurotransmittern verwendet.