Blinatumomab
Handelsname: Blincyto®
Englisch: blinatumomab
Definition
Blinatumomab ist ein monoklonaler Antikörper, der zur Behandlung einer Philadelphia-Chromosom-negativen, rezidivierenden oder therapierefraktären B-lymphoblastischen Leukämie (B-Vorläufer-ALL) genutzt wird. Es gehört zur Klasse der BiTE-Antikörper.
Wirkmechanismus
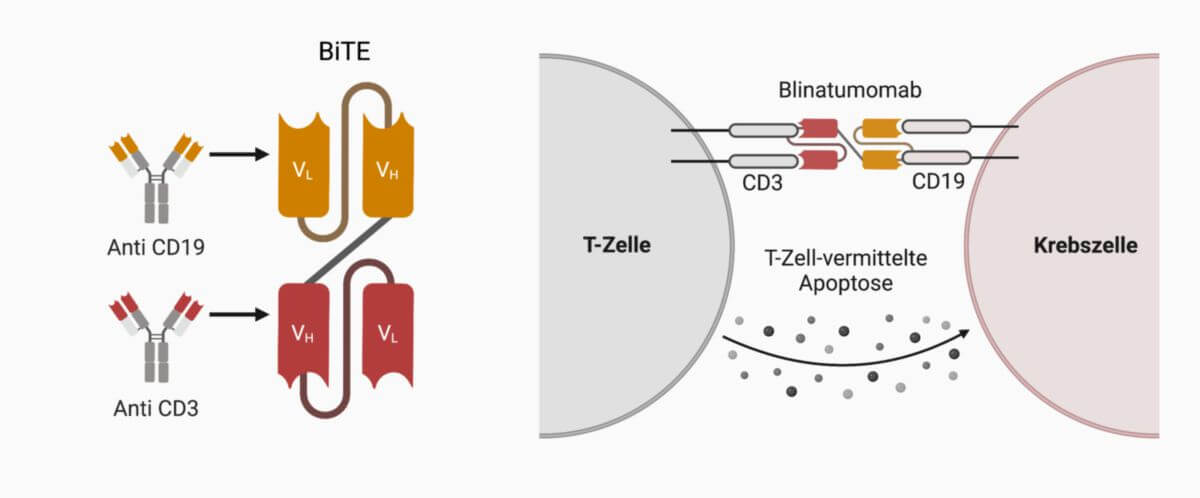
Blinatumomab ist ein bispezifischer Antikörper (BsMAb) von etwa 54 kDa, der aus zwei Antigen-erkennenden scFv-Fragmenten besteht, die über eine Peptidbrücke (Linker) miteinander verbunden sind. Ein Fragment bindet spezifisch an den CD3-Rezeptor von T-Zellen, das zweite an das Oberflächenprotein CD19 der B-Zellen. Dadurch werden T-Zellen und B-Zellen immunologisch miteinander gekoppelt.
Die Verbindung von CD3 mit CD19 im T-Zell-Rezeptor-Komplex aktiviert die T-Zellen, die daraufhin zytotoxische Proteine (u.a. Perforin) bilden. Die Zellmembran proliferierender und ruhender Zielzellen wird geschädigt, worauf die Zellen in die Apoptose eintreten. Da CD19 sowohl von malignen als auch von benignen B-Zellen exprimiert wird, trifft dieser Effekt allerdings auch gesunde B-Zellen.
Pharmakokinetik
Die Bioverfügbarkeit von Blinatumomab bei parenteraler Gabe beträgt 100 %. Die Substanz wird im Körper enzymatisch in Peptidfragmente und Aminosäuren gespalten. Die biologische Halbwertszeit beträgt rund 2 Stunden.
Indikation
- Second-Line-Therapie der Philadelphia-Chromosom-negativen, rezidivierenden oder therapierefraktären B-lymphoblastischen Leukämie (B-Vorläufer-ALL) bei Kindern und Erwachsenen.
Klinische Wirkung
Gegenüber der Standardchemotherapie konnte in klinischen Studien die mittlere Überlebensdauer durch Blinatumomab um 3,7 Monate verlängert werden.
In einem Fallbericht wurde die Behandlung bei einer Patientin mit schwerer systemischer Sklerose mitgeteilt, bei der sich die Symptome rasch besserten. Der Behandlungserfolg deutet darauf hin, dass die durch Blinatumomab ausgelöste B-Zell-Depletion die inflammatorische Komponente der aktiven Erkrankung günstig beeinflusst.[1]
Darreichungsform
Blinatumomab wird intravenös als Dauerinfusion appliziert.
Es wurde auch die subkutane Applikation von Blinatumomab zur Behandlung der akuten lymphatischen Leukämie untersucht.[2]
Dosierung und Komedikation
Die Therapie in kann in zwei Behandlungszyklen eingeteilt werden, die durch ein zweiwöchiges behandlungsfreies Intervall getrennt sind. Blinatumomab wird in einer Dosierung von jeweils 9 μg/Tag (Tage 1 bis 7 im ersten Zyklus) bzw. 28 μg/Tag (alle weiteren Behandlungstage) angewendet.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Vor Beginn jedes Zyklus wird im Abstand von einer Stunde die Gabe von Dexamethason empfohlen. Ebenfalls sollte eine antipyretische Therapie durchgeführt werden. Um ein ALL-Rezidiv im Zentralnervensystem zu verhindern, wird eine intrathekale Chemotherapie vor und während der Behandlung mit Blinatumomab empfohlen.
Nebenwirkungen
Unter Blinatumomab können u.a. folgende Nebenwirkungen auftreten:[3][4]
- Infektionen (> 30 %)
- neurologische Ereignisse, wie: Enzephalopathie, Krampfanfälle, Sprach- und Bewusstseinsstörungen (> 16 %)
- hämatologische Veränderungen: Neutropenie (> 15 %), Anämie (ca. 20%), Thrombozytopenie (ca. 10%)
- Zytokinfreisetzungssyndrom (CRS, ca. 12 %)
- Stoffwechselstörungen, wie Hypokaliämie, Hypomagnesiämie, Hyperglykämie
- Gastrointestinale Störungen, wie Übelkeit, Erbrechen, Obstipation, Diarrhö, Bauchschmerzen
- Exantheme
- Tumorlyse-Syndrom (0,5 %)
- Erhöhung der Leberenzyme
- Pankreatitis
- lokale infusionsbedingte Reaktionen
- Fieber
Kontraindikation
Bei Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe sollte von der Anwendung abgesehen werden. Außerdem sollte während der Behandlung mit Blinatumomab nicht gestillt werden.
Wechselwirkungen
Basierend auf der Zytokinausschüttung während der Applikation von Blinatumomab ist eine Interaktion mit den Enzymen des CYP450-Systems und P-Glykoproteinen nicht auszuschließen. Der Wirkstoff selbst interagiert nicht mit CYP450.
Zulassung
Blinatumomab ist in der EU seit November 2015 als erster therapeutisch verwendeter BiTE-Antikörper zugelassen. Der Hersteller ist Amgen.
Kosten
Die Jahrestherapiekosten von Blinatumomab pro Patient liegen bei einer Behandlung mit zwei Zyklen bei rund 150.000 €. Das IQWiG rechnet mit jährlichen Kosten zu Lasten der GKV zwischen 3,8 bis 18,5 Mio €.[4]
Nutzenbewertung
Da es sich bei Blinatumomab um ein Orphan Drug handelt, gilt nach § 35a Abs. 1 Satz 10 SGB V der medizinische Zusatznutzen bereits durch die Zulassung als belegt.
Quellen
- ↑ Subklewe M et al. Application of blinatumomab, a bispecific anti-CD3/CD19 T-cell engager, in treating severe systemic sclerosis: A case study. Eur J Cancer. 2024
- ↑ Jabbour E et al. Single agent subcutaneous blinatumomab for advanced acute lymphoblastic leukemia. Am J Hematol. 2024
- ↑ Fachinformation BLINCYTO® 38,5 Mikrogramm Pulver für ein Konzentrat und Lösung zur Herstellung einer Infusionslösung, Amgen
- ↑ 4,0 4,1 IQWiG-Berichte, Nr. 366: Blinatumomab – Bewertung gemäß § 35a Abs. 1 Satz 10 SGB V; Stand: 25.02.2016
Literatur
- Subklewe. BiTEs better than CAR T cells. Blood Adv. 5(2): 607–612. 2021