Apoptose
Englisch: apoptosis
Definition
Unter Apoptose versteht man den kontrollierten, durch Signalwege gesteuerten "Selbstmord" von Zellen. Die Apoptose führt im Gegensatz zur Nekrose nicht zur Freisetzung von Zellplasma und löst somit keine Entzündungsreaktion aus. Das zugehörige Adjektiv ist apoptotisch.
Hintergrund
Die Apoptose ist eine Form des programmierten Zelltods (PCD). Er wird auch als "active cell death" (ACD) bezeichnet. Davon abgegrenzt wird der "activation-induced cell death" (AICD).
Ablauf
Für die Apoptose sind folgende Veränderungen charakteristisch:
- Schrumpfung der Zelle
- Bildung von blasenförmigen Ausbuchtungen an der Zelloberfläche (Zeiosis)
- Schrittweise Kondensation und Degradierung der DNA
- Abbau der Mitochondrien mit Freisetzung von Cytochrom c
- Fragmentierung der Zelle in kleine membranumhüllte Teilstücke (Apoptosekörper)
- Exposition des Phospholipids Phosphatidylserin an der Zelloberfläche
Phosphatidylserin wird von Rezeptoren der Makrophagen erkannt, welche die Zellfragmente phagozytieren und dabei Cytokine sezernieren.
Einteilung
Eine Apoptose kann durch unterschiedliche Stimuli eingeleitet werden. Sie führen jeweils über einen mehrstufigen, komplexen Signalweg zur Apoptose. Diese Signalkaskaden sorgen dafür, dass der Zelltod nicht inzidentell ausgelöst wird. Die beiden wichtigsten Apoptoseformen sind die
- extrinsische Apoptose (Apoptose vom Typ I) und die
- intrinsische Apoptose (Apoptose vom Typ II)
Zellen, die den jeweiligen Apoptoseweg nehmen, heißen entsprechend Typ-I- oder Typ-II-Zellen. Darüber hinaus werden noch weitere Apoptosewege postuliert, z.B. die AIF-induzierte Apoptose.
Extrinsische Apoptose
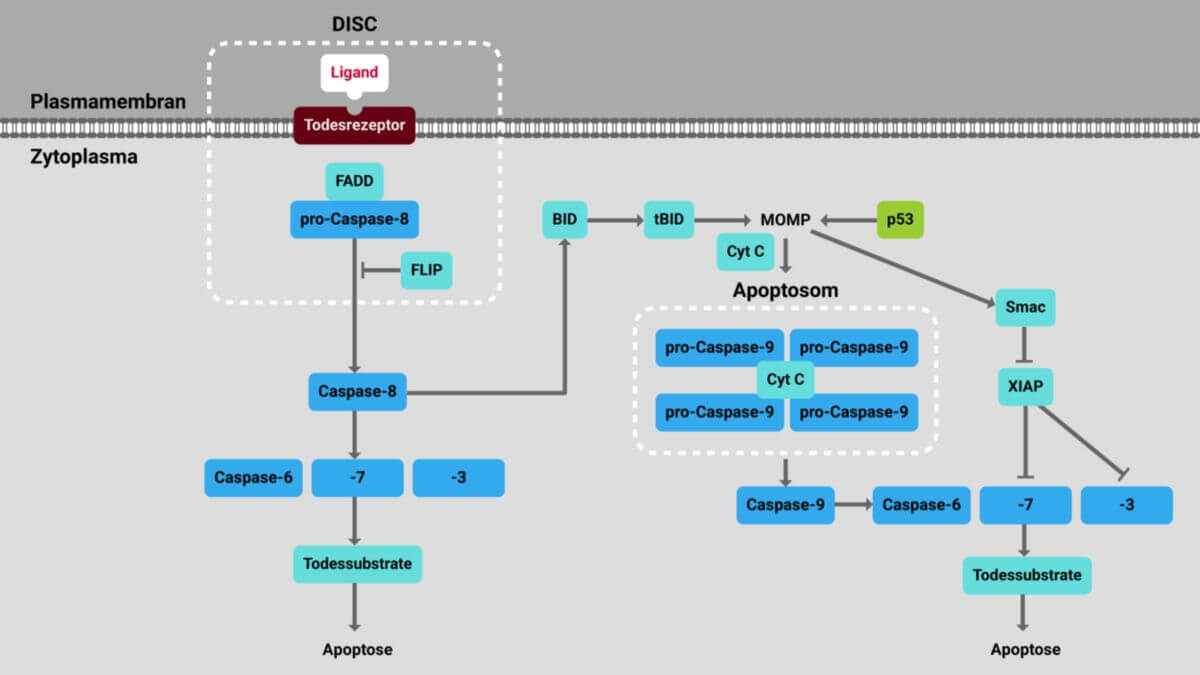
Bei der extrinsischen Apoptose wird der Zelltod von außen angestoßen. Die Aktivierung der Signalwege in der Zelle wird entsprechend über "Todesrezeptoren" (death receptor bzw. activator) auf der Zellmembran vermittelt. Zu ihnen zählen Mitglieder der TNF-Rezeptor-Familie wie CD95, TRAIL-R1 oder TNF-R1.
Durch Bindung von Liganden an die entsprechenden Rezeptoren wird eine Signalkaskade ausgelöst und Adaptermoleküle, wie FADD an den Todesrezeptor rekrutiert. FADD rekrutiert wiederum Pro-Caspase 8. Schließlich bildet sich der sogenannte DISC (Death inducing signaling complex). Innerhalb dieses Komplexes wird die Caspase 8 aktiviert, die als Initiatorcaspase dient. In Typ-I-Zellen ist der aktivierende Stimulus ausreichend groß, so dass Caspase 8 mit der Aktivierung der Effektorcaspasen Caspase 3, Caspase 6 und Caspase 7 beginnt. Sie schneiden daraufhin Zielproteine und führen so den Zelltod herbei.
In Typ-II-Zellen ist der Apoptose-Stimulus nicht ausreichend um den Zelltod zu induzieren. Hier wird durch Spaltung des Proteins BID (Protein) zu tBID zusätzlich der intrinische Apoptose-Signalweg aktiviert, um den Stimulus zu verstärken. Das gespaltene Bid transloziert zu den Mitochondrien und induziert dort die intrinsische Apoptose.
Intrinsische Apoptose
Bei der intrinsischen Apoptose wird der Zelltod auf dem mitochondrialen Signalweg eingeleitet. Auslöser des intrinsischen Signalwegs sind zellinterne Faktoren wie DNA-Schäden, osmotischer Stress oder Wachstumsfaktor-Entzug.
Das auslösende Zellereignis aktiviert den Transkriptionsfaktor p53, was zur Folge hat, dass vermehrt BAD (proapoptotisches Protein) exprimiert wird. Das Protein aktiviert wiederum das Bax-Protein (proapoptotisches Multidomänen-Protein). Durch die Aktivierung von Bax wird die Permeabilisierung der äußeren Mitochondrienmembran (MOMP) angestoßen. Dadurch tritt Cytochrom C aus dem Intermembranraum der Mitochondrien aus. Es bildet im Zytosol gemeinsam mit Pro-Caspase 9 und Apaf-1 das so genannte Apoptosom. Durch diese Komplexbildung wird Caspase 9 aktiviert und beginnt wiederum mit Aktivierung der Effektorcaspasen, welche die Zielproteine schneiden und somit den Zelltod erzwingen.
AIF-induzierte Apoptose
Diese Form des Zelltods wird durch die Freisetzung des Apoptosis-Inducing Factor (AIF) aus dem intermembranösen Raum der Mitochondrien eingeleitet. Die Freisetzung folgt als Reaktion auf pro-apoptotische Proteinmitglieder der Bcl-2-Proteinfamilie. AIF transloziert zum Zellkern und bindet dort an die DNA. So wird eine Caspase-unabhängige Chromatinkondensation stimuliert.
Vertreter der Forkhead-Box-Proteine (z.B. FOXO3) fördern die Apoptose sowohl Mitochondrien-abhängig, als auch unabhängig durch Hochregulierung pro-apoptotischer Moleküle wie FasL und BIM.
Aufgaben
Der gesteuerte Zelltod ist für die normale Entwicklung und Funktion des Organismus unerlässlich. Er erfüllt eine Vielzahl von Aufgaben, unter anderem dient er der
- Elimination entarteter oder potentiell schädlicher Zellen
- Kontrolle der Zellanzahl und damit der Größe von Geweben
- Sicherung des Zellturnovers in Geweben (z.B. im Riechepithel)
- Selektion genetisch intakter Keimzellen
Nachweis
Apoptotische Zellen können im Gewebe durch die TUNEL-Methode nachgewiesen und quantifiziert werden. Dabei werden sie anhand der charakteristischen DNA-Fragmentierung markiert und mittels Fluoreszenzmikroskopie visualisiert.
Apoptoseresistenz
Eine zentrale Eigenschaft von malignen Tumoren ist die Apoptoseresistenz. In der Summe ist das Größenwachstum der Tumoren eine Bilanz aus Zellproliferation, terminaler Differenzierung, Seneszenz und Apoptose. Bei vielen Tumoren existiert eine kooperative onkogene Wirkung durch c-myc-Amplifikation, das einen proliferationssteigernden Effekt ausübt, und Bcl-2, das als Mitochondrienmembranschutzfaktor die Apoptose behindert.
Pharmakologie
Die medikamentöse Hemmung der Apoptose bietet einen möglichen Angriffspunkt zur Behandliung von Erkrankungen, bei denen der programmierte Zelltod ein pathogenetischer Schlüsselmechanismus ist. Zur Zeit (2023) sind diese Apoptoseinhibitoren noch Gegenstand der Grundlagenforschung.