Tuberkulose
Synonyme: Tb, Tbc, Morbus Koch, "Schwindsucht" bzw. "Lungenschwindsucht", "Phthisis" (obsolet)
Englisch: tuberculosis
Definition
Tuberkulose ist eine Infektionskrankheit, die durch Bakterien des Mycobacterium-tuberculosis-Komplexes ausgelöst wird. Die Erkrankung kann jedes Organ betreffen, manifestiert sich jedoch hauptsächlich in der Lunge.
ICD10-Codes
- A15: Tuberkulose der Atmungsorgane, bakteriologisch oder histologisch gesichert
- A16: Tuberkulose der Atmungsorgane, weder bakteriologisch noch histologisch gesichert
- A17: Tuberkulose des Nervensystems
- A18: Tuberkulose sonstiger Organe
- A19: Miliartuberkulose
Einteilung
...nach Infektionsstadium
- Eliminierte tuberkulöse Infektion (ausgeheilte Infektion)
- Latente tuberkulöse Infektion (LTBI, eingedämmte Infektion, Persistenz der Erreger im Organismus)
- Beginnende tuberkulöse Infektion
- Subklinische Tuberkulose (asymptomatisch, aber radiologischer oder mikrobiologischer Nachweis)
- Aktive Tuberkulose (symptomatisch mit radiologischem oder mikrobiologischem Nachweis)
...nach Verlaufsform
- Primärtuberkulose
- Postprimärtuberkulose (PPTB, Sekundärtuberkulose)
...nach Keimnachweis
- Offene Tuberkulose: Keime in Körpersekreten (z.B. Sputum, Magensaft) nachweisbar
- Geschlossene Tuberkulose: Keine Keime in Körpersekreten nachweisbar
Im Allgemeinen beziehen sich die Begriffe offene und geschlossene Tuberkulose jedoch auf die Infektiösität (offene infektiöse gegenüber geschlossener nicht infektiöser Lungentuberkulose).
...nach Organbefall
- Lungentuberkulose: mit 80 % d.F. die häufigste Form der Tuberkulose[1]
- Extrapulmonale Tuberkulose, z.B.
Erreger
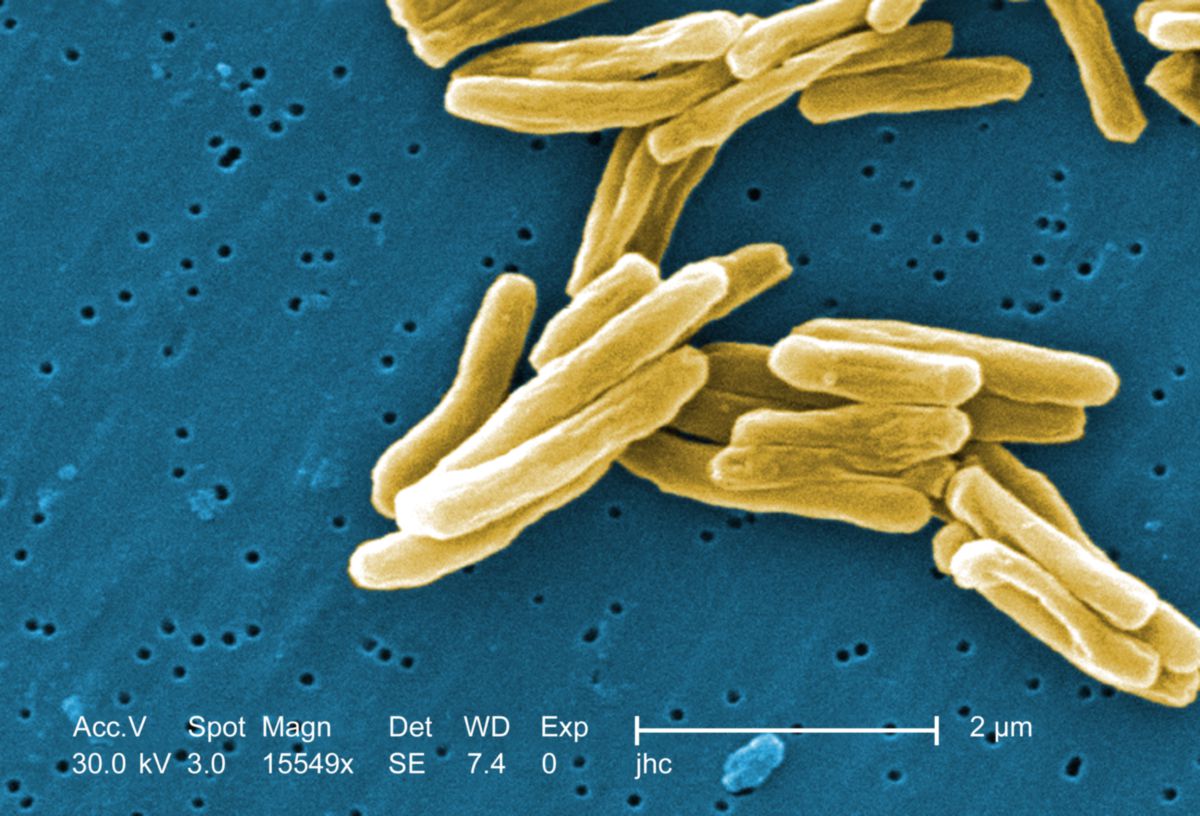
Die Tuberkulose wird v.a. durch Mycobacterium tuberculosis (sensu stricto) ausgelöst. Mycobacterium tuberculosis ist ein unbewegliches, aerobes Stäbchen, das sich intrazellulär vermehrt (insbesondere in Makrophagen). Es bildet keine Sporen.
Das eng verwandte Mycobacterium africanum kommt überwiegend bei Patienten in West-, Zentral- und Ostafrika vor. Der Zoonoseerreger Mycobacterium bovis wird durch nicht pasteurisierte Milch übertragen und war früher ein häufiger Auslöser der Tuberkulose. 2015 war Mycobacterium bovis noch für ca. 150.000 Fälle weltweit verantwortlich.[2] Mycobacterium bovis ist typischerweise resistent gegenüber Pyrazinamid. Sehr selten werden andere Bakterien des Mycobacterium-tuberculosis-Komplexes isoliert, vor allem bei Patienten mit Immundefizienz.
Mykobakterien besitzen eine speziell aufgebaute Zellwand die reich an Mykolsäure ist und ihnen eine hohe Säurefestigkeit und Resistenz gegenüber den meisten Antibiotika verleiht. Das Genom von Mycobacterium tuberculosis umfasst 4.043 Gene, die für 3.993 Proteine kodieren.
Epidemiologie
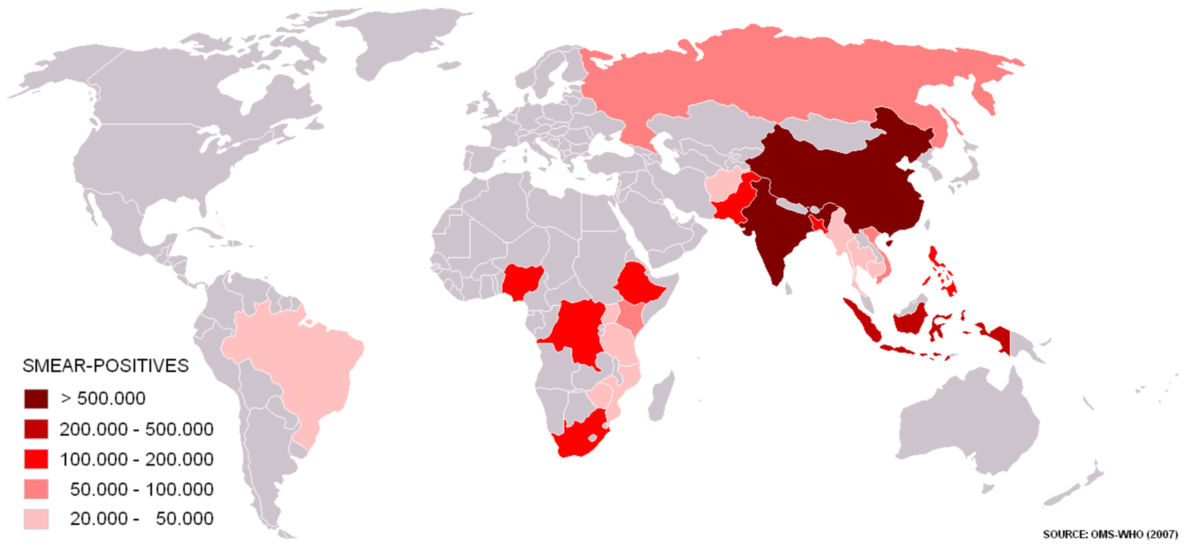
Vermutlich ist etwa ein Viertel der Weltbevölkerung mit Bakterien des Mycobacterium-tuberculosis-Komplex infiziert.[3] Bei Immunkompetenz entwickeln hiervon etwa 5 bis 10 % eine behandlungspflichtige Tuberkulose. Jährlich kommt es weltweit zu über 10 Millionen Neuerkrankungen.[1] Davon treten 95 % in Entwicklungsländern auf.[4] In insgesamt acht Ländern treten zwei Drittel aller Neuerkrankungen auf: Indien, Indonesien, China, den Philippinen, Pakistan, Nigeria, Bangladesch und Südafrika.[1] In zwei Dritteln der Fälle sind Männer betroffen.[5] Jedes Jahr erkranken zudem ungefähr 1 Millionen Kinder an Tuberkulose, wovon 230.000 an der Krankheit sterben.[6]
Die Anzahl der weltweiten jährlichen Todesfälle durch Tuberkulose wird mit etwa 1,5 Millionen beziffert, wobei ca. 25 % gleichzeitig mit HIV infiziert sind.[1][7] Damit gehört die Tuberkulose in Entwicklungsländern, trotz existierender Therapie, noch vor HIV zu den am häufigsten tödlich verlaufenden Infektionskrankheiten.[1] Armut, mangelnde Gesundheitsversorgung, die HIV-Koinfektion und die Verbreitung von Antibiotikaresistenzen sind entscheidende epidemiologische Faktoren der Tuberkulose.
In Deutschland ist die Erkrankungsrate seit dem Anstieg 2015 und 2016 weiter rückläufig. Im Jahr 2020 wurden in Deutschland 4.127 Tuberkulosefälle registriert. Das entspricht einer Inzidenz von 5 pro 100.000 Einwohner.[8] In den Jahren 2022 und 2023 wurden in Deutschland 4.076 bzw. 4.481 Fälle gemeldet.[9]
Übertragung
Aerogene Übertragung
Die Übertragung erfolgt fast immer aerogen durch Tröpfcheninfektion: Durch Husten und Niesen übertragen Patienten mit infektiöser offener Lungentuberkulose die Erreger. Die Kontagiosität ist jedoch deutlich geringer als bei anderen durch Aerosole übertragenen Infektionskrankheiten (z.B. Varizellen, Masern und SARS-CoV-2).[1] Einer der wichtigsten Risikofaktoren für die Übertragung sind entsprechend dichte Menschenansammlungen in schlecht belüfteten Räumen.
Tuberkulosepatienten mit kavernöser Lungentuberkulose oder Kehlkopftuberkulose, deren Sputum mikroskopisch sichtbare säurefeste Bakterien enthält (Sputum positiv), spielen die bedeutendste Rolle für die Ausbreitung der Tuberkulose. HIV-infizierte Patienten bilden häufig keine Kavernen aus, sodass deren Infektiosität vermindert sein kann. Patienten mit nur in der Kultur nachgewiesener Tuberkulose ohne sichtbare Bakterien im Sputumausstrich sind weniger infektiös, können aber für eine Übertragung der Erreger verantwortlich sein. Patienten mit kulturell negativer Lungentuberkulose oder extrapulmonaler Tuberkulose sind meist nicht infektiös.
Andere Übertragungswege
Eine Infektion durch nicht pasteurisierte, mit Mykobakterien kontaminierte Milch ist prinzipiell möglich. Dieser Übertragungsweg ist jedoch in Mitteleuropa nicht mehr von Bedeutung, da der Rinderbestand weitgehend tuberkulosefrei ist. Weitere Übertragungswege, z.B. über die Haut oder die Plazenta, sind ungewöhnlich und epidemiologisch nicht relevant.
Risikofaktoren
Die Pathogenese und der Verlauf nach einer Infektion mit Tuberkuloseerregern hängt im Wesentlichen von der Anzahl und Virulenz der Erreger und der individuellen Abwehrlage ab. Risikofaktoren für eine aktive Tuberkulose sind unter anderem:
- Alter: Aus ungeklärten Gründen findet sich weltweit unter den Infizierten die höchste Inzidenz im späten Jugendalter und im frühen Erwachsenenalter. Männer sind zudem in allen Altersklassen häufiger betroffen als Frauen.[10] In Deutschland steigt die Prävalenz mit dem Alter an. Der Gipfel im mittleren Alter fällt deutlich kleiner aus. Zwischen dem 25. und 39. Lebensjahr sind Frauen häufiger betroffen, im höheren Alter kehrt sich das Verhältnis wieder um.[8]
- Diabetes mellitus
- chronische Niereninsuffizienz
- Malnutrition
- vorbestehende Pneumokoniosen (z.B. Silikose)
- Lymphome
- angeborene oder erworbene Immundefekte, insbesondere HIV-Infektion
- medikamentöse Immunsuppression (z.B. mit Glukokortikoiden, Ciclosporin, Zytostatika, TNF-α-Blockern)
- Alkoholismus
- intravenöser Drogenabusus
- Tabakrauchen
- Gastrektomie
- jejunoilealer Bypass
- niedriger sozialer Status[1]
Pathogenese
Die Tuberkulose löst nur eine relativ geringe Immunreaktion des Wirts aus, da die Wachse und Lipide der äußeren Zellwand der Bakterien nur schwach immunogen sind. Die Erreger bilden auch keine Toxine, die als Antigen wirken könnten. Durch die Wachshülle und seine geringe Stoffwechselaktivität "maskiert" sich der Erreger gegenüber dem Immunsystem. Als Folge dieser Anpassung an das menschliche Immunsystem wachsen Mykobakterien allerdings vergleichsweise langsam.
Initialstadium
Nur weniger als 10 % der inhalierten, erregerhaltigen Tröpfchen erreichen die Alveolen, wo die Phagozytose durch Alveolarmakrophagen erfolgt. Auf verschiedenen Wegen verhindern die Erreger ihren Abbau (z.B. Hemmung der Phagolysosom-Bildung, Blockade der Autophagie). Anschließend beginnt die Replikation, die zur Ruptur der Makrophagen und zur Freisetzung des bakteriellen Inhalts führen kann. Nicht infizierte Phagozyten, die absterbende Makrophagen aufnehmen, werden selbst infiziert und tragen zur Ausbreitung der Infektion bei.
Im Initialstadium breitet sich Mycobacterium tuberculosis über die regionalen (z.B. hilären und mediastinalen) Lymphknoten aus. Vor dort aus kann es nach Eintritt ins Blut zur hämatogenen Streuung in weitere Bereiche der Lunge oder andere Organe kommen. In diesem Stadium findet ein starkes Wachstum in naiven, nicht aktivierten Makrophagen statt. Zugang zum Parenchym erhält der Erreger vermutlich über Infektion von Epithelzellen oder indem Makrophagen das Epithel durchqueren. Dann beginnen infizierte dendritische Zellen oder Monozyten damit, das Mykobakterium in das Lymphsystem zu transportieren. Diese Zellen migrieren in die drainierenden Lymphknoten und präsentieren dort den T-Zellen die mykobakteriellen Antigene. Zu diesem Zeitpunkt werden die zellvermittelte und die humorale Immunität initiiert. Diese Initialphase der Infektion ist i.d.R. asymptomatisch.
Spezifische Immunreaktion
Etwa 2 bis 4 Wochen nach Infektion bilden sich zwei verschiedene Formen der Immunreaktion aus:
- T-Zell-vermittelte Aktivierung von Makrophagen
- Hypersensitivitätsreaktion vom verzögerten Typ gegenüber mykobakteriellen Antigenen
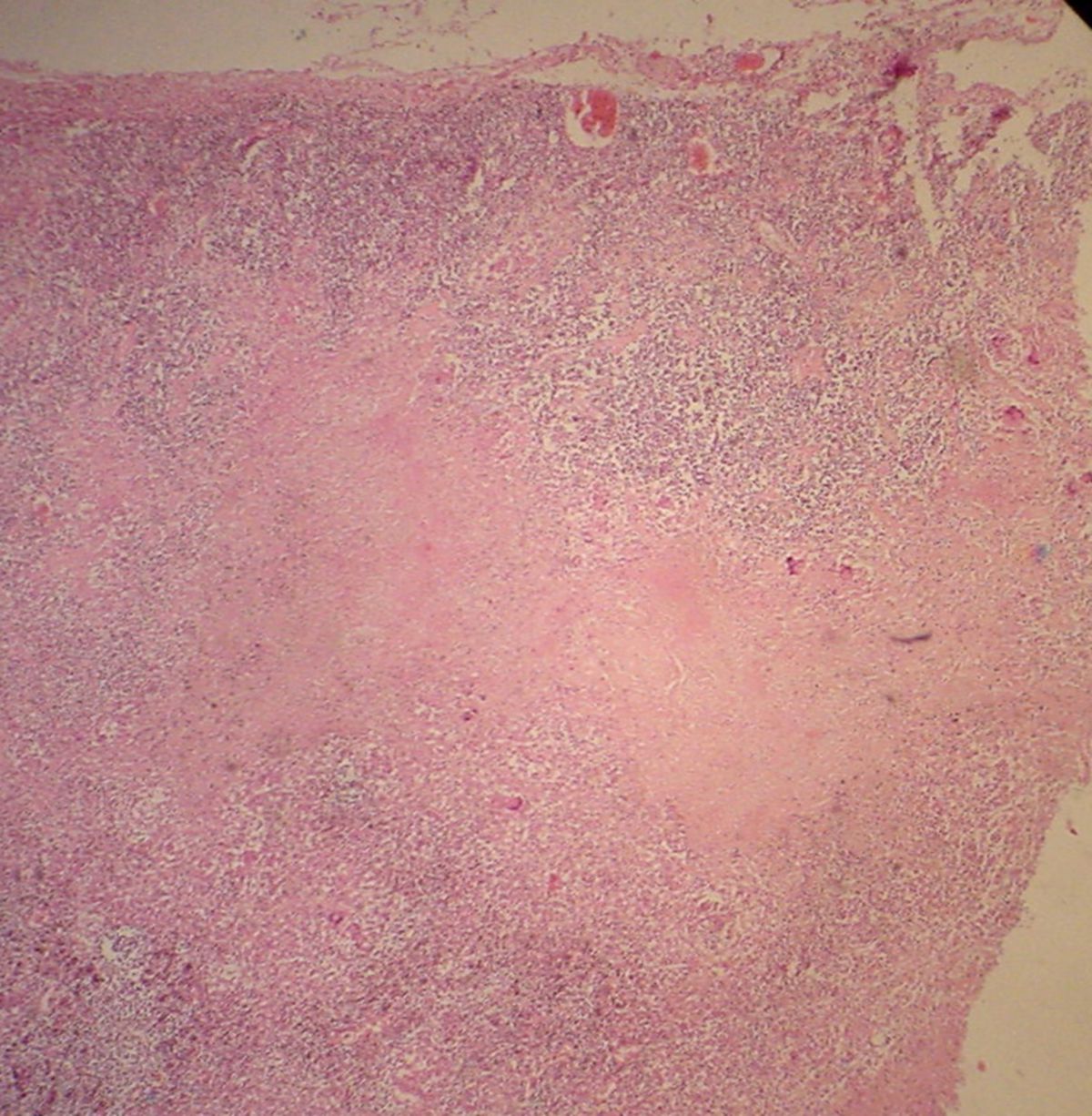
Beide Mechanismen können das Wachstum der Mykobakterien hemmen. Mit Ausbildung der spezifischen Immunität und Anhäufung von aktivierten Makrophagen am Ort der Primärinfektion entstehen Granulome bzw. Tuberkulome. Diese bestehen aus Lymphozyten und aktivierten Makrophagen, die sich zu Epitheloidzellen und Langhans-Riesenzellen differenzieren. Im Zentrum entsteht eine verkäsende Nekrose, die vitale Erreger enthalten kann. Durch den geringen Sauerstoffgehalt und niedrigen pH-Wert in der Nekrose wird das Erregerwachstum jedoch gehemmt. Einige der Läsionen können zu diesem Zeitpunkt durch Fibrosierung abheilen und anschließend verkalken.
Eine latente Tuberkulose entwickelt sich aus einem dynamischen Gleichgewicht zwischen Mikroorganismus und Wirt. Latente Infektion und manifeste Erkrankung stellen ein Kontinuum dar. Bisher (2024) existieren keine systemischen Biomarker, die es erlauben vorherzusagen, bei welchen Patienten eine Progression auftreten wird.
Extrapulmonale Läsionen durchlaufen die gleichen Reaktionsphasen wie in der Lunge, die meisten heilen allerdings ab. Bei Kleinkindern mit einer noch nicht voll ausgebildeten natürlichen Immunabwehr kann die hämatogene Aussaat z.B. zu einer Miliartuberkulose oder einer tuberkulösen Meningitis führen.
Makrophagenaktivierung
Makrophagen, welche die bakteriellen Antigene prozessiert haben, stimulieren T-Lymphozyten zur Produktion von Lymphokinen. Nur durch T-Lymphozyten bzw. Zytokine (IFN-γ, TNF-α) stimulierte Makrophagen können phagozytierte Mykobakterien abtöten.
Während die Makrophagen und T-Zellen (v.a. CD4-T-Zellen) die entscheidende Funktion bei der Abwehr von Mycobacterium tuberculosis ausüben, spielt die humorale Abwehr nur eine untergeordnete Rolle. Die von Alveolarmakrophagen ausgeschütteten Zytokine sind neben der Granulombildung auch für viele systemische Effekte (Fieber, Gewichtsverlust) verantwortlich. CD8-T-Zellen unterstützen zudem die spezifische Immunantwort durch Lyse der infizierten Makrophagen und Abtötung der Bakterien.
Verzögerte Hypersensitivitätsreaktion
Bei ausgeprägter, verzögerter Hypersensitivitätsreaktion kommt es zu einer Zerstörung des umliegenden Lungengewebes. Bronchialwände und Blutgefäße werden infiltriert und zerstört, sodass Kavernen entstehen, in denen Mykobakterien gut wachsen können. Das verflüssigte, erregerreiche Material wird über das Bronchialsystem drainiert.
Die verzögerte Hypersensitivitätsreaktion ist die Grundlage für den Tuberkulin-Hauttest (s.u.). Sie induziert zwar eine protektive Immunität, ermöglicht aber keinen sicheren Schutz vor einer Reaktivierung. Patienten, die bereits wegen einer aktiven Tuberkulose behandelt wurden, können durch einen neuen Mycobacterium-tuberculosis-Stamm reinfiziert werden.
Genetik
Genetische Faktoren spielen eine wichtige Rolle in der angeborenen, unspezifischen Resistenz gegenüber einer Infektion bzw. der Entwicklung einer aktiven Tuberkulose. Insbesondere NRAMP1 auf Chromosom 2 reguliert die Resistenz bzw. Empfindlichkeit gegenüber Mykobakterien. Weitere Polymorphismen betreffen verschiedene Allele von MHC, IFN-γ, Vitamin-D-Rezeptor und IL-1.
Weiterhin spielt das Chemokin MCP-1 (Makrophagen-Chemoattraktorprotein-1) eine Schlüsselrolle. Personen mit bestimmten genetisch bedingten MCP-1-Varianten – kodiert auf dem Genlokus 17q11.2 – erkranken fünfmal so häufig wie Personen mit der Normalvariante. Die Mutation des MCP-1-Gens führt dazu, dass der Körper zu viel MCP-1 bildet. Das wiederum blockiert in den Monozyten die Produktion von Interleukin-12p40. Durch das Fehlen dieser Zytokin-Untereinheit kann sich die Infektion leichter ausbreiten.
Klinik
Bei Erstinfektion kommt es nach einer Inkubationszeit von 6 bis 8 Wochen zu unspezifischen Symptomen wie:
- B-Symptomatik
- Fieber
- Nachtschweiß
- Gewichtsverlust (daher die Bezeichnung "Schwindsucht")
- Inappetenz
- Erythema nodosum
- Thoraxschmerzen
- Pleuritis exsudativa
- Konjunktivitis phlyctaenulosa
Die Erstinfektion kann jedoch auch asymptomatisch verlaufen, was die Diagnosestellung erschwert.
Bei Ausbildung eines tuberkulösen Primärkomplexes (Ghon-Komplex) oder bei primär pulmonalem Verlauf können hinzutreten:
Je nach Organbefall treten bei einer extrapulmonalen Tuberkulose weitere Symptome hinzu, sodass das klinische Bild insgesamt sehr vielfältig ist und Fehldiagnosen erzeugen kann.
Verlaufsformen
Bis zur Infektion, die mittels Immuntests nachweisbar ist, dauert es meist sechs bis acht Wochen.[1] Eine offene Lungentuberkulose tritt ungefähr sechs Monate nach einer Infektion auf. Reaktivierungen latenter Herde können noch nach Jahrzehnten auftreten.
Eine Tuberkulose kann sich in den verschiedenen Stadien der Erkrankung auf mannigfaltige Weise präsentieren. Mögliche Verlaufsformen in den einzelnen Phasen sind:
Primärtuberkulose
Unter einer Primärtuberkulose versteht man eine Organmanifestation nach Erstinfektion, meist als Resultat einer insuffizienten Abwehreaktion, v.a. bei Kindern in den ersten Lebensjahren sowie bei immundefizienten Patienten.
Die Primärtuberkulose manifestiert sich ungefähr sechs Wochen nach dem ersten Kontakt mit dem Mykobakterium. Bei der primären Lungentuberkulose kann der anfängliche Infektionsherd überall in der Lunge liegen, am häufigsten im Unterlappen. Sowohl mikroskopisch kleine Manifestationen bis hin zu lobären Konsolidierungen sind möglich. Kavitäten sind bei primärer Lungentuberkulose ungewöhnlich und kommen nur in 10-30 % der Fälle vor. In den meisten Fällen tritt die Infektion lokalisiert auf und es bildet sich ein verkäsendes Granulom, das in der Regel schließlich verkalkt und dann als Ghon-Fokus bezeichnet wird. Inbesondere bei Kindern finden sich eine ipsilaterale hiläre und paratracheale Lymphadenopathie. Dieses Muster findet sich bei über 90 % der Fälle einer Primärtuberkulose im Kindesalter, aber nur bei 10 bis 30 % der Erwachsenen. Die Kombination aus pulmonalem Primärherd und vergrößerten Hiluslymphknoten wird als Primärkomplex bezeichnet. Pleuraergüsse kommen bei Erwachsenen in 30 bis 40 % der Fälle, bei Kindern nur in 5 bis 10 % der Fälle vor.
Oft bleibt die primäre Lungentuberkulose asymptomatisch und heilt bei adäquater Immunreaktion aus. Eine Verkalkung der Herde wird in 35 % der Fälle beobachtet. Die Kombination aus verkalkten Hiluslymphknoten und verkalktem Primärherd (Ghon-Fokus) wird als Ranke-Komplex bezeichnet.
Ist die Immunität unzureichend, kann sich eine fortschreitende Primärtuberkulose mit der Möglichkeit einer Miliartuberkulose oder Landouzy-Sepsis entwickeln. Weitere Komplikationen sind Bronchusstenose mit Atelektase oder Überblähung, Bronchiektasien, eine Beteiligung von Pleura, Perikard oder der Brustwand (Empyema necessitans), bronchopleurale Fisteln, eine Phrenikusparese oder eine Beteiligung der Speiseröhre oder des Ductus thoracicus.
Postprimärtuberkulose
Als Postprimärtuberkulose (PPTB) bezeichnet man eine erneute aktive Tuberkuloseinfektion nach durchlebter Primärtuberkulose. Eine PPTB kann durch endogene Reaktivierung vorbestehender Herde (häufiger) oder nach erneuter Exposition (seltener) verursacht werden. Eine PPTB entwickelt sich in etwa 5 bis 10 % der Fälle, meist bei immungeschwächten Patienten. Der zeitliche Abstand zur Primärtuberkulose kann mehrere Wochen bis Jahrzehnte dauern.[1] Am häufigsten ist ebenfalls die Lunge betroffen, insbesondere die posterioren Oberlappensegmente und superioren Unterlappensegmente. Bei Kommunikation mit den Atemwegen liegt eine offene Tuberkulose mit Infektiösität und Möglichkeit einer endobronchialen Ausbreitung vor.
Seltenere Manifestationsformen sind lobäre Konsolidierungen, Tuberkulome oder eine Miliartuberkulose. Mögliche Kompliktionen sind Lungenblutung, Pleuritis, Pleuraempyem, respiratorische Insuffizienz, Narbenkarzinom und Amyloidose.
Latente Tuberkulose
Von einer latenten Tuberkulose spricht man bei einer Erstinfektion mit erfolgreicher Eindämmung der Erreger, jedoch mit Persistenz im Organismus. Ein Ausbrechen der Erkrankung ist bei gesundem Immunsystem nicht zu erwarten. Bei Immundefizienz ist jedoch eine Progredienz hin zu einer aktiven Erkrankungen möglich. Die Wahrscheinlichkeit aus einer latenten Infektion heraus zu erkranken, ist in den ersten beiden Jahren am höchsten.[1] Das Risiko ist bei HIV-Infektion deutlich erhöht. Auch Reinfektionen bei bereits infizierten Personen, insbesondere in Gebieten mit hohen Übertragungsraten, können die Ausbildung einer aktiven Tuberkulose begünstigen.
Miliartuberkulose
Bei disseminierter hämatogener Ausbreitung spricht man von einer Miliartuberkulose. Diese Verlaufsform kann sowohl bei Primär- als auch bei Postprimärtuberkulose auftreten und geht mit einer hohen Mortalität einher. Die genaue Häufigkeit der Miliartuberkulose ist unklar, vermutlich beträgt sie < 2 %.
Extrapulmonale Tuberkulose
Bei einer Manifestation in anderen Organsystemen spricht man von einer extrapulmonalen Tuberkulose, die in der Regel im Rahmen einer postprimären Tuberkulose auftritt.
Thorakale extrapulmonale Tuberkulose
Wie bereits erwähnt, kann die Tuberkulose praktisch jede thorakale Struktur betreffen. Neben der tuberkulösen Lymphadenitis ist insbesondere die tuberkulöse Pleuritis eine häufige Manifestation. Herz und thorakale Blutgefäße sind nur selten beteiligt, jedoch ist die tuberkulöse Perikarditis die häufigste kardiovaskuläre Komplikation einer Tuberkulose. In Folge kann es zu einer Pericarditis constrictiva kommen. Eine Beteiligung des Myokards mit Tuberkulomen ist sehr selten und meist assoziiert mit einer Miliartuberkulose.
Lymphknotentuberkulose
Die häufigste Form ist die Lymphknotentuberkulose, die in ungefähr 1/3 der Fälle vorkommt. Sie ist gekennzeichnet durch (teils nekrotische) Lymphadenopathie, Lymphadenitis und B-Symptomatik. Nach Ausheilung verkalken die Lymphknoten meist. Typische Lokalisationen sind das dorsale Halsdreieck und der ileozökale Übergang, seltener eine Beteiligung der Milz.
Muskuloskelettale Tuberkulose
Die muskuloskelettale Tuberkulose (Knochen- und Gelenktuberkulose) ist die zweithäufigste extrapulmonale Manifestation, wobei in erster Linie die thorakolumbale Wirbelsäule in Form einer tuberkulösen Spondylitis betroffen ist. Leitsymptom sind unklare Rückenschmerzen mit nächtlicher Schmerzexazerbation oder dumpfe Rückenschmerzen, die durch Druck verstärkt werden. Vorwiegend ist die Wirbelkörpervorderkante betroffen, sodass es zu einer diskontinuierlichen Ausbreitung über das vordere Längsband auf andere Bandscheibenfächer kommt (Skip Lesions). Durch Ausbreitung per continuitatem kann sich im Verlauf ein paravertebraler Abszess (Pott-Abszess) entwickeln.
Des Weiteren kann es zu einer tuberkulösen Arthritis kommen. Sie tritt vorwiegend sekundär nach einer Osteomyelitis auf, betrifft meist nur ein Gelenk und insbesondere die Hüfte oder das Knie. Seltener sind kleinere Gelenke betroffen.
Eine Sonderform ist der Morbus Poncet, eine reaktive Arthritis während der akut exazerbierten Tuberkulose.
Weitere mögliche Manifestationen sind eine Osteitis, eine Bursitis und sehr selten eine Tenosynovitis.
Urogenitaltuberkulose
Die Urogenitaltuberkulose betrifft meist die Nieren (Kittniere) und die ableitenden Harnwege. Typische Symptome sind Dysurie, Pollakisurie, kolikartige Flankenschmerzen oder eine Hämaturie. Aufgrund der fortschreitenden Entzündung kommt es zu narbigen Stenosen oder Strikturen mit konsekutiver Hydronephrose.
Seltener sind die Sexualorgane direkt betroffen. Mögliche Manifestationen bei Männern sind Epididymitis, Orchitis, Prostatitis oder Spermatozystitis. Bei Frauen sind meist die Adnexe oder der Uterus betroffen, seltener Cervix uteri, Vagina und Vulva. Komplizierend kann eine Infertilität die Folge sein.
Abdominelle Tuberkulose
Eine tuberkulöse Peritonitis tritt meist im Rahmen einer Miliartuberkulose auf, kann aber auch sekundär bei Darm- oder Urogenitaltuberkulose vorkommen. Bei den peritonealen Manifestationen unterscheidet man drei Formen mit absteigender Inzidenz:
- Wet-ascitic-Typ: nekrotische, proteinreiche Flüssigkeitskollektionen
- Fibrotic-fixed-Typ: beispielsweise kolliquierte Gewebevermehrung entlang des Mesenterialstiels oder des Omentum
- Dry-plastic-Typ: große inflammatorische Reaktion mit diffusen fibrotischen Adhäsionen und Noduli entlang des Peritoneums
Bei Beteiligung der Leber finden sich unspezifische Symptome wie Hepatomegalie, Cholestase und Transaminasenanstieg. Bildmorphologisch lassen sich mikro- oder makronoduläre (> 2 cm) Läsionen nachweisen. Bei der Miliartuberkulose kommt es zu disseminierten, mikronodulären Läsionen mit hypodensem Kern um 30 bis 40 HU sowie flauer Kontrastierung des Randsaums. Auch die selteneren, singulären makronodulären Läsionen zeigen dieses Bild in der CT. Bei Milzbeteiligung ist die häufigste Erscheinungsform ebenfalls nur eine Organvergrößerung, wobei Mikroabszesse vorkommen können. Im Endstadium finden sich verkalkte Granulome.
Im Gastrointestinaltrakt kommt es primär zu einem Befall des lymphatischen Gewebes an der Ileozökalklappe, gefolgt von Jejunum und Kolonrahmen. Begleitend finden sich oft große nekrotische Lymphknoten. Mögliche Symptome sind z.B. Appetitlosigkeit, Übelkeit, Bauchschmerzen, Diarrhoe und B-Symptomatik.
Selten können auch andere solide abdominelle Organe wie die Gallenblase oder das Pankreas beteiligt sein. Sie treten meist bei disseminierter Erkrankung auf.
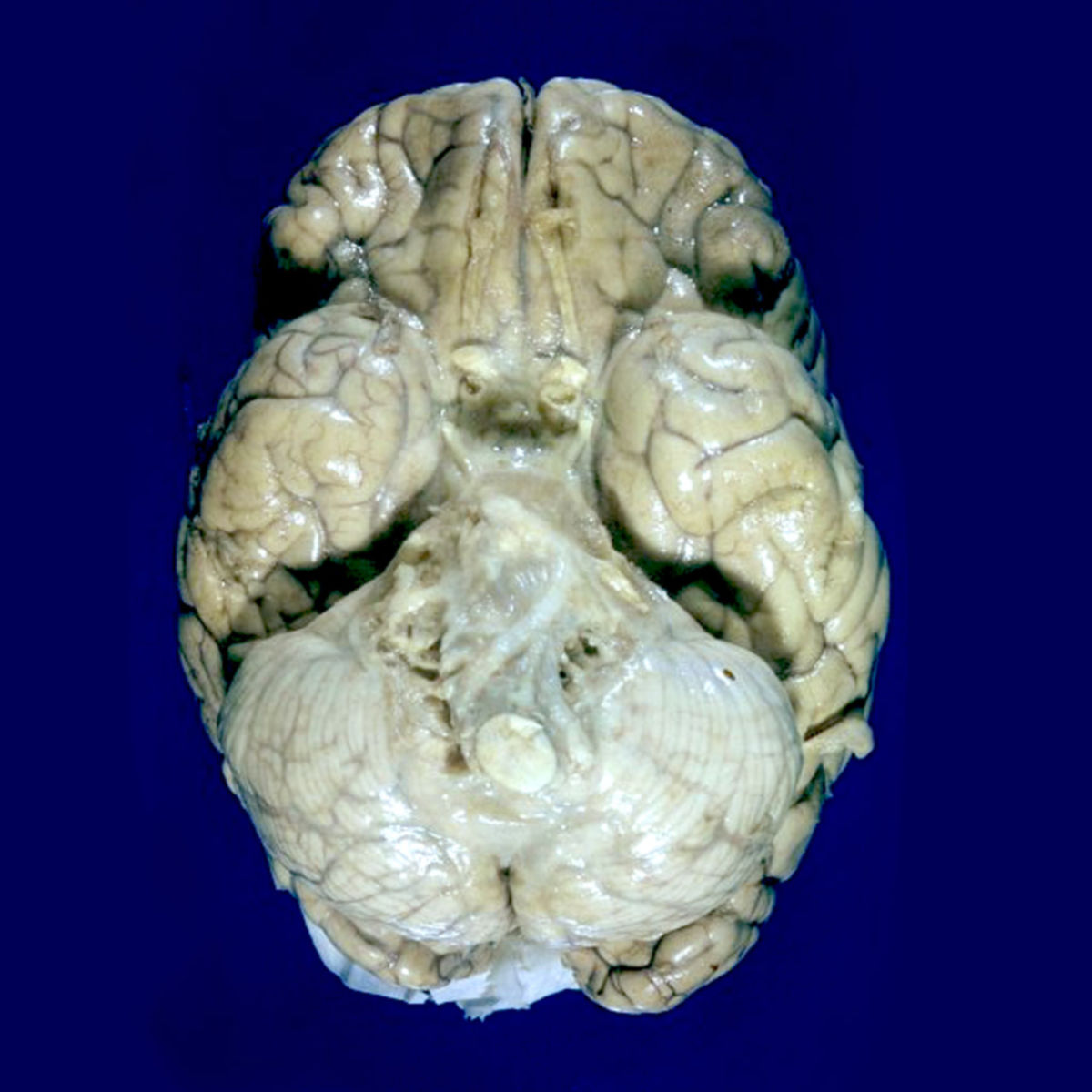
ZNS-Tuberkulose
Die seltenere Beteiligung des ZNS erfolgt meist über die Leptomeningen in Form einer tuberkulösen Leptomeningitis. Neben klassischen Meningitis-Symptomen (z.B. Nackensteifigkeit, Kopfschmerzen, Vigilanzminderung) ist die Liquoruntersuchung entscheidend. In der MRT zeigt sich eine Kontrastmittelaffinität der Leptomeningen, insbesondere basal. Bei fortschreitender Entzündung treten pachymeningeale und parenchymale Tuberkulome auf. Sie stellen sich als abgekapselte, meist verkalkte Rundherde dar. Dabei werden nicht-verkäsende und verkäsende (zentral nekrotische) Herde unterschieden. Letztere finden sich insbesondere bei älteren Patienten mit Immundefizienz und zeigen sich bildmorphologisch als Abszessformationen.
Durch Ausbreitung der leptomeningealen Entzündung kann eine tuberkulöse Radikulomyelitis entstehen. Sie ist gekennzeichnet durch radikuläre Beschwerden und bildmorphologisch durch ein unregelmäßig verdicktes meningeales Enhancement, teils mit Beteiligung der Nervenwurzel.
Seltene Formen
Deutlich seltenere Formen sind beispielsweise:
- Beteiligung von Glandula parotidea
- Beteiligung von Glandula thyreoidea
- Nebennierentuberkulose: Morbus Addison
- Hauttuberkulose
Silikotuberkulose
Eine Sonderform ist die Silikotuberkulose. Sie liegt vor, wenn neben einer Silikose gleichzeitig eine aktive Lungentuberkulose nachweisbar ist.
Diagnostik
Anamnese und Untersuchung
Die Verdachtsdiagnose einer Tuberkulose ergibt sich aus der Zusammenschau von Anamnese und körperlicher Untersuchung. Anamnestisch sind insbesondere infizierte Kontaktpersonen, frühere Verdachtsmomente oder Manifestationen einer Tuberkulose und eine orientierende Beurteilung des Immunstatus zu erheben.
Klinisch stehen die unspezifischen Symptome, eventuell ergänzt durch pulmonale Symptome im Vordergrund. Labormedizinisch kann es zudem zu erhöhten unspezifischen Entzündungsparametern kommen (CRP, BSG, Leukozytose).
Bildgebung
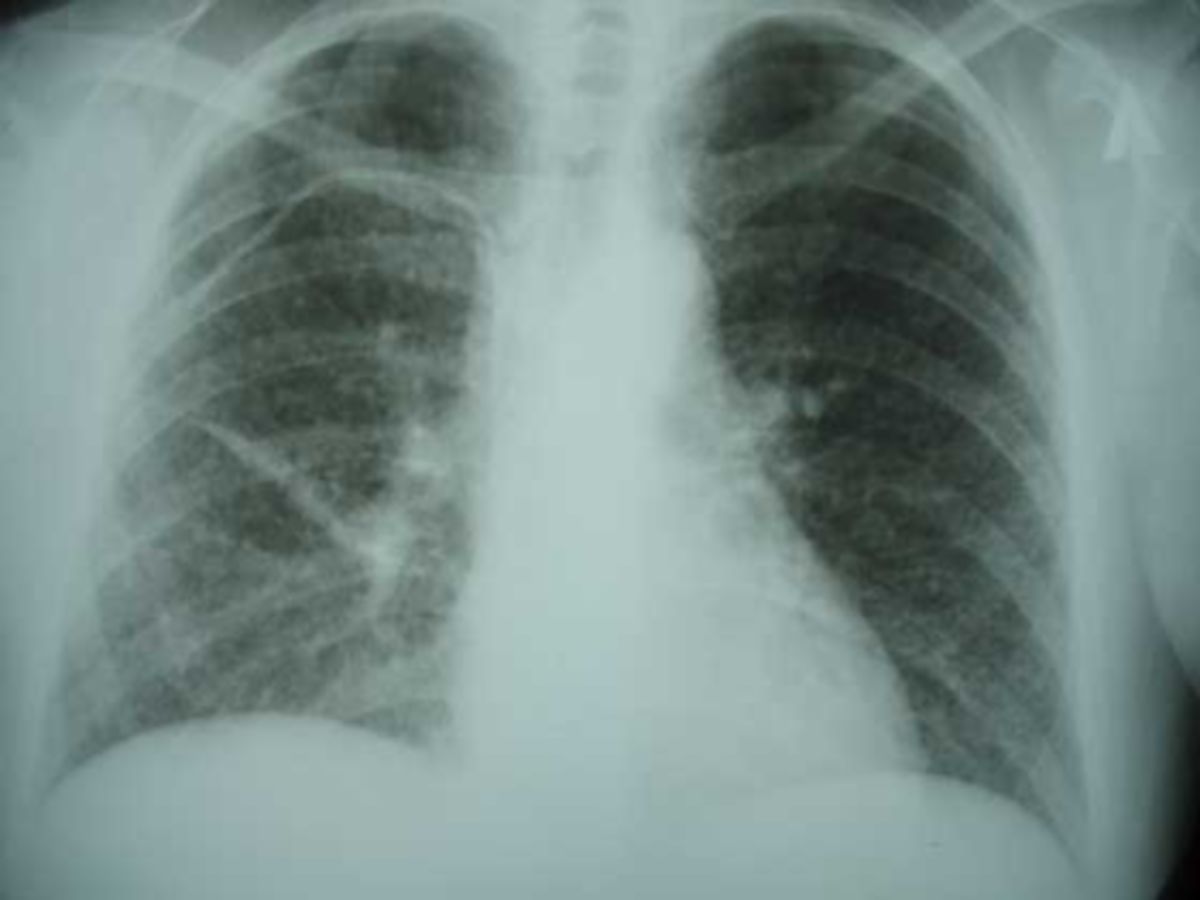
Ein Röntgen-Thorax kann einen Primärkomplex, Simon-Spitzenherde oder Assmann-Frühinfiltrate aufdecken. Bei begründetem Verdacht auf eine frische oder vorangegangene Infektion sollte die Röntgenaufnahme in nahem zeitlichen Abstand (z.B. 3 Monate) wiederholt werden. Alternativ oder ergänzend kann auch eine Computertomographie durchgeführt werden, die bezüglich kleinster Läsionen sensitiver ist.
Bei der Primärtuberkulose finden sich typischerweise folgende Thoraxbefunde:
Für eine postprimäre Tuberkulose sprechen Oberlappen-betonte, heterogene, oft fleckige Konsolidierungen. Ferner findet man unscharf begrenzte, lineare oder noduläre Verdichtungen. Im Vergleich zur Primärtuberkulose treten deutlich häufiger Kavitäten bzw. Kavernen auf, sie kommen in 20 bis 45 % der Fälle vor. Weitere radiologische Merkmmale sind Bronchialwandverdickungen und als Zeichen der aktiven endobronchialen Dissemination zentrilobuläre und azinäre Lungenrundherde mit Tree-in-Bud-Muster sowie lobuläre Konsolidierungen.
Bei der Miliartuberkulose zeigen sich scharf begrenzte Mikronoduli mit zufälliger (miliarer) Verteilung.
CT-Fallbeispiel
DICOM-Modelle können auf Mobilgeräten leider nicht angezeigt werden.
Hauttest
Ein Tuberkulin-Hauttest (Mendel-Mantoux-Test) ist ein nicht beweisender, jedoch einfach durchzuführender Test mit intrakutaner Applikation von gereinigten Erregerextrakten. Das Testergebnis lässt sich frühestens nach 2 Tagen beurteilen. Die Reaktion beruht auf einem Ansprechen sensibilisierter T-Lymphozyten. Weder Sensitivität noch Spezifität des Hauttests sind für die Diagnose einer Tuberkulose ausreichend. Er ist also oft falsch-negativ und kann zudem durch eine stattgehabte BCG-Impfung falsch-positiv werden.
Mikrobiologische Diagnostik
Zur Sicherung der Diagnose sollte ein Erregernachweis angestrebt werden. Dazu muss für die mikrobiologische Diagnostik erregerhaltiges Material gewonnen werden. Geeignet sind:
- Sputum
- Magensaft
- Bronchialsekret (nach BAL)
- Urin (bei V.a. urogenitalen Befall)
- Abstriche von verdächtigen Hautläsionen
- Probeexzisionen verdächtigen Materials
- Aspirierte Flüssigkeiten aus Punktionen (z.B. Lymphknotenpunktion)
- Ejakulat
Die Diagnostik kann auf mehreren Wegen parallel ablaufen. Mögliche Methoden sind PCR, Bakterienkultur und mikroskopischer Nachweis.
PCR
Eine positive PCR lässt auf das Vorliegen einer Erkrankung mit Erregern des Mycobacterium-tuberculosis-Komplex schließen. Für den Test sind folgende Schritte nötig:
- Sputum, Bronchial-Lavage, etc. unter Ausschluss von Kontaminationsmöglichkeiten gewinnen
- Entfernen von Inhibitoren (Zentrifugieren, Waschen)
- Inaktivierung der Keime durch Hitzebad
- Lyse zum Freisetzen der DNA
- Qualitätskontrolle: Aktivieren von Negativkontrolle und Kalibrator
- DNA-Amplifikation (Thermocycler)
- Detektion mittels spezifischer Gensonden und Messung, z.B. mit der MEIA-Methode
Bei dringendem Verdacht auf eine infektiöse Tuberkulose ist die PCR stets auch aus forensischen Gründen indiziert, da bis zum Verstreichen des kulturellen Ergebnisses (z.T. mehrere Wochen) von einem Indexfall bereits multiple (vermeidbare) Sekundärfälle ausgegangen sein können. Die PCR ersetzt die mikroskopische Untersuchung. Die Kultur muss zusätzlich angesetzt werden, da sie als Substrat für die Resistenzprüfung dient. Die PCR auf Erreger-DNA sollte durch eine Kontrolle bestätigt werden.
Kultur
Die Anzucht im Kulturmedium gilt als sensitivste Methode zum Nachweis einer vorliegenden Infektion. Zunächst müssen die Proben vorbehandelt werden. Dies umfasst die Dekontamination des Untersuchungsmaterials mit N-Acetyl-L-Cystein-NaOH und die Zentrifugation. Anschließend wird das Sediment auf Nährmedien eingebracht. Bei einer Bakterienkultur mit Antibiogramm schließt eine negative Kultur eine Tuberkulose nicht aus, eine positive Kultur ist beweisend.
Flüssigmedium
Testprinzip: Falls Mykobakterien im Nährmedium vorkommen (modifiziertes Kirchner-Medium mit Vitaminkomplex für beschleunigtes Wachstum), wandelt das Redox-System der Mykobakterien das farblose Tetrazoliumsalz in ein wasserunlösliches, stabiles rosa bis violettes Formazan um. Ein Farbumschlag in dem Fläschchen der Flüssigkultur weist auf Mykobakterien hin.
Andere Keime werden durch das Nährmedium und das Antibiotikagemisch supprimiert (PACT= Polymyxin B, Amphotericin B, Carbenicillin, Trimethoprim). Etwa 10 Bakterien/ml reichen aus, um ein positives Ergebnis zu erzielen.
Festmedien
Eine Kultivierung auf festem Nährboden nimmt über 4 Wochen in Anspruch, in Flüssigmedien (BACTEC-Verfahren) kann der Nachweis innerhalb von 2 Wochen gelingen. Es werden ca. 100 Bakterien/ml benötigt, um ein positives Ergebnis zu erzielen.
Mikroskopischer Nachweis
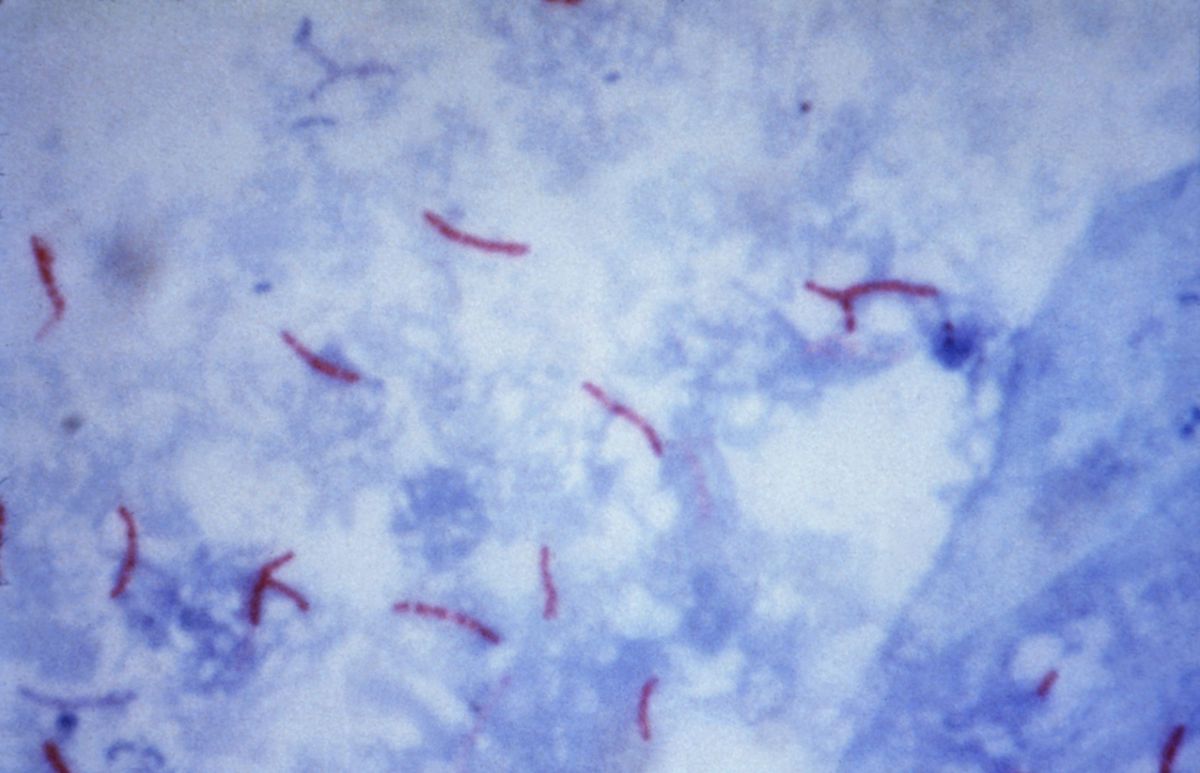
Nach der Anreicherung ist die Mikroskopie von Untersuchungsmaterial mit der Ziehl-Neelsen-Färbung möglich. Die Nachweisgrenze ist hoch, es müssen mindestens 104 Keime/ml vorhanden sein, um ein positives Ergebnis zu erhalten. Ein negativer Befund schließt eine Tuberkulose nicht aus, ein positiver Befund ist nicht beweisend. Zwischen Tuberkulosebakterien und ubiquitär vorkommenden Mykobakterien kann nicht unterschieden werden.
Immunologische Diagnostik
Der Interferon-Gamma-Release Assay (IGRA) ermöglicht einen schnellen und zuverlässigen Nachweis. Er liefert eine gute Sensitivität und Spezifität und ist unabhängig von einer evtl. stattgehabten BCG-Impfung. Der IGRA entwickelt sich aktuell mehr und mehr zum Goldstandard der Tuberkulosediagnostik – immer ergänzt durch parallele mikrobiologische Diagnostik.
Bei einer eliminierten (ausgeheilten) Tuberkuloseinfektion können immunologische Tests sowohl positiv als auch negativ sind. Bei einer latenten Infektion sind sie in der Regel positiv.
Histologie
Therapie
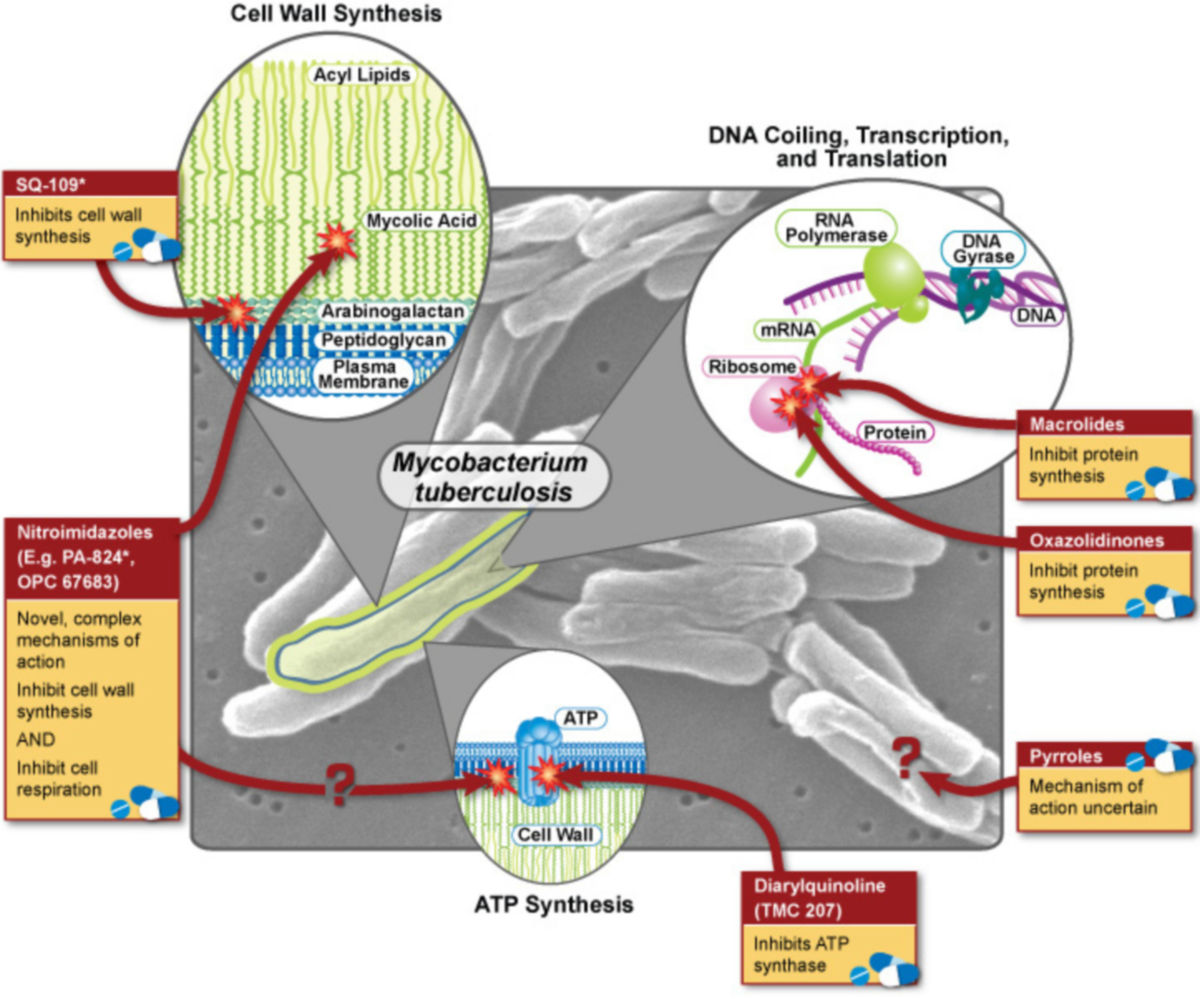
Die Behandlung der Tuberkulose erfolgt mit einer Mehrfachkombination von Antibiotika, sogenannten Tuberkulostatika, über mehrere Monate.
siehe Hauptartikel: Medikamentöse Therapie der Tuberkulose.
Flankiert wird die Tuberkulosetherapie durch Mitbehandlung eventuell vorliegender Begleiterkrankungen, die eine Immundefizienz bewirken. In die gleiche Richtung zielen das Einstellen eines Nikotinabusus bzw. Alkoholismus.
Antibiotikaresistenz
Das vermehrte Auftreten von bakteriellen Antibiotikaresistenzen hat die Behandlung der Tuberkulose in den letzten Jahren deutlich erschwert. Auslöser ist der falsche oder unkontrollierte Einsatz der verfügbaren Tuberkulostatika. Auf dieser Basis hat man Sonderformen der Tuberkulose definiert. Dazu zählen:
- Rifampicin-resistente Tuberkulose (RR-TB): 2016 weltweit ca. 100.000 Fälle
- Multiresistente Tuberkulose (MDR-Tb): mindestens gegen Isoniazid und Rifampicin resistent. 2016 weltweit ca. 500.000 Fälle[11]
- Extrem arzneimittelresistente Tuberkulose (XDR-Tb): zusätzliche Resistenz gegenüber Medikamenten der 2. Wahl (Fluorchinolone, Amikacin, Kanamycin, Capreomycin).
Insgesamt ereignen sich 47 % der Fälle mit MDR-Tb in Indien, China und Russland.
Weltweit könnten etwa 6,2 % der MDR-TB-Fälle tatsächlich XDR-Fälle sein.[11] Die überwiegende Zahl dieser Erkrankungen wird nicht diagnostiziert, da zuverlässige Methoden zur Empfindlichkeitstestung fehlen und die Laborkapazitäten ausgeschöpft sind.
Prävention
- Quarantäne von Patienten mit offener Tuberkulose
- Ausrottung der Rindertuberkulose
Eine Impfung mit dem derzeit verfügbaren BCG-Impfstoff wird nicht empfohlen.
Prognose
Bei adäquater Behandlung ist eine Tuberkulose in den meisten Fällen heilbar. Unbehandelt versterben ca. ein Drittel der Patienten innerhalb von einem Jahr nach Diagnosestellung und 50 bis 65 % innerhalb von 5 Jahren. Von den nach 5 Jahren noch lebenden, unbehandelten Patienten weisen ca. 60 % eine Spontanremission auf, während die restlichen Personen weiterhin Bakterien ausscheiden.
Meldepflicht
Für die Tuberkulose besteht nach Infektionsschutzgesetz (§ 6 Abs. 1) eine namentliche Meldepflicht gegenüber dem Gesundheitsamt innerhalb von 24 h. Dies gilt auch, wenn kein bakteriologischer Nachweis vorliegt. Zudem muss gemeldet werden, wenn eine Person die Behandlung verweigert oder abbricht.[1]
Quiz
Quellen
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 RKI - Tuberkulose, abgerufen am 15.03.2022.
- ↑ RKI - Epidemiologisches Bulletin, 2017.
- ↑ BMZ - Bekämpfung der Tuberkulose, abgerufen am 15.03.2022.
- ↑ Bundesregierung - Tuberkulose soll ausgelöscht werden, abgerufen am 15.03.2022.
- ↑ WHO - Tuberkulose und Geschlecht, abgerufen am 15.03.2022.
- ↑ Healio News - Children with TB: A global public health crisis, abgerufen am 15.03.2022.
- ↑ Deutsche Aidshilfe - WHO-Bericht: HIV und Tuberkulose an der Spitze der tödlichen Infektionskrankheiten , abgerufen am 15.03.2022.
- ↑ 8,0 8,1 RKI - Bericht zur Epidemiologie der Tuberkulose in Deutschland, 2020.
- ↑ Bericht zur Epidemiologie der Tuberkulose in Deutschland, 20.03.2025, Robert Koch Institut
- ↑ WHO - Global tuberculosis report, 2021.
- ↑ 11,0 11,1 WHO - Tuberculosis: Multidrug-resistant tuberculosis (MDR-TB), abgerufen am 15.03.2022.
Literatur
- MSD Manual - Tuberkulose, abgerufen am 15.03.2022
Bildquelle
- Bildquelle für Flexikon-Quiz: ©Public Health Image Library / CDC
- Bildquelle DICOM-Viewer: Datensatz freundlicherweise zur Verfügung gestellt durch die Klinik für diagnostische und interventionelle Radiologie, St. Vinzenz Hospital Köln