HIV-Infektion
Englisch: HIV infection
Definition
Als HIV-Infektion wird eine Infektion mit dem HI-Virus bezeichnet. Sie zählt weltweit zu einer der häufigsten Krankheiten. Die HIV-Infektion kann unterschiedliche klinische Ausprägungen haben und führt unbehandelt bei der überwiegenden Zahl an Betroffenen zu AIDS.
Erreger
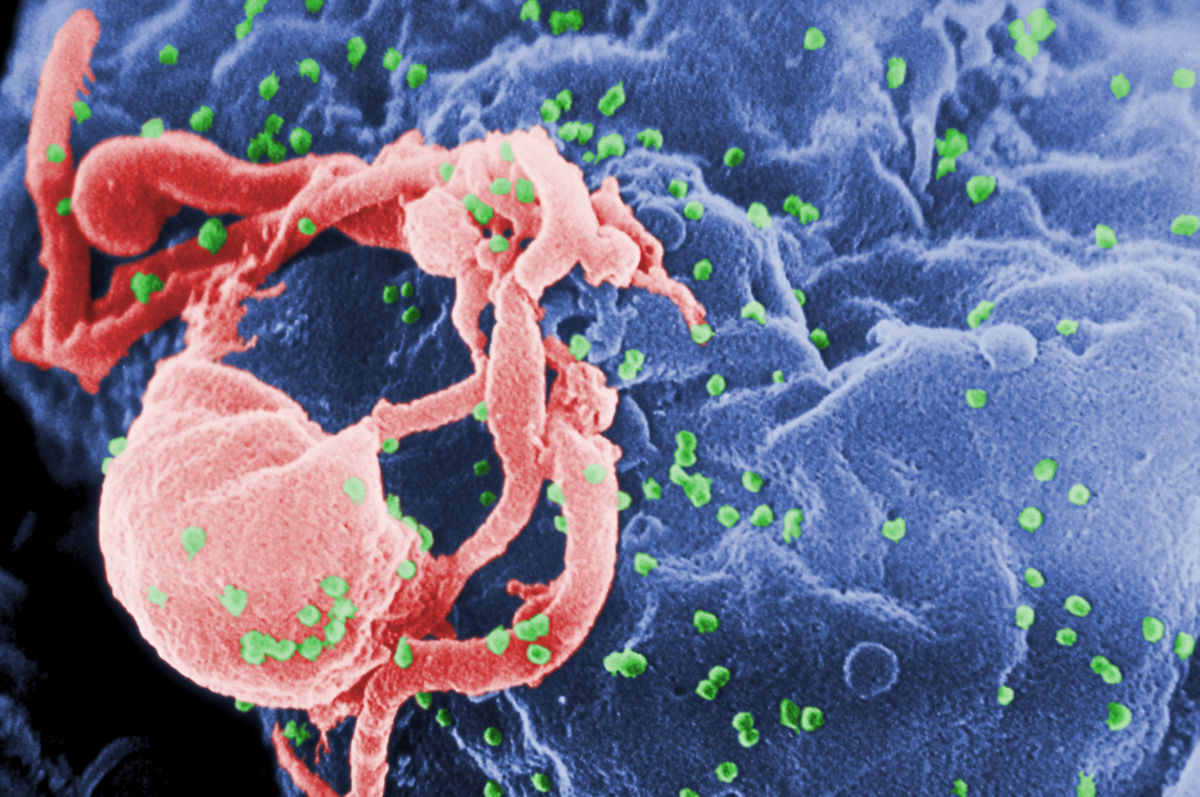
Das humane Immundefizienz-Virus (HIV) ist ein RNA-Virus, das zur Gattung der Lentiviren innerhalb der Familie der Retroviren zählt. Es sind zwei Typen bekannt: HIV-1 und HIV-2. Von beiden existieren wiederum weitere Subtypen.
HI-Viren sind von einer Hülle aus Phospholipiden umgeben, die von der Wirtszellmembran stammen. In diese sind Glykoproteine eingebettet, die für den Zellbefall entscheidend sind. Im Inneren befindet sich ein kegelförmiges Kapsid, das die zwei RNA-Stränge umgibt. Zudem befinden sich im Kern virale Proteine, die für die Virusreplikation entscheidend sind: Die reverse Transkriptase schreibt die RNA in der Zelle in DNA um, woraufhin die Integrase diese in das humane Genom integriert.
siehe Hauptartikel: HI-Virus
Übertragung
Das HI-Virus ist sehr empfindlich gegenüber Luftexposition und Desinfektionsmitteln, sodass eine Übertragung durch Tröpfchen- oder Schmierinfektion nahezu ausgeschlossen ist.
Vor allem ein direkter Kontakt mit Körperflüssigkeiten, vorwiegend mit Blut und Genitalsekreten, führt zu einer Aufnahme des Virus und damit zu einer HIV-Infektion.
Typische Übertragungswege sind Geschlechtsverkehr, Gebrauch von infizierten Kanülen (Nadelstichverletzung) oder medizinischen Geräten und die intravenöse Übertragung von Blutprodukten. Eine perinatale Weitergabe von der infizierten Mutter an das Kind ist möglich, ebenso eine Übertragung des Virus durchs Stillen.
Inkubationszeit
Die Inkubationszeit kann von 6 Tagen bis zu 6 Wochen betragen. Meist manifestiert sich die Infektion nach zwei bis drei Wochen. Das Krankheitsbild ist oft unspezifisch und entspricht dem eines akuten viralen Infekts (z.B. grippaler Infekt). Darauf folgt ein Stadium, in dem meist keine oder nur sehr milde Symptome vorliegen. Dieses kann sich über Monate oder Jahre ausstrecken. Danach können klinische Symptome wieder vermehrt auftreten und sich als schwerer Immundefekt äußern. Unbehandelt erkrankt etwa die Hälfte der Infizierten nach 10 Jahren an AIDS.
Epidemiologie
Weltweit waren 2020 ungefähr 38 Millionen Menschen mit HIV infiziert, 680.000 Menschen starben an den Folgen von AIDS. In Deutschland lebten 2020 ca. 91.400 Menschen mit HIV, was einem Anteil von 0,1 % der Bevölkerung entspricht. Etwa 2.000 Menschen in Deutschland haben sich 2020 neu mit HIV infiziert, wobei die Tendenz sinkend ist. In Deutschland erkranken rund 900 Menschen pro Jahr an AIDS oder einem schweren Immundefekt.[1] Im Jahr 2020 starben 380 Menschen in Deutschland an den Folgen von AIDS.[2]
Große Teile Afrikas und Südostasiens gelten als Hochrisikogebiete. Man geht davon aus, dass in manchen Ländern zwischen 30 und 50 % der Bevölkerung von einer HIV-Infektion betroffen ist.
Einteilung
Die HIV-Infektion wird entsprechend der CDC-Klassifikation (Centers for Disease Control and Prevention) klinisch und laborchemisch in jeweils drei Kategorien unterteilt.
Klinische Einteilung
- Kategorie A:
- Akute HIV-Erstinfektion mit grippeähnlichen Symptomen
- Asymptomatische latente HIV-Infektion ± Lymphadenopathie-Syndrom
- Kategorie B (Symptome oder Begleiterkrankungen, die noch nicht unter die AIDS-Definition fallen):
- Fieber (> 38,5 °C)
- Diarrhö (länger als vier Wochen)
- Mundsoor
- Orale Haarleukoplakie (durch EBV-Infektion)
- ITP
- Listeriose
- Rezidivierender Herpes zoster
- Periphere Neuropathie
- Kategorie C (manifestes AIDS):
- Wasting-Syndrom
- HIV-Enzephalopathie mit Demenz
- Opportunistische Infektionen (z. B. PjP, CMV-Retinitis, Toxoplasma-Enzephalitis, Tuberkulose, systemische Candidiasis, Kryptokokkose, Progressive multifokale Leukenzephalopathie)
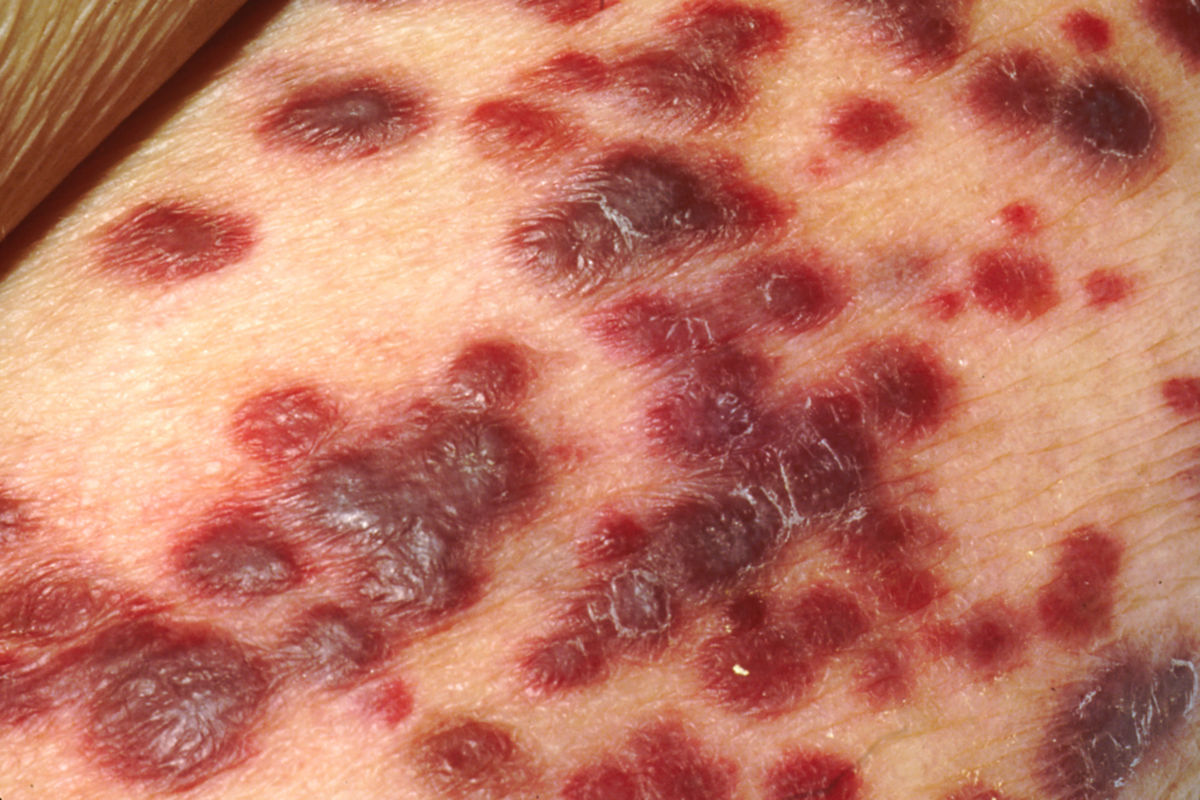
- maligne Erkrankungen (z. B. Kaposi-Sarkom, NHL wie das Burkitt-Lymphom, Zervixkarzinom)
Laborchemische Einteilung
Laborchemisch unterscheiden die CDC ebenfalls drei Kategorien anhand der Anzahl CD4-positiver Lymphozyten (sprich das Ausmaß der T-Zell-Depletion):
- Kategorie 1: ≥ 500 CD4-Lymphozyten/μl
- Kategorie 2: 200 - 499 CD4-Lymphozyten/μl
- Kategorie 3: < 200 CD4-Lymphozyten/μl
Diagnostik
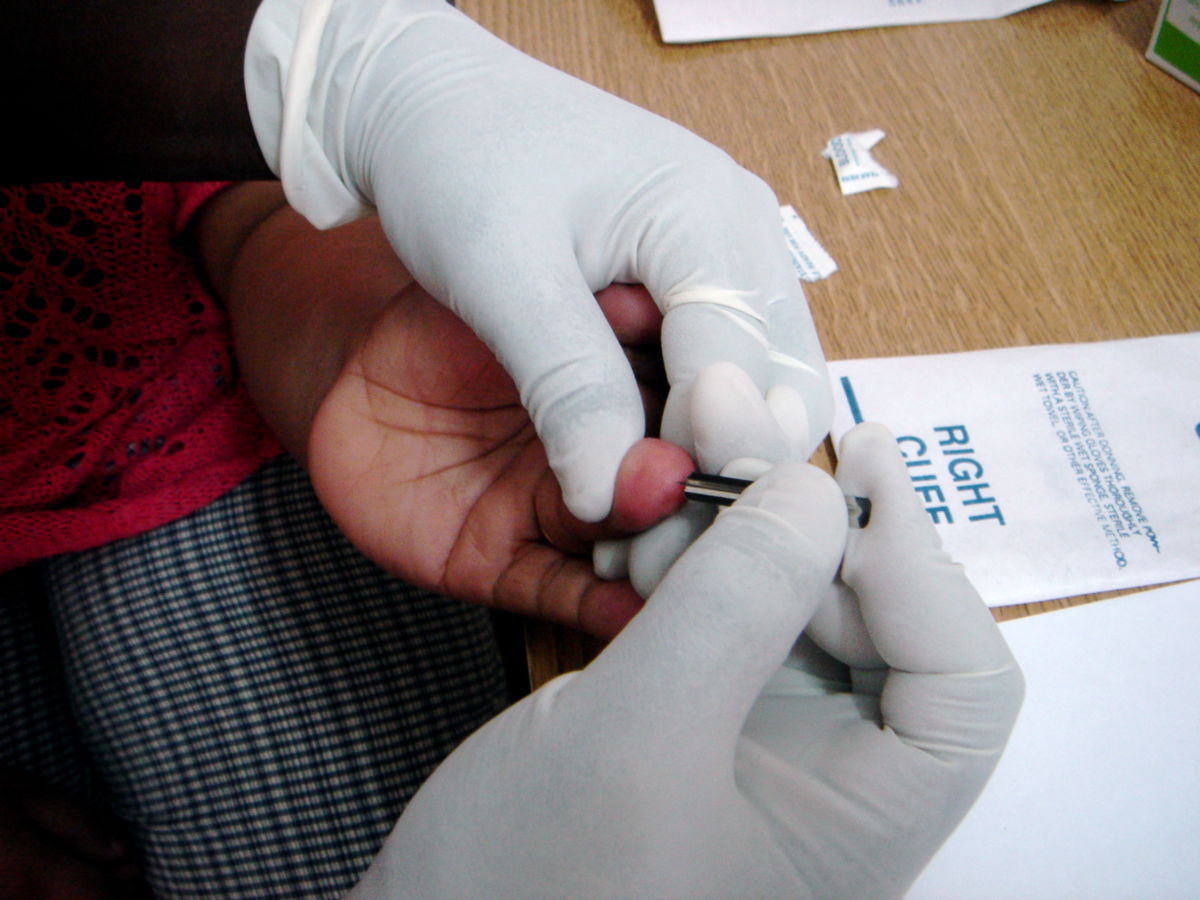
Die Diagnostik basiert auf dem kombinierten Nachweis von spezifischen Antikörpern und viralen Proteinen oder Nukleinsäuren. Eine Testung auf HIV bedarf grundsätzlich der Einwilligung des Patienten. Eine Testung ohne Einwilligung des Patienten ist nicht erlaubt und kann sogar als Straftat gewertet werden. Dies gilt sowohl im Krankenhaus, z.B. bei Untersuchungen vor operativen Eingriffen, als auch bei Einstellungsuntersuchungen.
Da erst nach etwa 6 Wochen die ersten viralen Proteine in ausreichender Konzentration im Blut nachweisbar sind, muss nach einer Exposition diese Zeitspanne abgewartet werden, bevor ein aussagekräftiger Test durchgeführt werden kann.
Suchtest
Der routinemäßig durchgeführte HIV-Suchtest beruht auf dem serologischen Nachweis von im Blut befindlichen Antikörpern gegen Proteine von HIV-1 und HIV-2, sowie des p24-Proteins des Viruskapsids (kombinierter Antigen/Antikörpertest) im ELISA-Verfahren. Bis zur Nachweisbarkeit spezifischer Antikörper nach einer Infektion mit dem HI-Virus vergehen im Durchschnitt 22 Tage. Das p24-Antigen ist bereits nach 16 bis 18 Tagen im Serum nachweisbar. Der Test weist eine hohe Sensitivität auf. Auf Grund der niedrigen Prävalenz von HIV in Deutschland ist die Rate an falsch positiven Testergebnissen im Suchtest jedoch verhältnismäßig hoch (geringe Prätestwahrscheinlichkeit), weshalb nach einem positiven Befund im Suchtest immer ein Bestätigungstest erfolgen sollte.
Für die Untersuchung werden 3 ml Serum benötigt.
Bestätigungstest
Üblicherweise wird bei einem positiven Testergebnis im ELISA-Suchtest ein zweimal durchzuführender Nachweis viraler Proteine durch einen Western Blot (Bestätigungstest) angeschlossen, um falsch positive Resultate zu vermeiden. Damit lässt sich die Wahrscheinlichkeit einer falsch diagnostizierten HIV-Infektion auf einen von 20.000 Fällen reduzieren. Der Bestätigungstest gilt als positiv, wenn Antikörper gegen mindestens ein Glykoprotein (env-Gen) und ein weiteres Protein aus einem anderen Genombereich (gag- oder pol-Gen) nachweisbar sind. Der Test weist eine hohe Spezifität auf.
Ein bestätigtes positives Ergebnis bedeutet, dass der Patient mit HI-Viren Kontakt hatte und Antikörper gebildet hat. Es erlaubt jedoch keine Aussage über das Stadium des Infektes. Bei unklaren Testergebnissen sollte eine Verlaufskontrolle nach 1 bis 3 Wochen erfolgen, bei dringendem Verdacht auf eine Infektion mit dem Hi-Virus ist eine RT-PCR durchzuführen.
RT-PCR
Ein anderes, aus Kostengründen nicht routinemäßig durchgeführtes Verfahren zur HIV-Testung basiert auf dem Nachweis von viraler RNA mittels RT-PCR und anschließenden Quantifizierungsverfahren. Die RT-PCR verfügt über eine hohe Spezifität und Sensitivität und ist in der Lage, auch geringe Mengen an Viruskonzentration (40 Kopien/ml) im Blut zu detektieren. Im Vergleich zu den serologischen Testverfahren ist der Nachweis von viraler RNA im Blut bereits nach durchschnittlich 11 Tagen möglich, was die RT-PCR zu einem verlässlichen Diagnostikum im Frühstadium der Infektion macht.
Die Hauptindikation für die Durchführung einer RT-PCR liegt insbesondere bei der Bestimmung der Viruslast zur Beurteilung der Krankheitsprogression und dem Monitoring der antiretroviralen Therapie. Weitere Indikationen sind:
- Testung eines Neugeborenen einer mit HIV infizierten Mutter (falsch positive serologische Testverfahren auf Grund der mütterlichen Antikörper)
- Abklärung unklarer Befunde
- Ausschluss falsch positiver serologischer Befunde
Für die Untersuchung werden 5 ml EDTA-Blut benötigt.
HIV-Schnelltests
Neben den labormedizinischen Nachweisverfahren gibt es inzwischen auch HIV-Schnelltests, die Antikörper gegen HIV-1 und HIV-2 nachweisen können. Es gibt auch neuere Tests, die analog zum ELISA-Suchtest zusätzlich zu den Antikörpern das p24-Antigen bestimmen können. Die Tests liefern schnell (nach 15 Minuten) ein Ergebnis, sind jedoch anfällig für Anwendungsfehler und erfordern bei einem positiven Ergebnis einen anschließenden Bestätigungstest (s.o.). HIV-Schnelltests sind seit 2018 in Deutschland als Heimtests frei verkäuflich.
Laborkontrollen bei HIV-Infektion
Bei bekannter HIV-Infektion sollten weitere Laborparameter bestimmt und Koinfektionen ausgeschlossen werden. Die Wahl der Parameter richtet sich insbesondere nach dem Ausmaß des Immundefektes (CD4+-T-Helfer-Zellzahl) und der klinischen Symptomatik des Patienten.
Bei der Erstuntersuchung nach positivem Testergebnis sollten folgende Parameter bestimmt werden:
- Großes Blutbild
- Differentialblutbild mit Lymphozytensubgruppenbestimmung
- Leberwerte
- Nierenwerte
- Elektrolyte
- Gesamteiweiß und Eiweißelektrophorese
- Immunglobuline
- Entzündungsparameter (insb. CRP)
- Beta-2-Mikroglobulin
- Hepatitis-Serologie
- Toxoplasmose-Serologie
- CMV-Serologie
- Lues-Diagnostik
- Kryptokokken-Antigen im Serum
- ggf. weitere Abklärung opportunistischer Infektionen
Bei niedriger Zellzahl der CD4+-T-Helfer-Zellen (< 100/µl) sollten monatliche Kontrolluntersuchungen und der regelmäßige Ausschluss opportunistischer Infektionen erfolgen.
Neurologisches Screening
Um neurologische Veränderungen einer HIV-Infektion aufzudecken, wird u.a. das Short Neuro-AIDS Screening (SNAS) eingesetzt.
Therapie
Indikationen
Prinzipiell besteht bei jeder HIV-infizierten Person die Indikation für eine zeitnahe (sofort bis wenige Tage/Wochen nach Diagnose) und dauerhafte medikamentöse antiretrovirale Therapie (ART, früher: HAART), unabhängig vom Immunstatus und von der Viruslast. Der Grund dafür ist das Fortschreiten des Immundefektes bei unbehandelter Infektion mit den damit assoziierten Risiken.
Besonders relevant ist eine schnelle Therapieeinleitung bei erhöhtem Risiko, wie z.B.:
- bei symptomatischer HIV-Infektion und klinischer CDC-Kategorie A bis C
- bei asymptomatischer oder symptomatischer HIV-Infektion und laborchemischer CDC-Kategorie 2 und 3
- bei asymptomatischen und immunkompetenten Patienten mit
- HIV-assoziierter Nephropathie (HIVAN)
- HIV-assoziiertem neurologisch-kognitivem Defizit (HAND)
- Koinfektion mit Hepatitis B oder Hepatitis C
- Alter > 50 Jahre
- Immunsuppression, Zytostatika, Bestrahlung
- Schwangerschaft (vertikale Transmission)
- gegebenes Risiko für horizontale Transmission
Selten beobachtet man asymptomatische und niedrig-virämische Verläufe, die nicht mit einem Immundefekt einhergehen (sogenannte "Elite Controller"). Für solche Sonderfälle besteht aktuell (2024) keine Evidenz für die vorteilhafte Anwendung einer antiretroviralen Therapie, sodass die Therapieeinleitung verzögert werden kann. Gleiches gilt für asymptomatisch Infizierte ohne Kompromittierung des Immunstatus. Unter bestimmten Umständen ist eine Verzögerung der Therapieeinleitung um einige Wochen sogar empfohlen, um ein Immunrekonstitutionssyndrom (IRIS) zu verhindern. Dazu gehören Patienten mit behandlungsbedürftigen opportunistischen Infektionen, wie die zerebrale Kryptokokkose und ggf. die Tuberkulose.
Ziele
Mit der HIV-Therapie werden folgende Ziele verfolgt:
- vollständige HIV-Suppression
- Verhinderung der Krankheitsprogression und Unterdrückung von Symptomen
- Rekonstitution des Immunsystems
- Reduktion von inflammatorischen Reaktionen und Organschädigungen aufgrund von Immunaktivierung
- Normalisierung der Lebenserwartung und Lebensqualität bei minimaler therapieassoziierter Toxizität
- Verhinderung der Übertragung des HI-Virus auf andere Personen
Voraussetzungen
Folgende Voraussetzungen sollten bei Beginn einer HIV-Therapie gegeben sein:
- Nachweis einer HIV-Infektion
- ausführliche Diagnostik als Grundlage einer geeigneten individuellen Therapie
- Aufklärung und Motivation für die Therapie (insbesondere bzgl. Nutzen/Ziel, Risiko, lebenslanger Dauer und Relevanz der regelmäßigen Einnahme)
- Sicherstellung von psychosozialer Unterstützung und Versicherungsstatus
Wirkstoffe
Mittlerweile gibt es eine Reihe von antiretroviralen Medikamenten, die an verschiedenen Stellen im Vermehrungszyklus von HIV ansetzen.
siehe auch: Virostatikum
Hemmung der reversen Transkriptase
Durch eine Hemmung der reversen Transkriptase kann das Virusgenom nicht mehr in DNA umgeschrieben werden und damit wird die Möglichkeit der Bildung neuer Viren unterbunden.
Heute stehen zur Hemmung der reversen Transkriptase eine Reihe von Medikamenten zur Verfügung, vor allem Analoga von Nukleosiden, die als Substrat verwendet werden können und zur Hemmung des Enzyms beziehungsweise zum Abbruch der DNA-Kette führen. Wichtige Vertreter von Reverse-Transkriptase-Inhibitoren (RTI) sind u.a.:
- Nukleosid-Analoga (Nukleosidische Reverse-Transkriptase-Inhibitoren, NRTI)
- Zidovudin (AZT)
- Emtricitabin (FTC)
- Stavudin
- Lamivudin
- Didanosin
- Zalcitabin
- Abacavir
- Nukleotid-Analoga (Nukleotidanaloge Reverse-Transkriptase-Inhibitoren, NtRTI)
- Nicht-nukleosidische Reverse-Transkriptase-Inhibitoren, NNRTI
Hemmung der Integrase
Durch die Hemmung der Integrase kann die zuvor gebildete virale DNA nicht mehr in das Genom der Wirtszelle eingebaut werden. Folglich wird die Translation von viralen Genprodukten unterbunden. Zu den Integrase-Inhibitoren (INI) gehören u.a.:
Hemmung der Protease
Die Protease spaltet die nach den viralen Genen translatierten Aminosäurenketten in funktionelle Proteine. Durch eine Hemmung des Enzyms unterbleibt dieser Schritt mit der Folge eines Mangels an Genprodukten für das Assembling neuer Viren.
Gängige Protease-Inhibitoren (PI), die zur Therapie einer HIV-Infektion eingesetzt werden, sind im Folgenden beispielhaft aufgelistet:
- Saquinavir
- Darunavir
- Indinavir
- Atazanavir
- Nelfinavir
- Lopinavir
- Fosamprenavir
- Amprenavir
- Tipranavir
- Saquinavir
Die genannten Wirkstoffe werden in der Regel in Kombination mit sogenannten Boostern (niedrigdosiertes Ritonavir, Cobicistat) verabreicht. Diese drosseln den Abbau der Protease-Inhibitoren und verstärken somit ihre Wirkung. Weiterhin haben Protease-Hemmer üblicherweise starke Wechselwirkungen, da sie mit Cytochrom-P-450-Enzymen der Leber interagieren und damit den Abbau anderer Substanzen über den P-450-Weg beeinflussen.
Hemmung des Kapsids
Kapsid-Inhibitoren hemmen das für die Virusreplikation essenzielle Kapsid. Sie binden direkt an die Monomere des Kapsids und stören damit dessen Funktion.[3]
Anwendungshinweise
Die Therapie einer HIV-Erkrankung wird individuell ausgerichtet. Allerdings folgt die Gabe von Medikamenten einigen Grundsätzen: Man kombiniert mehrere Subtanzen, um eine Bildung resistenter Viren zu verzögern. Geeignete Kombinationen von Wirkstoffen sind der aktuellen Leitlinie zu entnehmen. Für die Erstlinientherapie gelten orientierend folgende Kombinationsmöglichkeiten der Wirkstoffe:
- klassisch: zwei NRTI plus Integrase-Hemmer oder NNRTI oder PI
- neu: NRTI plus Integrase-Hemmer oder NNRTI plus Integrase-Hemmer
Die bis vor kurzem geltende dogmatische Devise "Hit early, hit hard" hat sich in letzter Zeit etwas relativiert, da bei einigen Patienten bereits im Frühstadium Resistenzen auftraten und die Medikamente oft massive unerwünschte Wirkungen zeigen.
Die üblicherweise in Kombination applizierten Medikamente führten zur verpflichtenden Einnahme von großen Mengen Tabletten, so dass bereits aufgrund der Menge die Compliance von HIV-Patienten mit der Zeit sank. Die Adhärenz ist jedoch unbedingt notwendig, um eine Resistenzentwicklung zu vermeiden. Daher werden seit einiger Zeit Kombinationspräparate mit einer Tablette täglich (Single-Tablet-Regime oder STR) angeboten, welche die Anzahl von Tabletten bei gleicher Wirkstoffgabe stark reduzieren. Ein neues Modell sind zudem Depotpräparate mit einer Dosis pro Monat. Faktoren wie eine hormonelle Verhütung mit oralen Kontrazeptiva oder eine Schwangerschaft können die Wirksamkeit und Toxizität der eingesetzten Medikamente beeinflussen. Diese Punkte sind bei der Behandlung von Frauen gesondert zu beachten. Zur Therapie bei Schwangerschaft und exponierten Neugeborenen existiert hierzu eine gesonderte Leitlinie.
Eine Unterbrechung der antiretroviralen Behandlung ist dringend zu vermeiden. Zudem sollten anderweitige Therapien und Medikationen immer auf Interaktionen mit der ART untersucht werden.
Verlaufskontrolle
Alle drei bis sechs Monate sollte eine Verlaufskontrolle mittels Blutabnahme erfolgen.
Es gelten folgende Richtwerte:
| Viruslast (Kopien HIV-RNA/ml) | Interpretation | Weiteres Vorgehen |
|---|---|---|
| < 50 | Therapieerfolg | |
| 50 bis 200 | Therapieversagen möglich |
|
| > 200 | Therapieversagen wahrscheinlich | Resistenztestung durchführen |
Mögliche Gründe für eine ansteigende Viruslast sind beispielsweise eine mangelnde Patientenadhärenz, fehlerhafte Medikamenteneinnahme, Wechselwirkungen oder eine beschleunigte Metabolisierung. Anlassbezogen kann daher zur differentialdiagnostischen Abklärung ein Drug Monitoring sinnvoll sein. Zur Bestimmung der Wirksamkeit eines Medikaments werden dabei die Talspiegel gemessen, zur Bestimmung der Toxizität die Spitzenspiegel.
Therapieversagen
Bei einem gesichertem Therapieversagen wird die Therapie auf zwei bis drei aktive Wirkstoffe umgestellt, davon mindestens einer mit hoher genetischer Barriere. Ein Therapiewechsel wird in der Regel auf Basis einer Resistenztestung durchgeführt.
Stammzelltransplantation
Die Heilung einer HIV-Infektion galt lange als unmöglich. Im Jahr 2008 gab es jedoch den ersten Fall eines Patienten (der sogenannte Berliner Patient), der nach einer allogenen Stammzelltransplantation bei akuter myeloischer Leukämie kein relevantes Virusmaterial mehr aufwies. Wenige weitere Menschen, die an HIV und einer hämatologischen Neoplasie litten und dieselbe Therapie erhielten, gelten seitdem als geheilt. Ein Erklärungsmodell für die Heilung basiert auf einer delta32-Deletion der Spenderzellen, die zu einer Inaktivierung des CCR5-Rezeptors führt. Dieser Rezeptor vermittelt die Aufnahme des HI-Virus in die T-Helfer-Zellen. Aufgrund des veränderten Rezeptorproteins scheinen die Zellen somit vor einer HIV-Infektion geschützt zu sein. Etwa 1 % der europäischstämmigen Bevölkerung trägt diese Veränderung des CCR5-Rezeptors.
Bei einem zweiten Berliner Patienten war eine Heilung trotz funktionierender Andockstelle des CCR5-Rezeptors für das Virus möglich. Die Stammzellspenderin hatte auf ihren Zellen sowohl den funktionierenden CCR5-Rezeptor als auch die mutierte Variante, war jedoch selbst nicht immun gegen das HI-Virus. Der genaue Mechanismus ist bislang nicht vollständig verstanden, jedoch wird vermutet, dass die Immunzellen der Spenderin alle HIV-infizierten Zellen des Empfängers beseitigt haben.[4]
Die genauen Mechanismen hinter der Heilung einer HIV-Infektion durch Stammzelltranslantationen und ob eine breite Anwendung in Zukunft möglich sein wird, ist aktuell (2024) noch Gegenstand der Forschung.[5][6][7][8]
Prophylaxe
Die Prophylaxe einer HIV-Infektion nimmt einen wichtigen Stellenwert ein, da keine vollständige Viruselimination möglich ist. Latexhandschuhe sind bei der Arbeit mit Blut oder Blutprodukten Standard. Blutkonserven werden routinemäßig auf einen Virusbefall getestet. Geschützter Geschlechtsverkehr mit Gebrauch von Kondomen gilt besonders unter Risikogruppen (Homosexuelle, Prostituierte, andere promiskuitiv aktive Menschen) als der beste Weg der Prophylaxe einer geschlechtlich übertragenen Infektion.
Präexpositionsprophylaxe (PrEP)
Neben der Prophylaxe mit Kondomen ist in Hochrisikogruppen auch eine medikamentöse Präexpositionsprophylaxe (PrEP) mit der Kombination Tenofovir/Emtricitabin (Truvada®) möglich. Sie ist ein Europa seit August 2016 zugelassen. Die Erfolgsraten der medikamentösen Prophylaxe liegen in klinischen Studien zwischen 62 und 86 %.
Postexpositionsprophylaxe (PEP)
Die Gabe von antiretroviralen Medikamenten nach einer möglichen Infektion bezeichnet man als Postexpositionsprophylaxe (PEP). Die Therapie sollte möglichst schnell nach dem Ereignis (nach Möglichkeit innerhalb von 24 Stunden, besser innerhalb von 2 Stunden) erfolgen und für mindestens 28 Tage durchgeführt werden. Bei mehr als 72 Stunden zwischen Exposition und möglichem Beginn der PEP wird die Prophylaxe nach nicht mehr zu empfehlen. Ausnahme bildet dabei eine PEP nach Transfusion von HIV-kontaminiertem Blut bzw Blutprodukten, diese sollte auch nach dem Ablauf von 72 Stunden erworgen werden.
Die Standardprophylaxe (medikamentöse PEP) besteht aus einer Kombinationstherapie:
- Tenofovir/Emtricitabin (Truvada®) 1 x 200/245 mg plus
- Raltegravir 2 x 400 mg oder 1 x 1.200 mg
- Dolutegravir 1 x 50 mg
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Berufliche Exposition
Indikationen zur HIV-PEP bei beruflicher Exposition (Indexperson HIV-positiv) sind:
| Expositionsereignis | Viruslast > 50 Kopien/ml* | Viruslast < 50 Kopien/ml |
|---|---|---|
|
Empfehlen | Empfehlen |
|
Empfehlen | Anbieten |
|
Anbieten | Nicht indiziert |
|
Nicht indiziert | Nicht indiziert |
* oder unbekannt
Nicht-berufliche Exposition
Indikationen zur HIV-PEP bei nicht-beruflicher Exposition sind:
| Parenterale Exposition | |
|---|---|
| Expositionsereignis | PEP-Indikation |
| Versehentliche Transfusion von HIV-haltigen Blutkonserven oder Erhalt von mit hoher Wahrscheinlichkeit HIV-haltigen Blutprodukten oder Organen | PEP empfehlen |
| Nutzung eines HIV-kontaminierten Injektionsbestecks durch mehrere Drogengebrauchende gemeinsam | PEP empfehlen |
| Verletzung an altem, weggeworfenem Spritzenbesteck – z.B. bei spielenden Kindern | keine PEP-Indikation |
| Sexuelle Exposition | |
| Expositionsereignis | PEP-Indikation |
| Ungeschützter insertiver oder rezeptiver vaginaler oder analer Geschlechtsverkehr (z.B. infolge eines geplatzten Kondoms) mit einer bekannt HIV-infizierten Person |
PEP empfehlen, wenn:
PEP anbieten, wenn:
keine PEP-Indikation, wenn:
|
| Sexuelle Exposition bei unbekanntem HIV-Status der Indexperson | |
| Expositionsereignis | PEP-Indikation |
| Ungeschützter Analverkehr zwischen Männern | PEP anbieten |
Ungeschützter heterosexueller Vaginal- oder Analverkehr
|
PEP anbieten |
| Ungeschützter heterosexueller Vaginal- oder Analverkehr | keine PEP-Indikation |
| Ungeschützter Oralverkehr mit Aufnahme von Sperma eines sicher oder wahrscheinlich mit HIV-infizierten Partners | keine PEP-Indikation |
| Küssen oder Hautkontakt | keine PEP-Indikation |
Impfindikationen bei HIV
Von der Ständigen Impfkommission (STIKO) empfohlene Impfungen bei Patienten mit einer HIV-Infektion und zugehörige Anwendungshinweise finden sich im Hauptartikel Impfindikationen (HIV).
Perspektiven
Eine Eradikationstherapie im Sinne einer Heilung ist bis heute (2024) nicht in Sicht. Allerdings ist durch die Einführung wirksamer Medikamente das Bewusstsein der Gefahr einer HIV-Infektion in der Bevölkerung zurückgegangen. In den letzten Jahren lässt sich daher wieder eine leichte Zunahme der Neuinfektionen beobachten.
Quiz
Leitlinien
- AWMF, S2k-Leitlinie Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion, Stand 31.12.2021
- AWMF, S2k-Leitlinie HIV-Therapie in der Schwangerschaft und bei HIV-exponierten Neugeborenen, Stand 11.09.2020
- AWMF, S2k-Leitlinie antiretrovirale Therapie der HIV-Infektion bei Kindern und Jugendlichen, Stand 30.06.2019
- AWMF, S2k-Leitlinie HIV-Präexpositionsprohphylaxe (PrEP), Stand 24.05.2018
- AWMF, S2k-Leitlinie Medikamentöse Postexpositionsprophylaxe (PEP) nach HIV-Exposition, Stand 31.12.2021
Literatur
Bildquelle
- Bildquelle für Flexikon-Quiz: © Anna Shvets / Pexels
Quellen
- ↑ Welt-Aids-Tag.de - Daten und Fakten zu HIV, abgerufen am 01.08.2022
- ↑ RKI - Ratgeber HIV AIDS, abgerufen am 15.08.2022
- ↑ Gräfe K.: Lenacapavir. Langwirksame HIV-Therapie 2.0, Pharmazeutische Zeitung 25.8.2022, abgerufen am 28.11.2024
- ↑ charite.de – Einem Charité-Team gelingt abermals eine offenbar vollständige Entfernung des HI-Virus aus dem Körper eines Patienten, abgerufen am 28.11.2024
- ↑ Ärzteblatt, „Berliner Patient“: Von HIV geheilt, an Krebs gestorben, abgerufen 30.01.2023
- ↑ Brown TR, I Am the Berlin Patient: A Personal Reflection, abgerufen am 30.01.2023
- ↑ Ärzteblatt, Forscher erklären vierten HIV-Patienten für geheilt, abgerufen am 30.01.2023
- ↑ DZIF, Kritisches Zeitfenster für Wiederinfektion mit HIV nach Stammzelltransplantation, abgerufen am 30.01.2023