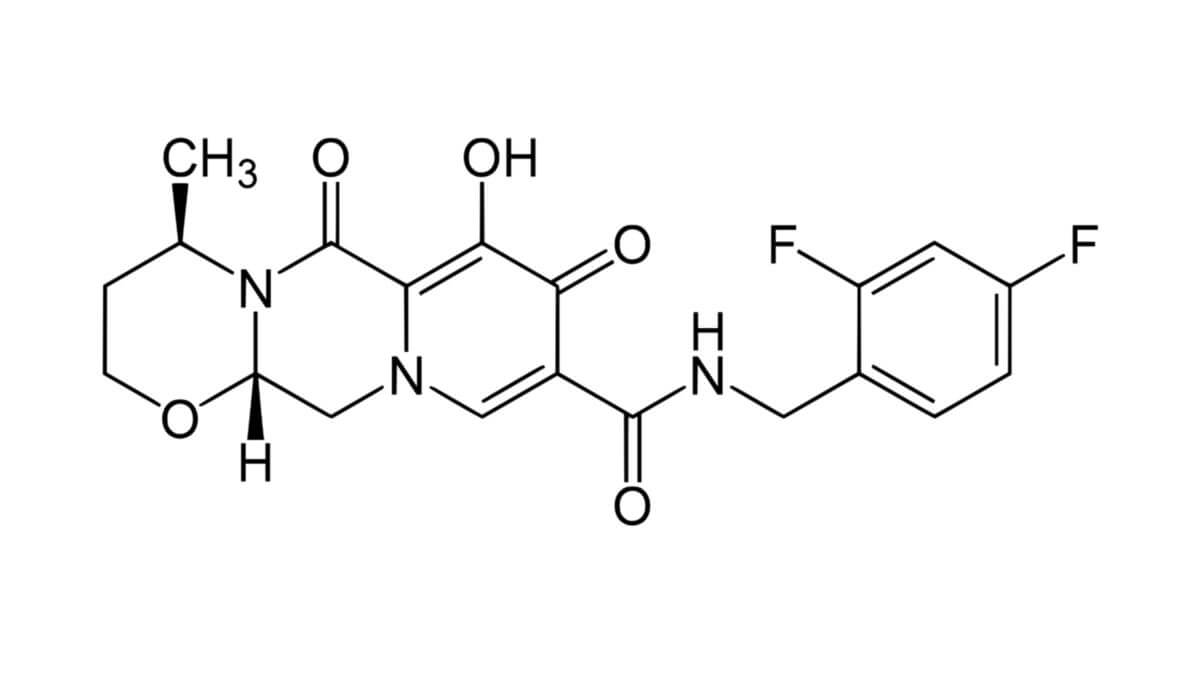
Dolutegravir
Handelsnamen: Trivicay®, Triumeq®, Juluca®
Definition
Dolutegravir ist ein Arzneistoff aus der Klasse der Virostatika. Er zählt zu den Integrase-Inhibitoren und wird in der Therapie von HIV-Infektionen eingesetzt.[1]
Chemie
Wirkmechanismus
Dolutegravir unterbricht den Replikationszyklus des HI-Virus, indem es an das aktive Zentrum der viralen Integrase bindet. Dieses HIV-eigene Enzym ist für den Strangtransfer und die Integration des retroviralen Genoms in die Wirtszelle verantwortlich.
Um Resistenzen zu vermeiden, werden für die Therapie von HIV-Infektionen immer mehrere Wirkstoffe aus verschiedenen Wirkstoffklassen kombiniert. Zur Verbesserung der Adhärenz sollen laut der deutsch-österreichischen Leitlinie bevorzugt Fixkombinationen eingesetzt werden.[2][3]
Pharmakokinetik
Die Eliminationshalbwertszeit von Dolutegravir beträgt etwa 14 Stunden. Der Wirkstoff wird hauptsächlich durch Glucuronidierung über UGT1A1 und in geringem Maße über CYP3A-Enzyme metabolisiert.[2][4][5]
Indikation
- Kombinationstherapie mit anderen antiretroviralen Arzneistoffen bei jugendlichen und erwachsenen Patienten, die mit dem HI-Virus infiziert sind[2]
Dosierung
Die empfohlene Dosis Dolutegravir beträgt 50 mg pro Tag. Der Arzneistoff ist ausschließlich als Fixkombination mit anderen Wirkstoffen erhältlich.[2]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Besondere Hinweise
Es gibt einen Rote-Hand-Brief zu Dolutegravir-haltigen Arzneimitteln. Grund dafür sind Neuralrohrdefekte bei Neugeborenen, deren Mütter zur Zeit der Konzeption eine Therapie mit Dolutegravir erhielten. Bei Frauen im gebärfähigen Alter sollte eine Schwangerschaft vor Beginn einer Therapie ausgeschlossen werden.[6]
Nebenwirkungen
Folgende Nebenwirkungen traten unter der Einnahme von Dolutegravir sehr häufig (≥ 1:10) oder häufig (≥ 1:100) auf:[2]
Wechselwirkungen
Dolutegravir wird hauptsächlich über UGT1A1 eliminiert. Der Wirkstoff ist außerdem Substrat von UGT1A3, UGT1A9, CYP3A4, Pgp und BCRP. Deshalb können Arzneimittel, die Induktoren dieser Enzyme sind, zu einer Abnahme der Plasmakonzentration führen. Durch magnesium- und aluminiumhaltige Antazida kann die Resorption von Dolutegravir deutlich vermindert werden.[2]
Kontraindikationen
- Überempfindlichkeit gegenüber dem Wirkstoff
- gleichzeitige Anwendung von Dofetilid
- Schwangerschaft und Stillzeit[2]
Zulassung
Dolutegravir ist in der EU seit 2014 zugelassen. Der Arzneistoff wird von ViiV Healthcare vermarktet.[2]
Nutzenbewertung
Ein Zusatznutzen einer Therapie mit Dolutegravir wird vom G-BA auf der Basis der vom IQWiG ausgewerteten Studienergebnisse wie folgt eingeordnet:[7]
- beträchtlicher Zusatznutzen gegenüber einer zweckmäßigen Vergleichstherapie Efavirenz in Kombination mit 2 Nukleosid-/Nukleotidanaloga
Kosten
Die Jahrestherapiekosten betragen pro Patient rund 11.000 €.[7]
Quellen
- ↑ Pharmazeutische Zeitung Online Arzneistoffe | Dolutegravir abgerufen am 26.11.18
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 Fachinformation Triumeq®, abgerufen am 26.11.18
- ↑ HIV-Therapie Ärztezeitung, abgerufen am 26.11.2018
- ↑ Fachinformation Juluca®, abgerufen am 26.11.18
- ↑ Fachinformation Tivicay® abgerufen am 26.11.18
- ↑ Gelbe Liste Pharmindex Rote-Hand-Brief zu Dolutegravir-haltigen Arzneimitteln
- ↑ 7,0 7,1 IQWIG-Berichte-Nr.221 Dolutegravir Nutzenbewertung gemäß § 35a SGB V abgerufen am 26.11.2018