ACE-Hemmer
Synonyme: Angiotensinkonversionsenzym-Hemmer, ACE-Inhibitor
Englisch: ace inhibitor
Definition
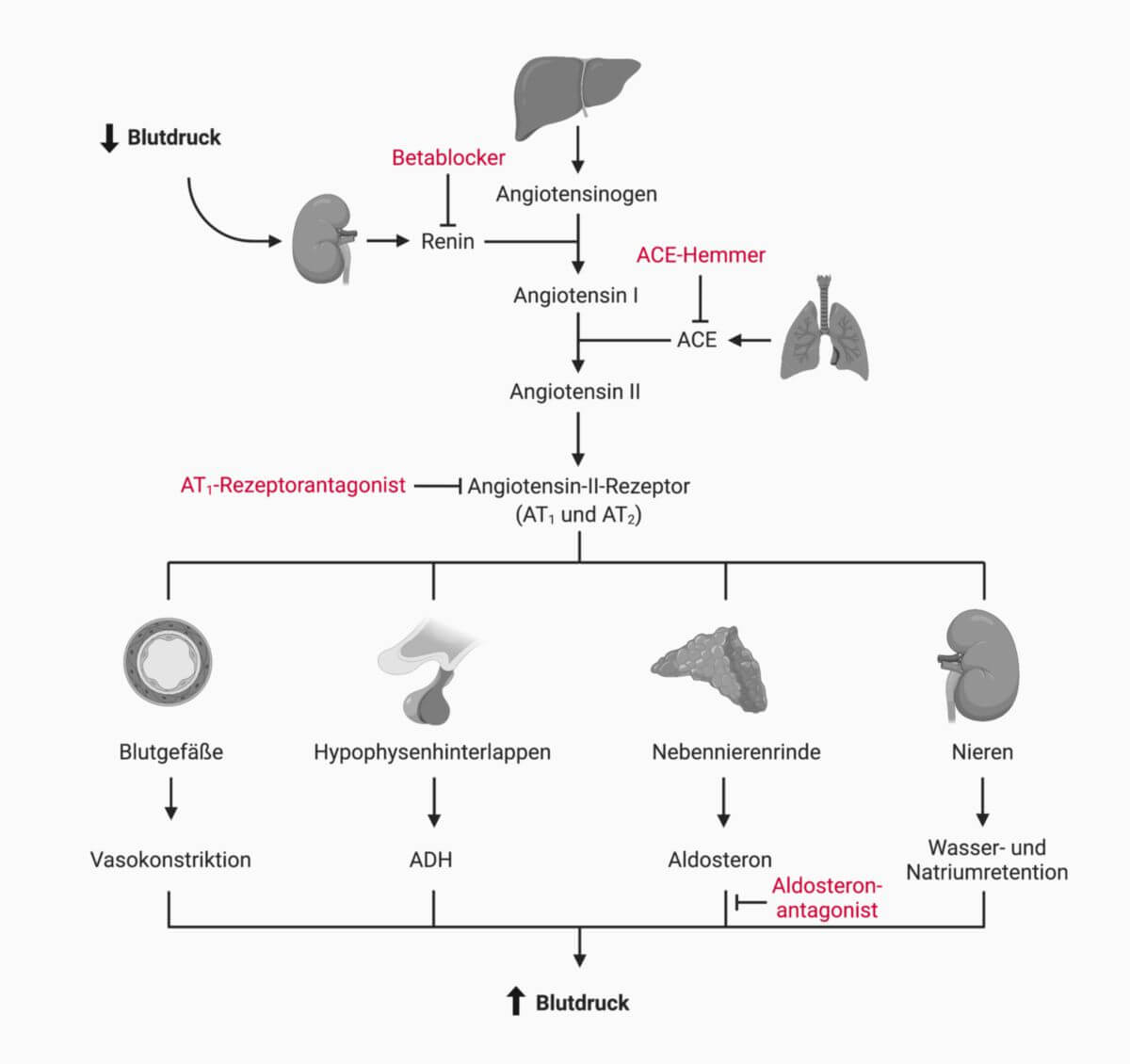
ACE-Hemmer sind eine Gruppe von Antihypertensiva, deren Wirkung auf einer Inhibition des Angiotensin Converting Enzyme (ACE, Kininase II) beruht.
Wirkmechanismus
ACE-Hemmer blockieren die Aktivität des Angiotensin Converting Enzyme kompetitiv. Folglich entsteht weniger Angiotensin II aus Angiotensin I, das Renin-Angiotensin-Aldosteron-System wird in seiner Endstrecke ausgehebelt.
Das ACE ist gleichzeitig auch für den Abbau des Peptidhormons Bradykinin verantwortlich, dessen Präsenz sich aus diesem Grund bei der Anwendung von ACE-Hemmern erhöht. Diese Erkenntnis hilft beim Verständnis von charakteristischen Nebenwirkungen der Substanzgruppe.
Wirkungen
ACE-Hemmer haben Wirkungen auf das kardiovaskuläre System und auf die Nieren.
Kardiovaskuläres System
ACE-Hemmer senken den Blutdruck und verringern somit sowohl die Vorlast als auch die Nachlast des Herzens, ohne dabei die Herzfrequenz zu erhöhen. Daher sind ACE-Hemmer auch sehr gut zur Behandlung der Herzinsuffizienz geeignet.[1]
Auch bei der Behandlung der koronaren Herzerkrankung haben ACE-Hemmer prognostisch günstige Auswirkungen.[2] Durch die Hemmung des Renin-Angiotensin-Aldosteron-Systems bleibt die Aktivierung des AT1-Rezeptors aus und das ventrikuläre Remodeling wird verhindert. Auch die Akkumulation von Bradykinin spielt hierbei eine Rolle, der zugrundeliegende Mechanismus ist jedoch bislang (2022) nicht geklärt.
Niere
ACE-Hemmer haben einen nephroprotektiven Effekt, vermutlich indem sie den systemischen Gefäßwiderstand reduzieren und in der Niere zu einer Vasodilation der efferenten Gefäße führen. Dadurch verlangsamen ACE-Hemmer die Progredienz von Folgeerkrankungen der Niere bei Hypertonie und Diabetes mellitus.[3]
Bei Vorliegen von Nierenarterienstenosen, Hypovolämie, schwerer Herzinsuffizienz und/oder hochdosierter Therapie mit (Schleifen-)Diuretika können ACE-Hemmer die Nierenfunktion einschränken. In diesen Fällen sollte die Nierenfunktion genau beobachtet und die Dosis eventuell angepasst werden.
Durch den Blutdruckabfall wird reflektorisch mehr Renin ausgeschüttet, was aber durch die ACE-Hemmung nicht zu einer Blutdrucksteigerung führt.
Wirkungen bei Langzeittherapie
Bei einer Langzeittherapie mit ACE-Hemmern kehren bei rund 30 bis 40 % der Patienten die Aldosteronlevel wieder zu den Ausgangswerten vor der Therapie zurück oder übersteigen diese zum Teil sogar. Als mögliche Ursache wird unter anderem eine alternative enzymatische Spaltung von Angiotensin I zu Angiotensin II durch die Serinproteasen Chymase oder Kathepsin G diskutiert.
Das Bradykininsystem wird von diesen Enzymen jedoch nicht beeinflusst. Da Bradykinin im Endothel via Freisetzung von NO und PGI2 (Prostacyclin) zu einer Vasodilatation führt, bleiben die antihypertensiven Wirkungen des ACE-Hemmers erhalten, ebenso der bradykininvermittelte antiproliferative Effekt.
siehe auch: Aldosteron-Breakthrough-Phänomen
Pharmakokinetik
Bis auf Lisinopril und Captopril sind alle derzeit verfügbaren ACE-Hemmer Prodrugs, da sie in dieser Form besser resorbiert werden. Erst die in der Leber entstehenden Metabolite sind dann als Hemmstoffe wirksam. Die Wirkungsdauer von ACE-Hemmern ist in der Regel länger als ihre Halbwertszeit im Plasma, da der Komplex aus Enzym und Inhibitor sehr langsam dissoziiert.
ACE-Hemmer werden in der Regel renal eliminiert. Einige Substanzen (Spirapril, Fosinopril) werden zusätzlich auch extrarenal eliminiert.
Indikationen
Für ACE-Hemmer bestehen grundsätzlich folgende Indikationen.
- Essentielle Hypertonie
- Herzinsuffizienz (NYHA I bis IV)
- Prophylaxe des Herzinfarkts und des Schlaganfalls sowie kurzzeitige Nachbehandlung[4]
- Behandlung von Nierenerkrankungen bei Hypertoniepatienten mit Diabetes mellitus Typ II und beginnender Nephropathie
Zu beachten ist, dass derzeit nicht alle ACE-Hemmer für alle Indikationen zugelassen sind. Nähere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Nebenwirkungen
Zu den häufigen Nebenwirkungen der ACE-Hemmer zählen:
- Reizhusten (bis zu 20%): vermutlich aufgrund einer Akkumulation von Bradykinin
- Schwindel, Kopfschmerzen, Müdigkeit
- Blutdruckabfall (dosisabhängig): insbesondere bei Patienten mit schwerer Hypertonie, Aortenstenose, Mitralstenose, hypertropher Kardiomyopathie, Diuretikatherapie oder Leberzirrhose
- Hyperkaliämie: v.a. bei Patienten mit eingeschränkter Nierenfunktion, Dehydratation, metabolischer Azidose, gleichzeitiger Einnahme von kaliumsparenden Diuretika oder Heparin sowie bei älteren Patienten; daher werden ACE-Hemmer häufig mit einem Thiazid- oder Schleifendiuretikum kombiniert
- gastrointestinale Beschwerden (z.B. Verdauungsstörungen, Bauchschmerzen, Dyspepsie, Durchfall, Übelkeit, Erbrechen)
- Geschmacksstörungen (vermehrt bei Captopril)
- makulopapulöses Exanthem
- Muskelkrämpfe, Myalgien
- Hyperglykämien, Hyperurikämie
Nur gelegentlich oder selten auftretende Nebenwirkungen sind:
- allergische Reaktionen bis hin zum anaphylaktischen Schock
- Angioödem: Bradykinin-vermittelt, insbesondere bei gleichzeitiger Anwendung von Sacubitril/Valsartan und mTOR-Inhibitoren
- Niereninsuffizienz bzw. akutes Nierenversagen
- Knochenmarkdepression: Leukopenie bzw. Agranulozytose (v.a. unter Immunsuppression sowie bei Kollagenosen), Thrombopenie, Anämie
- Hepatitis bzw. akutes Leberversagen
- Sehstörungen
- Verwirrtheit
Kontraindikationen
Kontraindiziert sind ACE-Hemmer bei:
- Überempfindlichkeit gegen den Wirkstoff oder andere Bestandteile
- Angioödem in der Anamnese
- signifikanter beidseitiger Nierenarterienstenose oder Nierenarterienstenose bei nur einer funktionsfähigen Niere, Niereninsuffizienz
- Schwangerschaft (2. und 3. Trimenon), Stillzeit
- primärem Hyperaldosteronismus
- schwere Aortenstenose
Warnhinweise
Vorsicht ist geboten bei:
- Nierenfunktionsstörungen (Dosisanpassung notwendig)
- Leberfunktionsstörungen (nur unter strenger medizinischer Überwachung und Dosisreduktion)
- älteren Patienten (Dosisreduktion)
- Patienten mit hohem Hypotonierisiko (s.o.)
Substanzen
Es sind mehr als 10 verschiedene Einzelsubstanzen verfügbar, die sich hauptsächlich in ihren pharmakokinetischen Daten unterscheiden.
| Wirkstoff | Tagesdosis (mg) | Gabe (Tag) | Eliminations- HWZ (h) |
Eliminationsweg | Wirkdauer bei 1x Gabe (h) | |
|---|---|---|---|---|---|---|
| Benazepril | 10-20 (max. 40) | 1 | 18 | > renal (Kreatinin-Clearance < 30 ml/min)* | bis 24 | |
| Captopril | 12,5-25 (max. 50) |
2 | 1-2 | > renal (Kreatinin-Clearance < 30 ml/min)* | bis 12 | |
| Cilazapril | 1,25-2,5 (max. 5) | 1 | 40 | > renal (Kreatinin-Clearance < 60 ml/min)* | bis 18 | |
| Enalapril | 5-10 (max. 40) |
1 | 35 | > renal (Kreatinin-Clearance < 80 ml/min)* | bis 18 | |
| Fosinopril | 5-20 | 1 | 12 | renal / hepatisch | bis 24 | |
| Imidapril | 2,5-10 | 1 | 24 | renal / hepatisch (Kreatinin-Clearance < 80 ml/min)* | bis 24 | |
| Lisinopril | 5-20 | 1 | 30 | > renal (Kreatinin-Clearance < 30 ml/min)* | bis 24 | |
| Moexipril | 7,5-15 (max. 30) |
1-2 | 14 | > renal / hepatisch (Kreatinin-Clearance < 30 ml/min)* | bis 24 | |
| Perindopril | 4-8 | 1 | 30 | > renal (Kreatinin-Clearance < 30 ml/min)* | bis 24 | |
| Quinapril | 10-20 | 1-2 | 26 | > renal (Kreatinin-Clearance < 60 ml/min)* | bis 24 | |
| Ramipril | 2,5-5 (max. 10) |
1 | 15 | > renal (Kreatinin-Clearance < 30 ml/min)* | bis 48 | |
| Spirapril | 3-6 | 1 | 1 | renal / hepatisch (Kreatinin-Clearance < 30 ml/min)* | bis 24 | |
| Trandolapril | 1-2 (max. 4) |
1 | 20 | > renal (Kreatinin-Clearance < 30 ml/min)* | bis 24 | |
| * Dosisanpassung erforderlich | ||||||
Pharmakoökonomie
Mit 6,02 Milliarden DDD zu lasten der GKV waren ACE-Hemmer im Jahr 2021 die Arzneimittelgruppe, die am häufigsten gegen Hypertonie verordnet wurde, sowie eine der meistverordneten Arzneimittelgruppen überhaupt auf dem deutschen Markt. Diese Zahl beinhaltet sowohl Monopräparate als auch Kombinationspräparate. Im Vergleich zum Vorjahr ging das Verordnungsvolumen um -0,5% zurück. Der mit Abstand häufigste ACE-Hemmer in Deutschland war Ramipril mit 4,78 Milliarden DDD.[5]
Geschichte
ACE-Hemmer wurden erstmals in den 1960er-Jahren entwickelt, als man beobachtete, dass Peptide im Speichel der Schlange Bothrops jararaca (Jararaca-Lanzenotter) hemmend auf das Angiotensin Converting Enzyme (ACE) wirken. Als Ausgangssubstanz für die Entwicklung der ACE-Hemmer diente das im Toxinsekret enthaltene Nonapeptid Teprotid. Es hat einen ausgeprägten antihypertensiven Effekt, lässt sich jedoch nur intravenös verabreichen, was seinen Nutzen stark einschränkt.
Der erste oral verfügbare Wirkstoff war Captopril, das Anfang der 1980er Jahre als Arzneimittel zugelassen wurde. Kurz darauf folgte der Wirkstoff Enalapril.
Weblinks
- ACE-Hemmer in Wikipedia, mit ergänzendem Wissen
- ACE-Hemmer und kardiovaskuläre Ereignisse - Abstract in PubMed
- ACE-Hemmer und Stroke - Abstract in PubMed
- ACE-Hemmer und KHK - Abstract in Pubmed
- ACE-Hemmer und Typ1 Diabetes
- ACE-Hemmer und Herzinsuffizienz - Volltext im JAMA
- ACE-Hemmer bei chronischer Niereninsuffizienz - Volltext in Annals of Internal Medicine
Literatur
- Leitlinie: Evidenzbasierte Leitlinie zu Diagnose und Therapie der Herzinsuffizienz (evidence.de, Universität Witten/Herdecke)
- Karow T, Lang-Roth R: Allgemeine und spezielle Pharmakologie und Toxikologie; 27.Auflage, 2019, S.111-118
Quellen
- ↑ Rekha Garg et al.: Overview of Randomized Trials of Angiotensin-Converting Enzyme Inhibitors on Mortality and Morbidity in Patients With Heart Failure JAMA. 1995;273(18):1450-1456. doi:10.1001/jama.1995.03520420066040
- ↑ Heart Outcomes Prevention Evaluation Study Investigators, Yusuf S1, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G.N: Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. Engl J Med. 2000 Jan 20;342(3):145-53.
- ↑ Tazeen H. Jafar et al: Progression of Chronic Kidney Disease: The Role of Blood Pressure Control, Proteinuria, and Angiotensin-Converting Enzyme Inhibition: A Patient-Level Meta-Analysis Ann Intern Med. 2003;139(4):244-252. DOI: 10.7326/0003-4819-139-4-200308190-00006
- ↑ PROGRESS Collaborative Group: Randomised trial of a perindopril-based blood-pressure-lowering regimen among 6,105 individuals with previous stroke or transient ischaemic attack. Lancet. 2001 Sep 29;358(9287):1033-41.
- ↑ Wolf-Dieter Ludwig, Bernd Mühlbauer, Roland Seifert (2023): Arzneiverordnungs-Report 2022, Springer-Verlag GmbH, Berlin