Heparin
von altgriechisch: ήπαρ ("hepar") - Leber
Englisch: heparin
Definition
Als Heparin bezeichnet man eine Gruppe von körpereigenen Glykosaminoglykanen, die hemmend auf die Gerinnungskaskade wirken und daher auch therapeutisch als Antikoagulantien Verwendung finden.
Nomenklatur
Der Name "Heparin" ist darauf zurückzuführen, dass diese Wirkstoffgruppe historisch zuerst aus dem Lebergewebe von Hunden isoliert wurde.
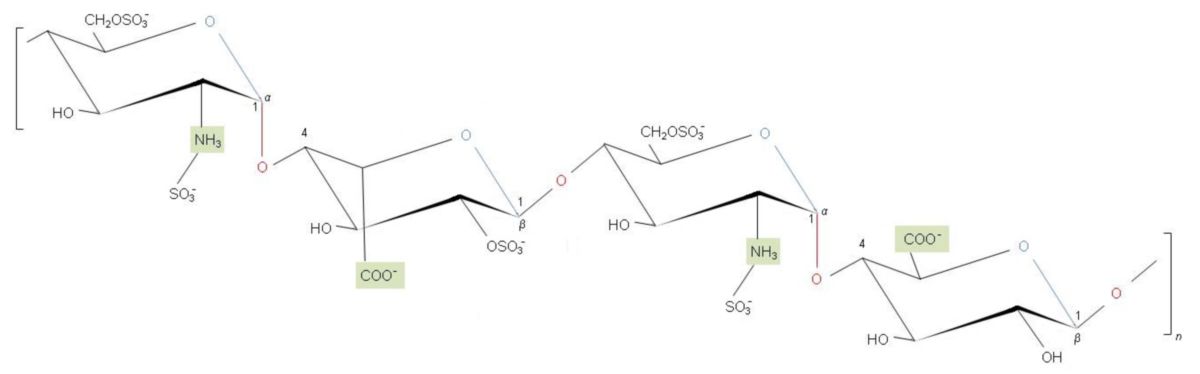
Struktur
Heparinmoleküle bestehen aus üblicherweise unverzweigten Ketten von sulfatierten Saccharidbausteinen, die vor allem Glucosamin, Glucuronsäure und Iduronsäure enthalten. Sie weisen unterschiedliche Molekulargewichte zwischen 4.000 und 50.000 Dalton auf. Das durchschnittliche Gewicht der Heparine liegt bei 16.000 Da.
Aufgrund der vielen im Molekül vorkommenden Carboxyl- und Sulfatreste ist Heparin stark negativ geladen und bildet daher unter physiologischen Bedingungen Komplexe mit basischen Proteinen, beispielsweise dem Antagonisten Protamin.
Vorkommen
Im tierischen Organismus kommt Heparin vor allem zusammen mit Histamin in Vesikeln von Mastzellen vor, aus denen es unter anderem im Rahmen von Entzündungsreaktionen ausgeschüttet wird. Im menschlichen Organismus wird Heparin aus basophilen Granulozyten und aus Mastzellen freigesetzt.
Der Nachweis von Heparin in Mastzellen und basophilen Granulozyten erfolgte erstmal durch die Färbung von Heparin mit Toluidinblau in Glycerin, die eine Metachromasie zur Folge hatte.[1]
Wirkmechanismus
Heparin bindet an den Serinprotease-Inhibitor Antithrombin III und verstärkt dessen Wirkung um etwa das Tausendfache. Der entstehende Komplex gehört zu den Sofortinhibitoren und ist in der Lage, die Gerinnungsfaktoren Thrombin (Faktor IIa), IXa, Xa, XIa und XIIa zu binden und ihre Wirkung damit zu unterdrücken.
Durch die Hemmung von Faktor Xa und Thrombin wird außerdem die Aktivierung des Komplementsystems inhibiert, indem die Bildung von Membranangriffskomplexen verhindert wird. [2]
Daneben inhibiert der Heparin-Antithrombin-Komplex auch die Protease Kallikrein.
Pharmakologie
Heparin findet in zwei Formen in der medizinischen Therapie Verwendung, als hochmolekulare und niedermolekulare Zubereitung. Es wird inzwischen großteils aus der Mukosa von Schweinedarm isoliert und gegebenenfalls modifiziert, die Gewinnung aus Rinderlungen ist seit der BSE-Epidemie obsolet.
Die Heparingabe dient der Prophylaxe und Therapie von Gerinnungsstörungen, vor allem Thrombosen und Embolien.
Hochmolekulares Heparin
Hochmolekulare oder unfraktionierte Heparine (UFH) werden aus tierischen Geweben (v.a. Schweinedarmmukosa) gewonnen und haben eine durchschnittliche Molekülmasse von 16 kDa. Die Therapie mit hochmolekularen Heparinen muss durch die Bestimmung der Gerinnungswerte (z.B. PTT) im Blut engmaschig überwacht werden.
Wegen seiner kurzen Halbwertszeit muss unfraktioniertes Heparin zur Therapie kontinuierlich intravenös über ein Perfusorsystem verabreicht werden (sog. Vollheparinisierung). Die Therapie ist häufig schlecht steuerbar – Phasen verstärkter Gerinnbarkeit können sich mit Phasen übermäßiger Antikoagulation abwechseln.
Die Anwendung in der Prophylaxe erfolgt durch s.c.-Spritzen zwei bis dreimal täglich. Dies wird häufig als low-dose-Heparinisierung bezeichnet. Eingesetzt wird das unfraktionierte Heparin v.a. bei niereninsuffizienten Patienten.
Einer Überdosierung von Heparin kann mit Antagonisten wie Protamin entgegengewirkt werden.
Unfraktioniertes Heparin ist auch für die topische Anwendung in Form von Gelen oder Cremes im Handel. Indikationen sind Schwellungen oder Hämatome nach stumpfen Verletzungen. Aufgrund der Molekülgröße der Heparine sowie ihrer negativen Ladung ist es jedoch fraglich, ob der Wirkstoff über die Haut aufgenommen werden kann.[3][4]
Fraktioniertes Heparin
Im Gegensatz zum hochmolekularen Heparin wird fraktioniertes, niedermolekulares Heparin (NMH oder LMWH) nach der Isolation aus Gewebe auf ein durchschnittliches Molekulargewicht von etwa 5 kDa herunterfraktioniert. Es wirkt als Bruchstück vor allem durch die Blockade des aktivierten Gerinnungsfaktors X (FXa, Stuart-Prower-Faktor).
Im Gegensatz zu den hochmolekularen Heparinen muss eine Therapie mit niedermolekularem Heparin nicht engmaschig überwacht werden. Die PTT ist zur Therapiekontrolle nicht geeignet, da niedermolekulare Heparine die PTT nicht oder nur wenig verlängern. Die Therapiekontrolle kann durch Messung der Anti-Faktor Xa-Aktivität erfolgen. Anders als bei unfraktioniertem Heparin lassen sich NMH mittels Protamin nur zu ca. 50 % antagonisieren. Abgesehen von der leichteren Handhabung (s.c.-Injektion), der höheren Bioverfügbarkeit und der längeren Halbwertszeit, ist das Risiko einer HIT-Entwicklung unter NMH-Therapie deutlich geringer. Zu den NMH zählen:
Nebenwirkungen
Die Gabe von Heparin ist üblicherweise gut verträglich und findet in der Behandlung der meisten klinischen Patienten zur Thromboseprophylaxe Anwendung. Gelegentlich tritt eine Heparin-induzierte Thrombozytopenie (Typ I oder II) auf, die unter Umständen lebensbedrohlich sein kann. Besonders das hochmolekulare Heparin führt in etwa 5 % aller Fälle zum Absinken der Thrombozytenzahl, während dasselbe Phänomen bei einer Behandlung mit fraktioniertem Heparin bei weniger als 1 % der behandelten Patienten auftritt.
Weitere mögliche Nebenwirkungen einer Heparintherapie sind eine gesteigerte Blutungsneigung, Haarausfall und bei längerfristiger Anwendung Osteoporose.
Im Falle eines Auftretens schwerer Nebenwirkungen kommt gegebenenfalls eine Behandlung mit anderen Antikoagulantien in Frage, unter anderem mit Hirudin, Hirudinanaloga oder Cumarin-Derivaten oder DOAKs.
Kontraindikationen
Die wichtigsten Kontraindikationen sind:
- Aktuelle oder aus der Anamnese bekannte HIT Typ II
- Starke Blutung bzw. Risiko für starke Blutungen
- Septische Endokarditis
- Spinalanästhesie, Periduralanästhesie, Lumbalpunktion
- Erkrankungen, bei denen der Verdacht auf Läsionen des Gefäßsystems besteht (z.B. Hirnblutung, Ulzera im Magen-, und/oder Darmbereich)
Podcast

Quellen
- ↑ Tas, J., Geenen, L.H.M. Microspectrophotometric detection of heparin in mast cells and basophilic granulocytes stained metachromatically with Toluidine Blue O. Histochem J 7, 231–248. 1975.
- ↑ Amara U., et al. Molecular Intercommunication between the Complement and Coagulation Systems. J Immunol. 185: 5628-5636. 2010.
- ↑ Lemmer et al. Pharmakotherapie: Klinische Pharmakologie. 13. Auflage, Springer-Verlag, 2007.
- ↑ Gelbe Liste - Heparin, abgerufen am 27.12.2022
Bildquelle
- Bildquelle Podcast: © Midjourney