Magenkarzinom
Synonym: Magenkrebs
Englisch: gastric carcinoma
Definition
Das Magenkarzinom ist die häufigste maligne Neoplasie des Magens. Aufgrund fehlender Frühsymptome ist es zum Zeitpunkt der Diagnosestellung meist fortgeschritten und weist dann eine schlechte Prognose auf.
- ICD10-Code: C16.- bösartige Neubildung des Magens
Einteilung
...nach Lokalisation
Magenkarzinome lassen sich nach ihrer Lokalisation einteilen. In den letzten Jahren (Stand 2026) wurde eine zunehmende Häufigkeit bei proximal im Magen entstehenden Tumoren festgestellt. Ungefähre Anteile sind:
- Antrum, Pylorus - 35 %
- kleine Kurvatur - 30 %
- Kardia - 25 %
- restliche Lokalisationen - 10 %
Histologische Klassifikation nach WHO
Die WHO hat 1997 eine Klassifikation der Magenkarzinome aufgrund ihres histologischen Zelltypus erarbeitet:
- Adenokarzinome (Anteil über 90 %)
- papillär wachsend
- muzinös wachsend
- tubulär wachsend
- Siegelringzellkarzinom: diffuses Wachstum, Siegelringzellen (schleimgefüllte Zellen mit abgeplattetem, randständigem Zellkern)
- Adenosquamöse Karzinome (ca. 5 %)
- Plattenepithelkarzinome (squamöse Karzinome)
- Kleinzellige Karzinome
- Undifferenzierte Karzinome
Der dominante Zelltyp hat keine prognostische Relevanz. Diese hängt eher von der Ausbreitungstendenz und der Wachstumsform ab.
Laurén-Klassifikation
Die Laurén-Klassifikation unterteilt die Magenkarzinome anhand der Histomorphologie und Ausbreitungstendenz. Sie gibt Auskunft über das Wachstumsverhalten des Karzinoms innerhalb der Magenwand. Daraus ergibt sich das Ausmaß der Resektion bzw. der notwendige Sicherheitsabstand. Man unterscheidet:
Intestinaler Typ
Der intestinale Typ macht etwa 50 % der Tumoren aus. Typische Charakteristika sind:
- drüsenähnliche tubuläre Strukturen
- polypöses und ulzerierendes Wachstum
- häufig im Antrum oder im Bereich der kleinen Magenkurvatur
- meist gut differenziert und klar begrenzt
- bei frühzeitiger Entdeckung i.d.R. bessere Prognose
Cave: Drüsenstrukturen in einem Magenkarzinom bedeuten nicht automatisch, dass der Tumor gut differenziert ist. Es gibt auch wenig differenzierte Karzinome vom intestinalen Typ, die eine schlechte Prognose haben.
Diffuser Typ
Der diffuse Typ stellt 40 % der Magenkarzinome. Seine Eigenschaften sind:
- gestörte Zelladhäsion (z.B. durch fehlende Expression von E-Cadherin), sodass einzelne Tumorzellen die Magenwand infiltrieren und verdicken, ohne jedoch eine umschriebene Tumormasse zu bilden
- keine drüsenartigen Strukturen
- meist schlecht differenziert
- frühe Metastasierung, da er in der Lage ist, die Lymphgefäße zu infiltrieren
- häufiger bei jüngeren Patienten
- führt zu einem Verlust der Aufweitbarkeit des Magens (Linitis plastica bzw. "Lederflaschen-Aspekt")
- ungünstigere Prognose
Mischtyp
Der Mischtyp vereint Eigenschaften beider Tumortypen. Er macht nur etwa 10 % der Tumoren aus und wird im Zweifel behandelt wie ein diffuser Typ.
...nach Molekularbiologie
Zunehmend an Bedeutung gewinnt die Einteilung von Magenkarzinome in insgesamt vier molekulargenetische Subtypen:[1]
- Epstein-Barr-Virus-assoziiert (EBV): häufig DNA-Hypermethylierungen, PIK3CA-Mutationen, Amplifikationen von JAK2, PD-L1, PD-L2
- Mikrosatelliten-instabil (MSI): u.a. fehlende Expression von MLH1, Mutationen von onkogenen Signalproteinen
Magenkarzinome ohne Nachweis von EBV oder MSI werden bzgl. des Vorhandenseins extensiver somatischer Aberrationen in folgende zwei Subtypen eingeteilt:
- genomisch-stabil (GS): wenig Mutationen (z.B. von E-Cadherin, RhoA), histologisch v.a. vom diffusen Typ
- chromosomal-instabil (CIN): u.a. Mutationen von p53, Aneuploidie, Aktivierung von Ras, histologisch v.a. vom intestinalen Typ
Mittlerweile (2026) hat diese von der TCGA (The Cancer Genome Atlas) vorgeschlagene Klassifikation erhebliche Auswirkungen auf die Auswahl der Behandlung. MSI-hohe und EBV-assoziierte Tumoren zeigen ein gutes Ansprechen auf Immuncheckpoint-Inhibitoren.
...nach Borrmann
Nach der Borrmann-Klassifikation werden grundsätzlich vier makroskopische Wachstumsformen unterschieden:
- Typ I: polypöses Wachstum (5 %)
- Typ II: schüsselförmiges scharf begrenztes Ulkus (35 %)
- Typ III: unscharf begrenztes, infiltrierendes Ulkus (50 %)
- Typ IV: diffus infiltrierendes (szirrhöses) Wachstum (Linitis plastica) (10 %)
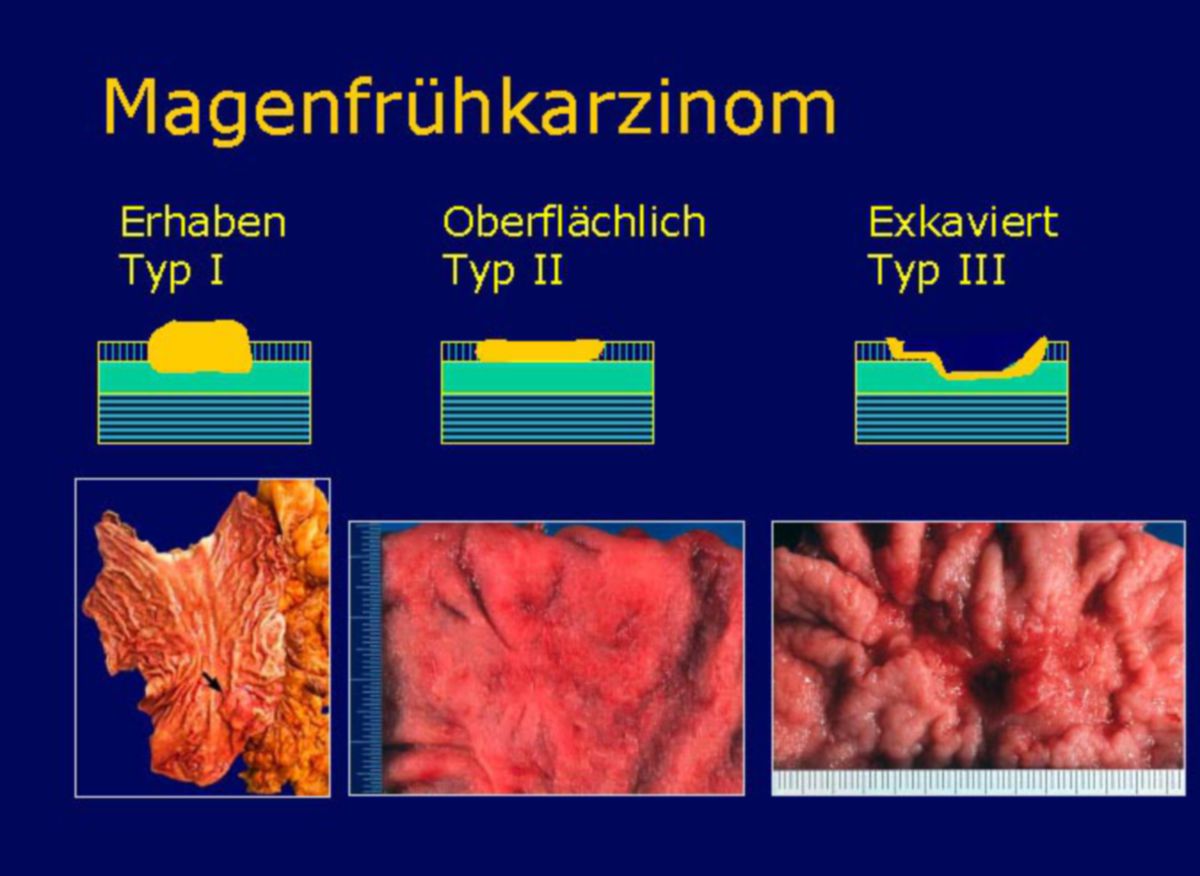
Japanische Klassifikation der Magenfrühkarzinome
Die japanische Klassifikation dient der Beurteilung der endoskopischen Resektabilität von Frühkarzinomen:
- Klasse I: vorgewölbt
- Klasse II: oberflächlich-erhaben (a), -flach (b), -vertieft (c)
- Klasse III: exkaviert
- Mischtyp 1: IIc + III
- Mischtyp 2: III + IIc
Nomenklatur
Adenokarzinome des gastroöosphagealen Übergangs (AEG-Karzinome) werden zu den Ösophaguskarzinomen gezählt, wenn das Zentrum der Raumforderung maximal 2 cm distal der Z-Linie liegt. Diese Einteilung ist ein diagnostisches und therapeutisches Grenzproblem.
AEG-Karzinome werden nach Siewert und Hölscher topografisch in 3 Typen eingeteilt:
- AEG Typ I: Epizentrum 1-5 cm oralwärts der Z-Linie, meist aus Barrett-Metaplasie hervorgehend.
- AEG Typ II („Kardiakarzinom“): Epizentrum 1 cm oralwärts bis 2 cm aboral der Z-Linie.
- AEG Typ III: Epizentrum 2-5 cm unterhalb der Z-Linie, entspricht somit einem Magenkarzinom.
Epidemiologie
Magenkarzinome gehören weltweit zu den häufigsten tumorbedingten Todesursachen. Frauen und Männer sind grundsätzlich gleich häufig betroffen. Eine Ausnahme sind Kardiakarzinome bzw. Adenokarzinome des gastroösophagealen Übergangs, an denen Männer doppelt so häufig erkranken. Das Erkrankungsrisiko steigt mit zunehmendem Alter. Das mittlere Erkrankungsalter liegt bei 70-75 Jahren.
In Deutschland ist das Magenkarzinom bei Männern die fünft-, bei Frauen die sechsthäufigste Tumorerkrankung. Insgesamt ist es die Ursache für ca. 1 % der Todesfälle. Die altersstandardisierte Inzidenz beträgt derzeit (2026) ca. 10–12 pro 100.000 Einwohner und Jahr, wobei Männer häufiger betroffen sind als Frauen. Höhere Inzidenzen finden sich in China, Japan und Südamerika. In Westeuropa und USA zeigt sich seit Jahrzehnten ein stetiger Rückgang der Erkrankungs- und Sterberaten. Dies gilt insbesondere für die Tumoren des Magenausgangs (Antrum und Pylorus) sowie für Magenkarzinome des intestinalen Typs. Umgekehrt zeigt sich ein relativer Anstieg der AEG-Karzinome.
Ätiologie
Das Magenkarzinom ist eine multifaktorielle Erkrankung. Dabei ist die Infektion mit Helicobacter pylori der wichtigste Risikofaktor.
Helicobacter pylori
Das Bakterium induziert eine chronisch-aktive Typ-B-Gastritis. Bei einigen Patienten kann es dabei zur Progression kommen, die über eine atrophische Gastritis und eine intestinale Metaplasie schließlich zu einem Magenkarzinom führen kann (Correa-Hypothese). Fast 90 % der Nicht-Kardia-Karzinome sind mit einer Helicobacter-pylori-Infektion assoziiert. Auch bei AEG-Karzinomen Typ I und II spielt Helicobacter pylori vermutlich eine Rolle.
Genetische Faktoren
Verwandte ersten Grades von Erkrankten haben ein zwei- bis dreifach erhöhtes Risiko im Vergleich zur Allgemeinbevölkerung. Ist mehr als ein Verwandter I° erkrankt, ist das Risiko 10-fach erhöht. Trotzdem wird eine Screeninguntersuchung mittels Gastroskopie auch bei positiver Familienanamnese nicht grundsätzlich empfohlen.
Derzeit (2026) ist unklar, ob die Risikoerhöhung am Lebensstil, an der Helicobacter-pylori-Übertragung innerhalb der Familie oder an genetischen Veränderungen liegt.
Hereditäres Magenkarzinom
Bei 1-3 % der Patienten mit Magenkarzinom liegt eine Keimbahnmutation zu Grunde (hereditäres Magenkarzinom). Man unterscheidet folgende autosomal-dominant vererbte Erkrankungen:
- hereditäres diffuses Magenkarzinom (HDGC)
- familiäres intestinales Magenkarzinom (FIGC)
- gastrales Adenokarzinom mit proximaler Polypose des Magens (GAPPS)
Außerdem existieren hereditäre Tumorleiden, bei denen Magenkarzinome in erhöhter Frequenz auftreten, z.B.:
- familiäre adenomatöse Polyposis (FAP)
- MUTYH-assoziierte Polyposis
- Lynch-Syndrom (HNPCC)
- Cowden-Syndrom
- juvenile Polypose
- Li-Fraumeni-Syndrom
- Peutz-Jeghers-Syndrom
Bei den letzten drei Erkrankungen wird eine Überwachung mittels Ösophagogastroduodenoskopie (ÖGD) empfohlen. HNPCC-Patienten und Risikopersonen für HNPCC sollten jährlich ab dem 35. Lebensjahr neben einer Koloskopie auch eine ÖGD erhalten. Das Lebenszeitrisiko für die Entwicklung eines Magenkarzinoms variiert zwischen 2 und 30 %. Das mittlere Erkrankungsalter variiert zwischen 47 und 56 Jahren. Meist liegt ein intestinaler Typ mit Mikrosatelliteninstabilität vor.
Eine erhöhte Inzidenz von Magenkarzinomen bei hereditärem Brust- und Eierstockkrebs (BRCA1 und BRCA2) ist nicht gesichert.
Ernährungsfaktoren
- Hoher Nitratgehalt der Nahrung in geräucherten und gesalzenen Speisen: Es wird vermutet, dass exogen aufgenommene Bakterien (z.B. durch kontaminierte Nahrungsmittel) Nitrate zu Nitriten umwandeln und karzinogene Nitrosamine gebildet werden. Durch verbesserte Methoden der Nahrungsmittelkonservierung und durch Kühlen bzw. Einfrieren von Lebensmitteln scheint dieser Risikofaktor zunehmend an Bedeutung zu verlieren.
- Tabakrauchen
- Alkoholkonsum
- Adipositas: unklare Datenlage
Weitere Risikofaktoren
- Alter
- niedriger sozioökonomischer Status
- Leben in einer Hochrisikopopulation
- Blutgruppe A
- Magenteilresektionen: kumulatives Karzinomrisiko im Restmagen liegt bei 2,6 % nach 10 Jahren und 4 % nach 20 Jahren
- perniziöse Anämie bzw. Typ-A-Gastritis: doppelt so hohes Risiko für Nicht-Kardiakarzinom, außerdem auch für neuroendokrine Magentumore, Hypopharynx- und Tonsillenkarzinome, Plattenepithelkarzinome des Ösophagus, Dünndarmkarzinome, hepatozelluläre Karzinome und einige hämatologische Neoplasien
- Epstein-Barr-Virus: kann in bis zu 9 % d.F. im Magenkarzinomgewebe nachgewiesen werden; scheinen eigene Entität darzustellen.
- adenomatöse Magenpolypen: Karzinominzidenz bis zu 20 %
- Morbus Ménétrier: Karzinominzidenz bis 10 %
Bei AEG Typ I ist eine Assoziation mit einer gastroösophagealen Refluxkrankheit (GERD) wahrscheinlich. Die Refluxerkrankung allein erklärt jedoch nicht den starken Inzidenzanstieg der Barrett-Metaplasie in den letzten Jahrzehnten.
Symptome
Initialphase
Das Magenkarzinom verläuft sehr lange asymptomatisch. Sobald sich der Tumor ausdehnt, kann es zu diskreten bzw. unspezifischen Symptomen kommen. Häufig beklagen die Patienten schleichend einsetzende epigastrische Beschwerden, deren Intensität von leichtem, postprandialem Völlegefühl bis hin zu starken, persistierenden Schmerzen reichen können. Zusätzlich kann Appetitlosigkeit, eine Abneigung gegen Fleisch sowie eine leichte Übelkeit bestehen.
Fortgeschrittene Erkrankung
Mit fortschreitender Erkrankung treten Gewichtsverlust, Leistungsabnahme, subfebrile Temperaturen und evtl. ein tastbarer Tumor im Oberbauch auf. Während Tumore im Bereich des Pylorus insbesondere zu Übelkeit und Erbrechen führen, finden sich dysphagische Beschwerden v.a. bei Tumoren im Bereich der Kardia.
Bei Metastasierung sind u.a. folgende Symptome möglich:
- Hepatomegalie
- Aszites
- tast-/sichtbare Metastase im Virchow-Lymphknoten (links supraklavikulär), im periumbilikalen Bereich (Sister-Mary-Joseph-Knoten) oder peritoneal im Douglas-Raum (Blumer-Zeichen)
Eine chronische Eisenmangelanämie sowie okkultes Blut im Stuhl sind häufig vorzufinden. Auch eine akute Magenblutung und Teerstuhl sind denkbar. Zu den seltenen Symptomen gehören:
Metastasierung
Ungefähr 70 % der Patienten mit Magenkarzinom haben zum Diagnosezeitpunkt bereits Lymphknotenmetastasen. Im Stadium T1a weisen 3 %, im Stadium T1b bereits 30 % der Patienten nodale Metastasen auf. Betroffen sind dabei:
- Lymphknoten entlang der kleinen und großen Kurvatur (Kompartiment I)
- Lymphknoten entlang Arteria gastrica sinistra, Arteria hepatica communis, Arteria splenica und Truncus coeliacus sowie im Ligamentum hepatoduodenale (Kompartiment II)
- paraaortale und mesenteriale Lymphknoten (Kompartiment III)
- bei Kardiakarzinomen auch mediastinale Lymphknoten
Außerdem können Magenkarzinome per continuitatem benachbarte Strukturen infiltrieren. Dazu zählen u.a. Ösophagus, Duodenum, Kolon, Pankreas, Milz und Peritoneum. Von einer hämatogenen Metastasierung sind v.a. Leber, Lunge, Skelett und Gehirn betroffen.
Eine Sonderform sind Abtropfmetastasen. Diese können die Ovarien als sog. Krukenberg-Tumor befallen oder im Douglas-Raum auftreten.
Diagnostik
Primärdiagnostik
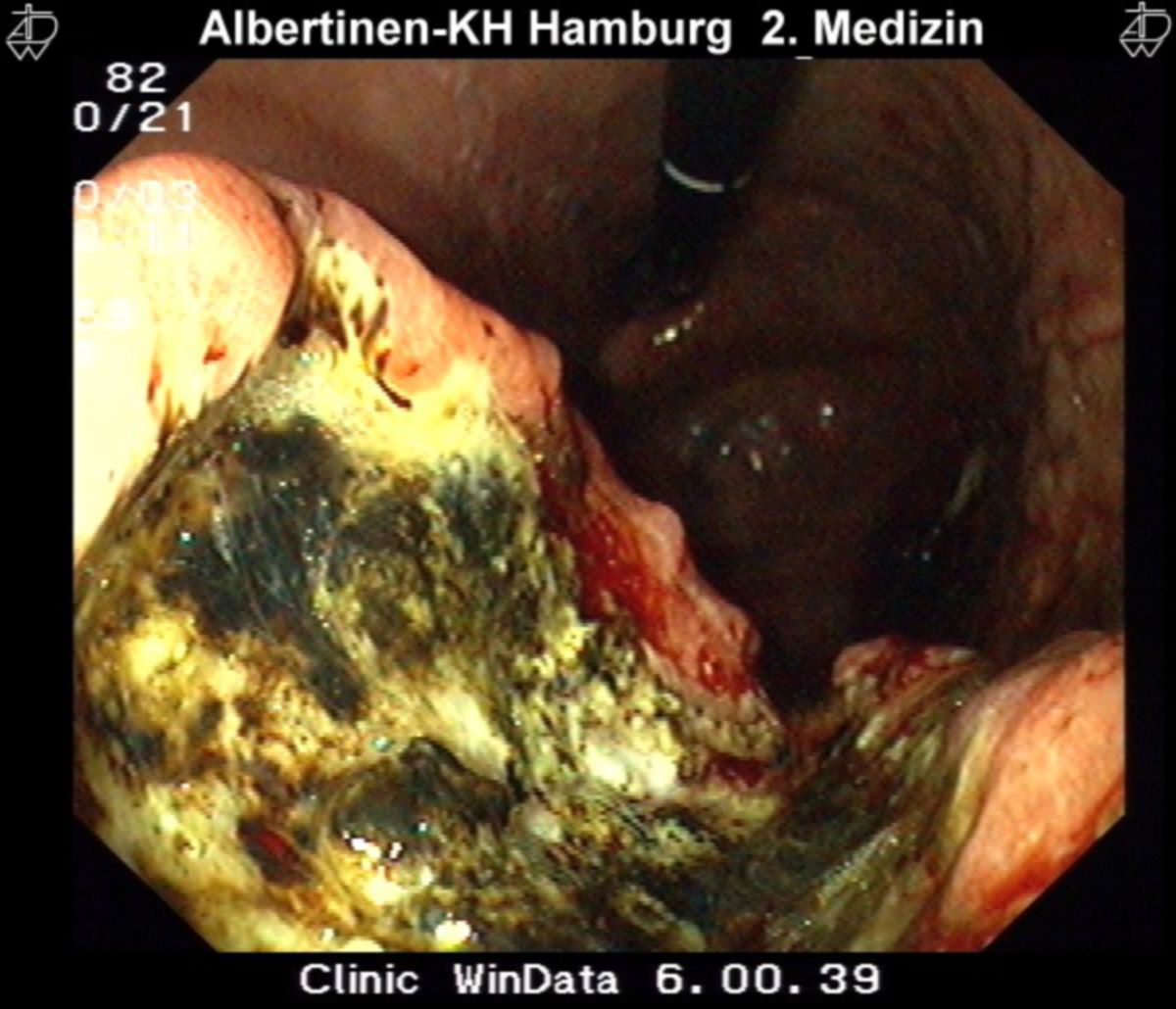
Aufgrund der fehlenden Frühsymptome sollte bei epigastrischen Beschwerden nur ein zeitlich begrenzter Therapieversuch z.B. mit Protonenpumpenhemmer (PPIs) unternommen werden. Anschließend ist eine endoskopisch-bioptische Klärung mittels ÖGD notwendig. Außerdem ist bei folgenden Warnsymptomen frühzeitig eine hochauflösende Videoendoskopie mit Biopsieentnahme notwendig:
- progredienter bzw. rezidivierender Dysphagie
- gastrointestinaler Blutung
- unklarer Eisenmangelanämie
- unklarer Gewichtsabnahme
- rezidivierendem Erbrechen
- rezidivierender Aspirationspneumonie
- Inappetenz
Neben der Standardendoskopie mit Weißlicht (400-700 nm) können u.a. computergestützte Chromoendoskopie und Magnifikationstechniken die Diagnostik verbessern. Insgesamt sollten mindestens 8 Biopsien aus allen suspekten Läsionen entnommen werden.
Bei der anschließenden pathohistologischen Beurteilung bedürfen sog. intraepitheliale Neoplasien (IEN bzw. Dysplasien) einer pathologischen Zweitmeinung, da die Abgrenzung gegenüber reaktiven Veränderungen und Karzinomen schwierig ist.
Bei negativem Befund trotz makroskopisch verdächtiger Läsion oder Verdacht auf Linitis plastica ist eine erneute Biopsieentnahme indiziert. Bei mehrfacher negativer Biopsie können folgende diagnostische Maßnahmen erwogen werden:
- diagnostisches endoskopisch-laparoskopisches oder chirurgisches Vorgehen
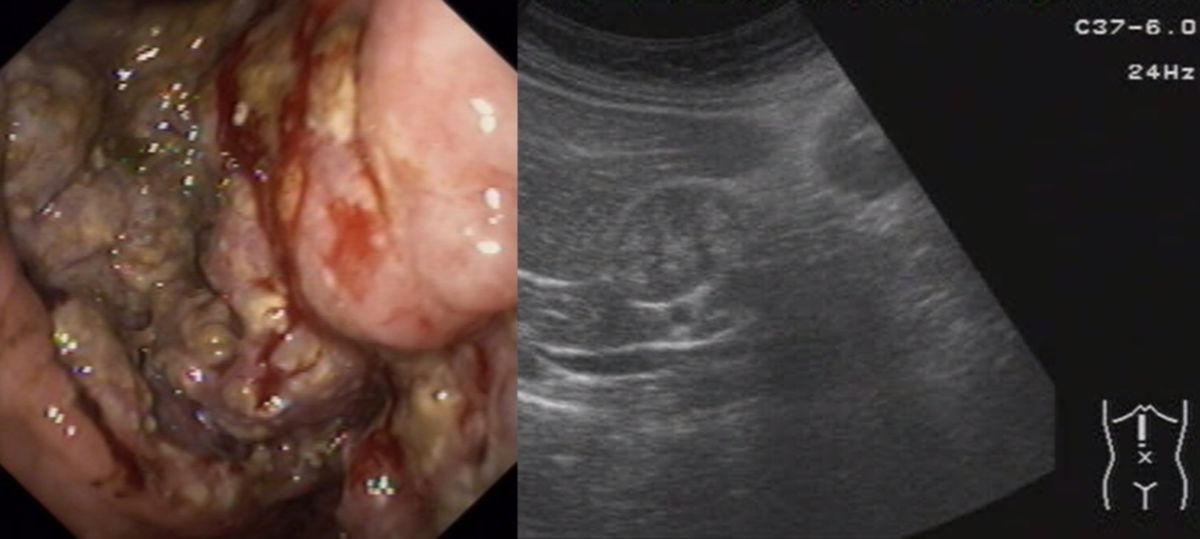
- Endosonografie (EUS) ggf. mit Biopsie der Magenwand oder von pathologischen Lymphknoten
- echoarme Verdickung der tiefen Schichten der Magenwand (v.a. Tunica muscularis) spricht für einen malignen Prozess (v.a. szirrhöses Adenokarzinom)
- Verdickung der mukosalen Schichten spricht eher für eine benigne Ursache
Staging
Beim Staging wird das TNM- und somit das UICC-Stadium festgestellt:
TNM und UICC
| Tis | Carcinoma in situ |
| T1 | Magenfrühkarzinom: Infiltration der Mukosa (T1a) oder Submukosa (T1b) |
| T2 | Infiltration der Tunica muscularis |
| T3 | Infiltration der Subserosa |
| T4 | Perforation von Subserosa (T4a) oder Infiltration benachbarter Strukturen (T4b) |
| N1 | 1-2 regionäre Lymphknoten |
| N2 | 3-6 regionäre Lymphknoten |
| N3 | 7-15 (N3a) oder > 15 regionäre Lymphknoten (N3b) |
| M1 | Fernmetastasen incl. Metastasen im Peritoneum oder Omentum, solange diese nicht per continuitatem entstanden sind |
| UICC-Stadium | TNM-Klassifikation |
|---|---|
| 0 | Tis |
| IA | T1 N0 M0 |
| IB | T1 N1 M0 oder T2 N0 M0 |
| II | T1 N2 M0 oder T2 N1 M0 oder T3 N0 M0 |
| IIIA | T2 N2 M0 oder T3 N1 M0 oder T4 N0 M0 |
| IIIB | T3 N2 M0 |
| IV | T1-T3 N3 M0 oder T4 N1-N3 M0 oder M1 |
Bildgebung
Zum Staging sollten folgende bildgebende Verfahren angewendet werden:
- Abdomen-Sonographie (ggf. kontrastmittelverstärkt als CEUS): Mittel der Wahl zur Detektion von Lebermetastasen und Aszites, ggf. ultraschallgesteuerte Feinnadelaspirationsbiopsie bei Verdacht auf Lymphknoten-Metastasen
- Sonographie des Halses: z.A. von nodalen Metastasen, immer bei AEG-Karzinomen, fakultativ beim Magenkarzinom
- Endosonographie: empfohlen bei Patienten mit kurativer Therapieintention; komplementär zur Computertomographie (CT), um Patienten für perioperative Therapie zu selektieren. Beurteilung der Tiefenausdehnung und des lokalen Lymphknotenbefalls, wobei kein sicherer Ausschluss möglich ist. Nachweis geringer Aszitesmengen
- CT-Thorax, -Abdomen und –Becken: bei Patienten mit kurativem Ansatz. Mit intravenösem Kontrastmittel und Magenfüllung mit oralem Kontrastmittel oder Wasser („Hydro-CT“). Suche nach Lungenmetastasen, Peritonealkarzinose, Fernmetastasen und lokoregionären Metastasen.
- Magnetresonanztomographie (MRT): bei Patienten, bei denen eine CT nicht durchgeführt werden kann. Dabei ist eine Diffusionswichtung, eine Kontrastmittelgabe sowie ggf. ein MRT in Hydro-Techik sinnvoll.
- Knochenszintigraphie: nur bei Verdacht auf ossäre Metastasen
- PET-CT: nur ggf. bei AEG-Tumoren
CT-Fallbeispiel
DICOM-Modelle können auf Mobilgeräten leider nicht angezeigt werden.
Laparoskopie
Bei lokal fortgeschrittenem Magenkarzinom (ab cT3) oder bei cT2 mit unklarem Lymphknoten-Status und/oder fraglicher Peritonealkarzinose ist eine Laparoskopie vor Beginn einer kurativen, neoadjuvanten Therapie sinnvoll.
Sie dient u.a. der Überprüfung der Resektabilität des Magenkarzinoms und dem Nachweis einer Peritonealkarzinose sowie okkulter Lebermetastasen. Mit Hilfe einer Peritoneallavage mit anschließender zytologischer Untersuchung können Hochrisikopatienten identifiziert werden, selbst wenn sie keine makroskopischen Veränderungen aufweisen.
Tumormarker
Tumormarker wie CA 72-4, CA 19-9 oder CEA werden in der aktuellen Leitlinie (Stand 2026) für die Primärdiagnostik bzw. für das Staging nicht empfohlen.
Histopathologie
Der histopathologische Bericht (nach operativer Therapie) umfasst folgende Aspekte:
- makroskopische Begutachtung (z.B. Größe und Lokalisation des Tumors)
- mikroskopischer Tumortyp incl. Grading
- Residualtumorklassifikation (R0-, R1- oder R2-Resektion)
- Angaben zum Lymphknotenbefall: dabei müssen mindestens 16-25 regionäre Lymphknoten untersucht werden.
Bei undifferenzierten Tumoren sind weitergehende immunhistologische Untersuchungen notwendig. Auch bei einer Erkrankung im Stadium IV werden sie durchgeführt. Zur Standarddiagnostik gehört die Bestimmung von:[2]
- HER2-Status
- PD-L1-Status
- Mikrosatelliteninstabilität (MSI)
- Combined Positive Score (CPS)
- Tumor Area Positivity (TAP)
Differentialdiagnosen
- gastroduodenale Ulkuskrankheit
- gastroösophageale Refluxkrankheit
- Morbus Ménétrier
- Reizmagen
- Erkrankungen an Gallenwegen, Leber, Pankreas
- andere Magentumore: MALT-Lymphom, gastrointestinaler Stromatumor (GIST), Leiomyosarkom, Lipom, Neurofibrom, Karzinoid
- fokale foveoläre Hyperplasie (hyperplastischer Polyp)
- hyperplasiogener Polyp (hyperplastisch-adenomatöser Polyp)
- Magenadenom
- Polypen bei Peutz-Jeghers-Syndrom
Therapie
siehe Hauptartikel: Therapie des Magenkarzinoms
Operative Therapie
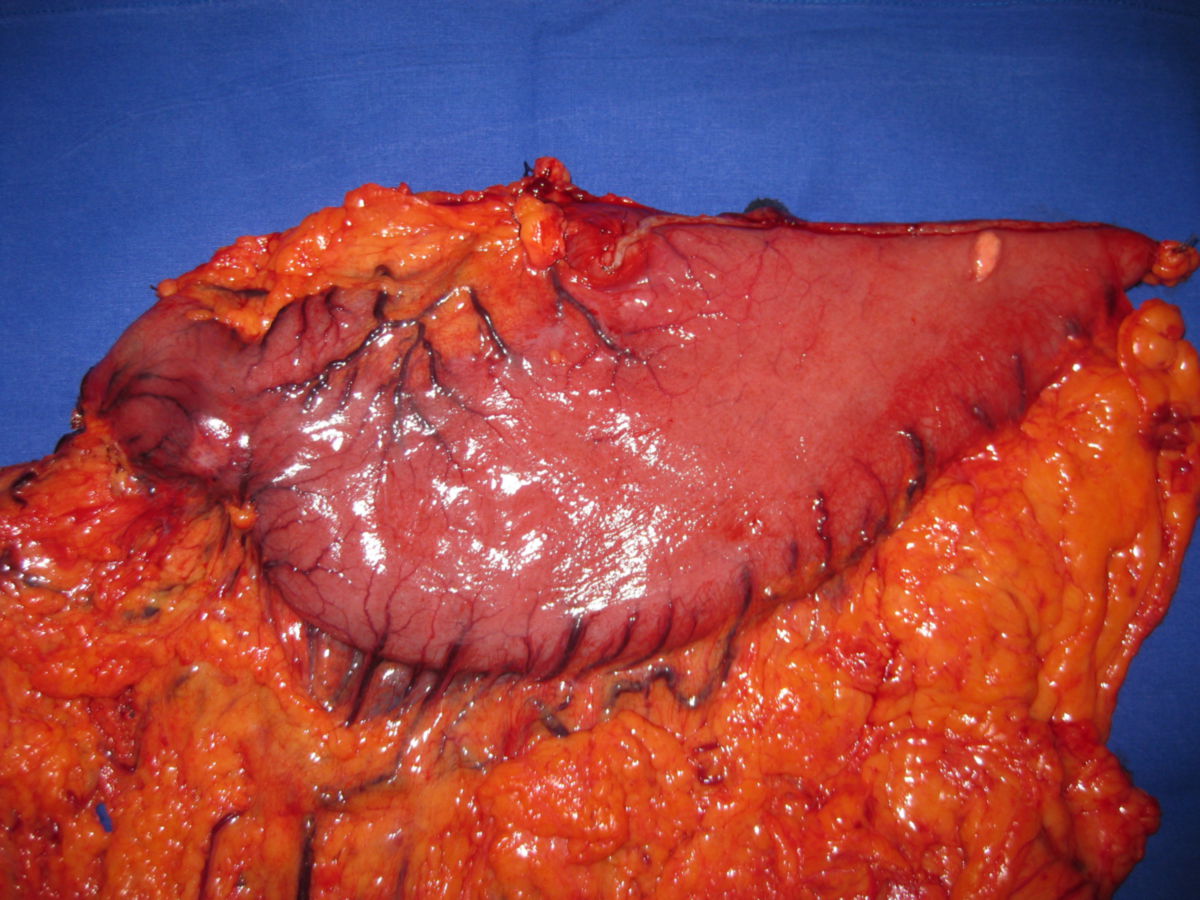
Die einzige kurative Therapie besteht in der endoskopischen oder chirurgischen Resektion des Tumors. Standardverfahren ist die radikale Gastrektomie mit Lymphadenektomie. Dabei ist das Einhalten eines tumorfreien Resektionsrandes (R0-Resektion) entscheidend. Feste Sicherheitsabstände von 5 cm (intestinaler Typ) bzw. 8 cm (diffuser Typ) gelten nicht mehr als obligater Standard und können ggf. durch intraoperative Schnellschnittuntersuchungen abgesichert werden. Anschließend erfolgt die Passagewiederherstellung durch eine Roux-Y-Anastomose oder mittels Pouchbildung.
Die Resektion kommt grundsätzlich in allen T-Stadien in Betracht, vorausgesetzt der Patient ist funktionell operabel. Nicht operiert werden Patienten mit T4b-Tumoren, die nicht-resektable Strukturen betreffen sowie Patienten mit Fernmetastasen.
Unter Einhaltung der erforderlichen Sicherheitsabstände kann bei Karzinomen des unteren Magendrittels sowie bei Karzinomen vom intestinalen Typ des mittleren Drittels eine subtotale Gastrektomie mit Lymphadenektomie ausreichen.
Bei AEG-Tumoren gelten folgende operative Therapieempfehlungen:
- AEG Typ I: transthorakale subtotale Ösophagektomie mit Resektion des proximalen Magens und anschließendem Magenhochzug und intrathorakaler Anastomose
- AEG II: transthorakale Ösophagektomie und obere Magenresektion oder transhiatal erweiterte Gastrektomie mit distaler Ösophagusresektion
- AEG Typ III: transhiatal erweiterte Gastrektomie und distale Ösophagusresektion, z.T. Ösophagogastrektomie und Rekonstruktion durch Koloninterposition.
Perioperative Therapie
Ab Stadium cT3 wird eine perioperative Chemotherapie i.d.R. mit 5-Fluoruracil, Oxaliplatin und Docetaxel (FLOT) empfohlen.
Palliative Therapie
Eine palliative Situation liegt vor bei:
- Fernmetastasen
- fortgeschrittenem Stadium mit nicht resektablem Tumor
- funktionell inoperablen Patienten
Palliativen Patienten sollte frühestmöglich eine Chemotherapie angeboten werden, vorausgesetzt der Patient befindet sich in gutem Allgemeinzustand (ECOG 0-1). Standard der Erstlinientherapie ist eine platin- und fluoropyrimidinbasierte Chemotherapie (z.B. FOLFOX, CAPOX oder FLO). Bei HER2-Überexpression kann zusätzlich Trastuzumab verabreicht werden. Für EGFR-Antikörper (Cetuximab, Panitumumab) und Bevacizumab besteht außerhalb klinischer Studien kein etablierter Stellenwert. Als Zweitlinientherapie kommen Irinotecan, Docetaxel, Paclitaxel oder Ramucirumab in Frage.
Immuncheckpoint-Inhibitoren (v.a. Nivolumab und Pembrolizumab) haben abhängig von PD-L1-Expression und/oder MSI-Status einen Stellenwert in der palliativen Therapie gemäß aktueller Zulassung und Leitlinienempfehlungen. Bei MSI-high/dMMR-Tumoren kann Pembrolizumab nach Versagen einer Erstlinientherapie eingesetzt werden. Bei Claudin-18.2-positiven Tumoren ist Zolbetuximab in Kombination mit einer Chemotherapie eine weitere zielgerichtete Therapieoption.[2]
Neben einer Chemotherapie existieren weitere palliative Therapiemaßnahmen, z.B. Stentimplantation bei symptomatischer Tumorstenose im Magen.
Nachsorge und Rehabilitation
Patienten nach kurativer Therapie des Magenkarzinoms sollten eine ganzheitliche Nachsorge erhalten. Diese umfasst:
- klinische, endoskopische und radiologische Kontrolle: in ersten 2 Jahren zumindest alle 6 Monate, danach jährlich bis zum 5. Jahr
- psychoonkologische Betreuung
- lebenslange, parenterale Vitamin-B12-Substitution nach Gastrektomie (mind. 2 µg/d p.o., 100-500 µg bei monatlicher bzw. 500-1.000 µg pro Injektion bei dreimonatiger Substitution)
- Substitution von Pankreasenzymen bei Fettstühlen
- Anschlussheilbehandlung nach Abschluss der Primärtherapie: leichtes Ausdauer- und spezielles Muskelaufbautraining (reduziert Angst, Depression, Fatigue, Schlafstörungen), Ernährungstherapie, Physiotherapie, psychoedukative Schulungen
Des Weiteren ist auf typische Komplikationen nach der Magenresektion zu achten:
Aufgrund der geringen Sensitivität und Spezifität von CEA und CA 19/9 werden diese Tumormarker in der Nachsorge nicht empfohlen.
Prävention
Protonenpumpeninhibitoren führen zu einem Anstieg der Gastrin-Serumkonzentration. Gastrin hat einen trophischen Effekt auf die Magenschleimhaut, sodass ein erhöhtes Risiko für die Entstehung von neuroendokrinen Tumoren des Magens sowie von Magen- und Kolonkarzinomen denkbar ist. Bisherige (2026) Daten sind jedoch widersprüchlich. Derzeit existieren keine klinischen Hinweise, die ein erhöhtes Magenkarzinomrisiko bei PPI-Therapie belegen.
ASS, NSAR und selektive COX-2-Hemmer sollten nicht zur Prophylaxe eines Magenkarzinoms angewendet werden. Die Einnahme aus anderer Indikation führt jedoch vermutlich als Nebeneffekt zur Reduktion des Magenkarzinomrisikos.
Um ein Magenkarzinom zu verhindern, ist in folgenden Konstellationen eine Helicobacter-pylori-Eradikation sinnvoll:
- Risikogastritis (Pangastritis, korpusdominante Gastritis)
- Verwandte I° von Magenkarzinompatienten
- frühere Magenneoplasien (endoskopische Resektion oder Magenteilresektion bei Magenadenom oder Frühkarzinom; MALT-Lymphom).
- nach Magenoperation (v.a. Ulkuschirurgie) aufgrund des alkalischen Galle- und Pankreassaftrefluxes
- evtl. bei ausgedehnter, multifokaler Atrophie und/oder intestinaler Metaplasie
Screening
Bisher (2026) existieren keine verlässlichen Biomarker, die eine Früherkennung des Magenkarzinoms erlauben.
In Japan und Südkorea werden Individuen anhand des Serum-Pepsinogen-Tests und des serologischen Helicobacter-Pylori-Status in Risikogruppen eingeteilt. Pepsinogen I (PG I) findet sich nur in Hauptzellen des Korpus, Pepsinogen II (PG II) auch in Kardia, Pylorus und in den duodenalen Brunner-Drüsen. Ein reduziertes PG I/II-Verhältnis spricht für eine fortgeschrittene Drüsenkörperatrophie. Die Kosteneffektivität der Untersuchung ist jedoch nur für Regionen mit hoher Inzidenz oder für bestimmte Patientengruppen nachgewiesen. Daher wird ein bevölkerungsweites Screening für Deutschland derzeit (2026) nicht empfohlen.
Ein Screening auf EBV ist aufgrund der hohen Durchseuchungsrate nicht sinnvoll.
Bei fortgeschrittener Atrophie und intestinaler Metaplasie des Magens kann alle 3 Jahre eine ÖGD mit Biopsien nach dem Sydney-Protokoll sinnvoll sein. Ausgeprägte Atrophien und Metaplasien erhöhen das Risiko für ein Magenkarzinom jeweils um das Fünffache.
Patienten mit vorausgegangener Magenresektion (ohne Magenkarzinom) sollten ab dem 15. postoperativen Jahr eine regelmäßige Gastroskopie erhalten. Der Nutzen ist jedoch bisher (2026) nicht belegt.
Besondere Screeningmaßnahmen ergeben sich für Patienten mit Keimbahnmutationen, die eine Prädisposition für ein hereditäres Magenkarzinom haben sowie für Patienten mit hereditären Tumorleiden (s.o.).
Prognose
Die Prognose ist meist ungünstig. Insgesamt beträgt die 5-Jahres-Überlebensrate ca. 30 %. Ursächlich ist das lange asymptomatische Stadium zu Beginn der Erkrankung, sodass die Diagnose oft erst spät gestellt wird.
Die beste Prognose besitzt ein Magenfrühkarzinom mit 5-Jahres-Überlebensrate von 90-95 %. Im Stadium III beträgt sie 30 %, im Stadium IV nur 5 %. Ab T3 beträgt die Prognose bei erfolgreicher R0-Resektion 45 %.
Podcast

Literatur
- S3-Leitlinie Magenkarzinom, Stand Mai 2025, abgerufen am 04.02.2026
Bildquelle
- Bildquelle DICOM-Viewer: Lucchesi, F. R., & Aredes, N. D. (2016). The Cancer Genome Atlas Stomach Adenocarcinoma Collection (TCGA-STAD) (Version 3). The Cancer Imaging Archive
Quellen
- ↑ The Cancer Genome Atlas Research Network Comprehensive molecular characterization of gastric adenocarcinoma, Nature 2014; 513(7517): p. 202-209, abgerufen am 24.02.2020
- ↑ 2,0 2,1 Lordick et al (Onkopedia).: Magenkarzinom, 08/2025, zuletzt abgerufen am 03.02.2026