Helicobacter pylori
Englisch: Helicobacter pylori
Definition
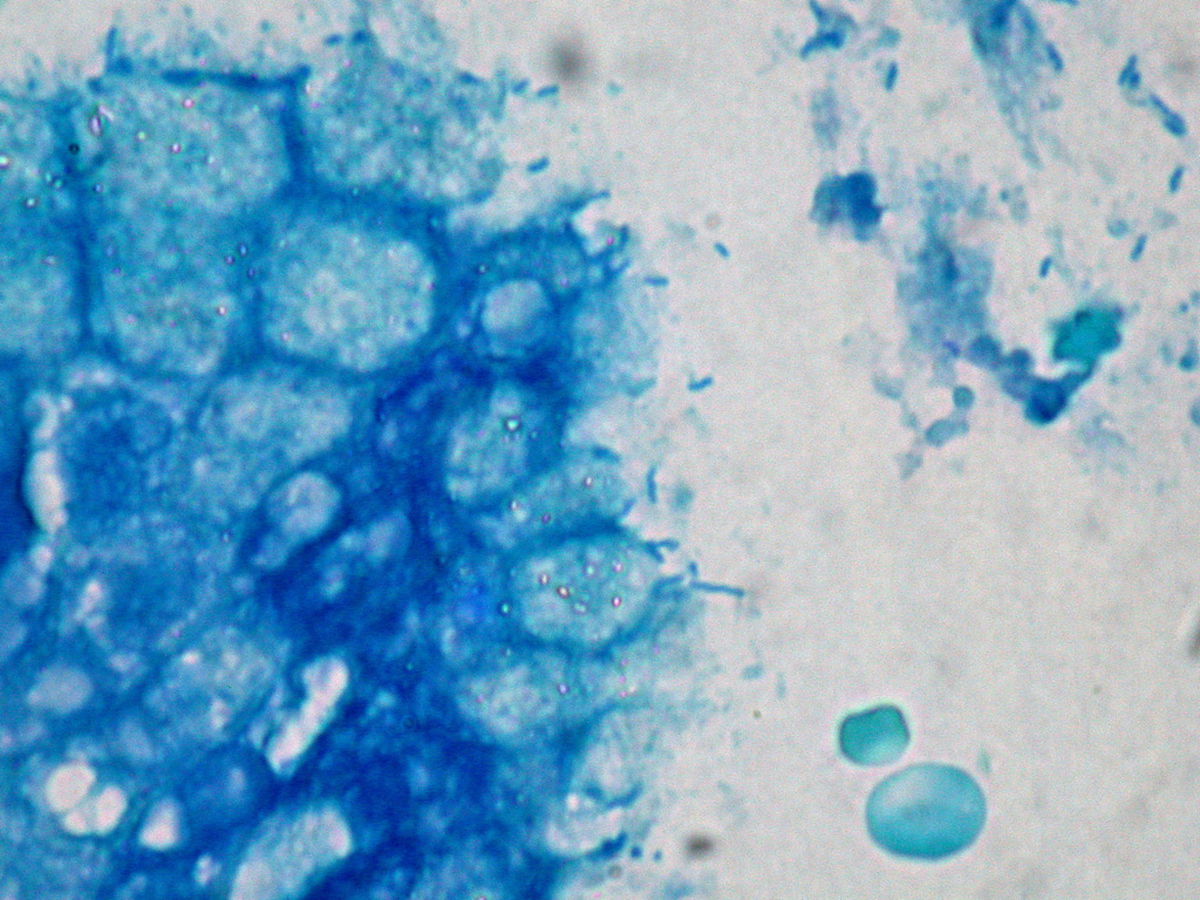
Helicobacter pylori, kurz H. pylori oder HP, ist ein gramnegatives Stäbchenbakterium mit lophotricher Begeißelung aus der Gattung Helicobacter.
Morphologie
Die Zellen sind stäbchenförmig mit spiralförmig gewundener Oberfläche. Sie haben einen Durchmesser von 0,5 µm und eine Länge von rund 3 µm. Der Erreger ist motil. Zur Fortbewegung nutzt er 4-6 Flagellen, die büschelförmig polar angeordnet sind. Sie sind aus den Flagellinen FlaA und FlaB aufgebaut.
Helicobacter pylori verfügt über verschiedene Membranprotein-Familien, vor allem über Adhäsine, daneben über Porine, Eisentransporter und Geißelproteine. Wie bei anderen gramnegativen Erregern besteht die äußere Membran aus Phospholipiden und Lipopolysacchariden (LPS).
Der Mikroorganismus kann durch unterschiedliche Färbungen dargestellt werden, u.a. durch die Gramfärbung, die Giemsa-Färbung und die HE-Färbung sowie durch Acridinorange.
Stoffwechsel
Helicobacter pylori ist mikroaerophil und bevorzugt Umgebungen mit geringem Sauerstoffgehalt. Die Energiegewinnung erfolgt durch Hydrogenasen, die molekularen Wasserstoff (H2) oxidieren. Darüber hinaus verfügt der Erreger über diverse andere Enzyme wie Oxidase, Katalase und Urease.
Genom
Das Genom verschiedener Helicobacter-pylori-Stämme wurde vollständig sequenziert. Es besteht aus etwa 1,7 Millionen Basenpaaren und mehr als 1.500 Genen. Das Pangenom von 30 verschiedenen Stämmen kodiert rund 2.000 Proteinfamilien, von denen etwa die Hälfte in allen 30 Stämmen nachweisbar ist.
Die gegenwärtigen Genomstudien (2021) konzentrieren sich auf die Gene, welche die Pathogenität des Erregers bestimmen. Als wahrscheinliche Pathogenitätsinsel (PAI) wurde eine 40 kb lange Gensequenz mit etwa 30 verschiedenen Genen identifiziert. Eines dieser Gene ist das cagA-Gen, das ein relevantes Virulenzprotein von Helicobacter pylori kodiert. Es besteht aus 1.186 Aminosäuren. Stämme mit cagA-Gen können Ulzera auslösen.
Die cag-Pathogenitätsinsel fehlt bei Patienten, die asymptomatische Wirte von Helicobacter pylori sind. Wahrscheinlich wurde sie durch horizontalen Gentransfer von einer anderen Bakterienspezies erworben.
Pathogenese
Helicobacter pylori kommt fast ausschließlich beim Menschen vor. Nach der Übertragung auf fäkal-oralem Weg erfolgt die Kolonisation und Infektion der Magenschleimhaut.
Auch bei Tieren (z.B. Hunden und Katzen) können Helicobacter-Spezies nachgewiesen werden, u.a. Helicobacter felis, Helicobacter bizzozeronii und Helicobacter bilis. Hier ist allerdings bisher ungeklärt, ob die Besiedlung des Magens zu Erkrankungen führt.[1]
Wichtige Pathogenitätsfaktoren sind:
- starke Beweglichkeit
- Adhärenz an Oberflächenzellen des Magens
- Urease
- vakuolisierendes Zytotoxin
- Lipid A (Bestandteil von LPS)
Krankheitsbilder
Mit Helicobacter pylori assoziierte Krankheitsbilder sind:
- chronische Typ-B-Gastritis (mit oder ohne Symptome)
- Duodenalulcus, seltener Magenulcus
- chronische, atrophische Gastritis, aus der sich u.U. ein Adenokarzinom des Magens entwickeln kann, das sich meistens distal befindet
- Magenlymphom (MALT-Lymphom)
Antral kommt es häufig zu einer Entzündung und im Corpus zu einer gesteigerten Säureproduktion. Protektive Wirkungen von Infektion mit Helicobacter pylori bezüglich der Entwicklung einer gastrooesophagealen Refluxkrankheit bzw. des Barrett-Ösophagus werden diskutiert.
Diagnostik
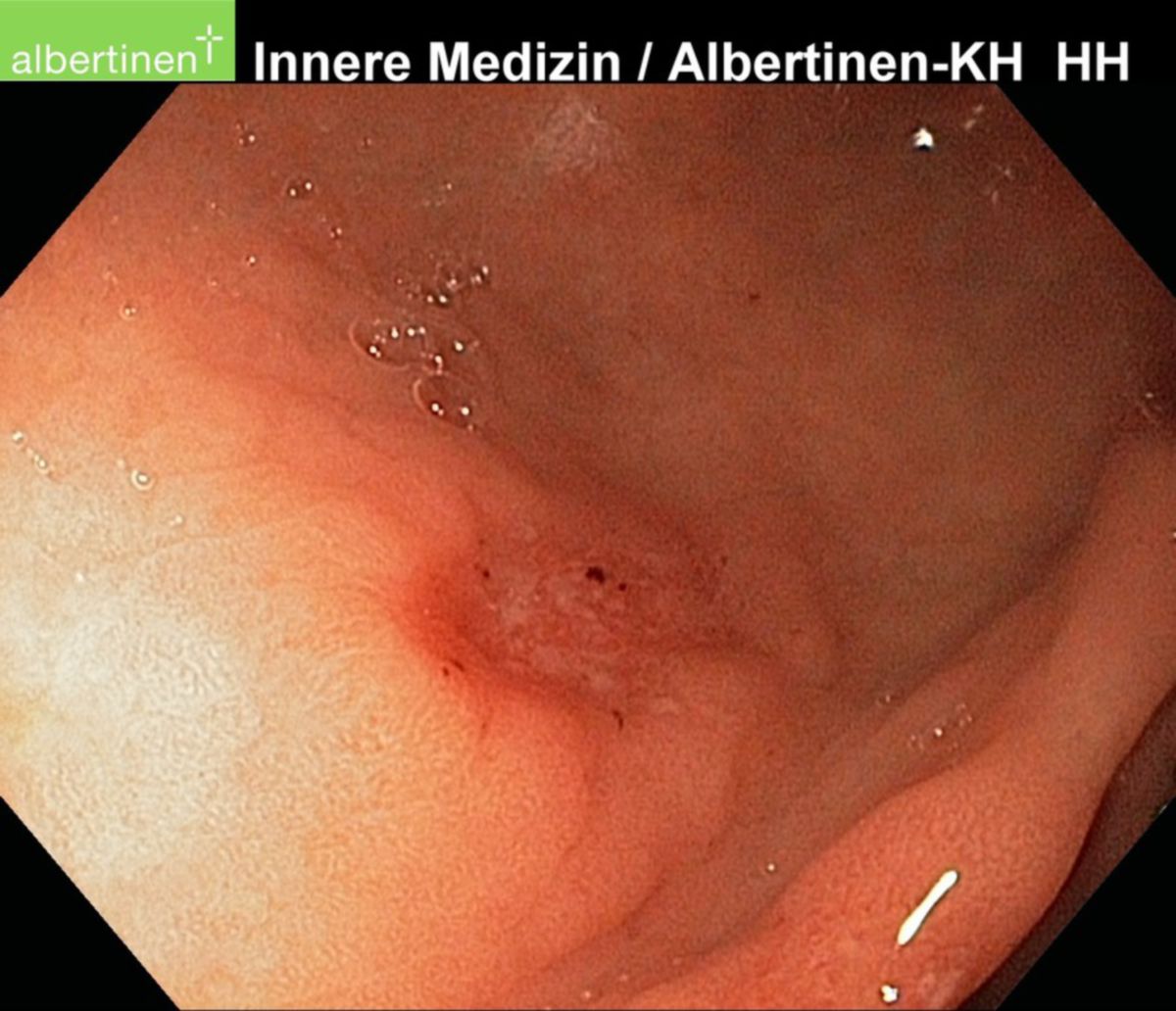
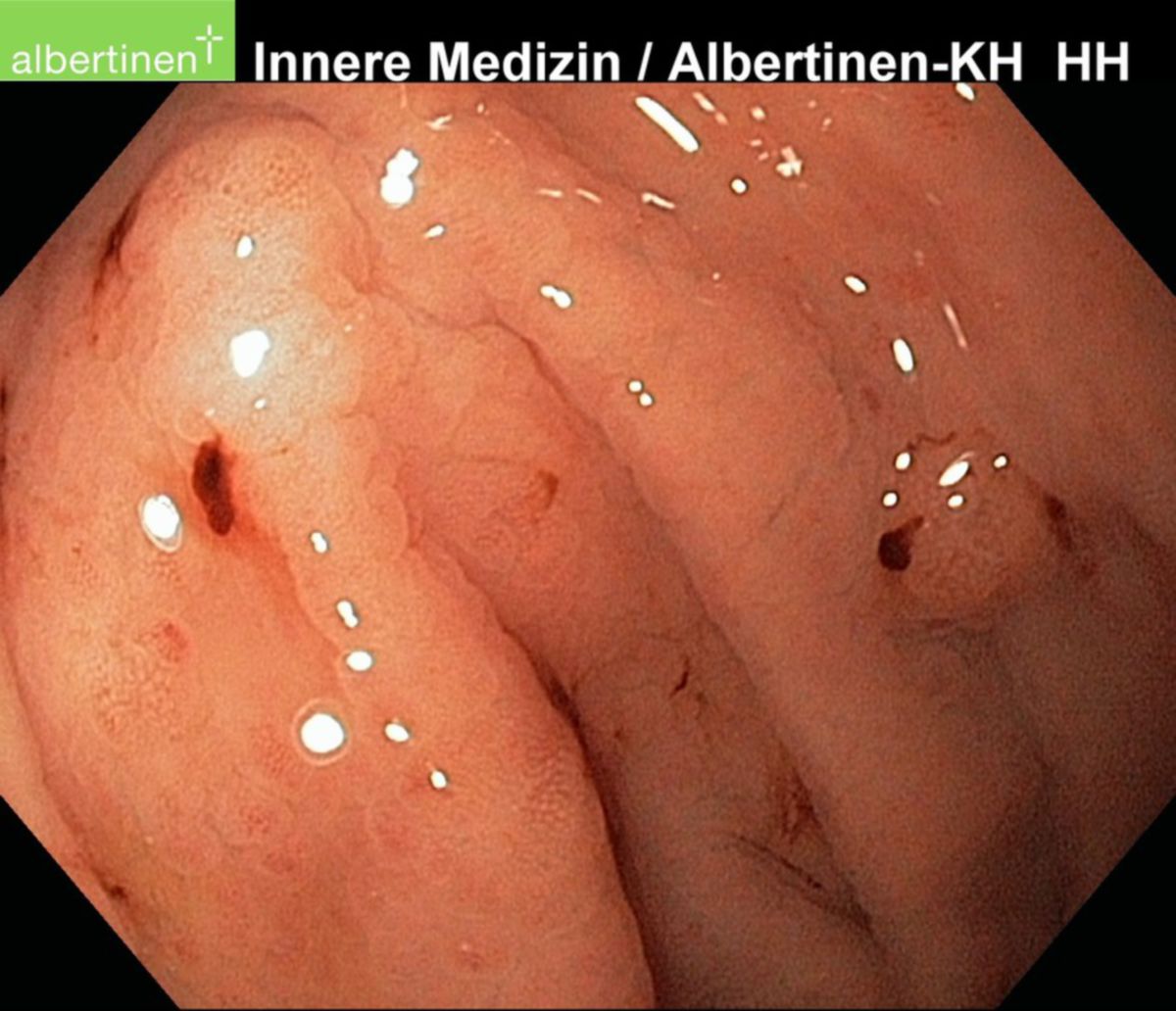
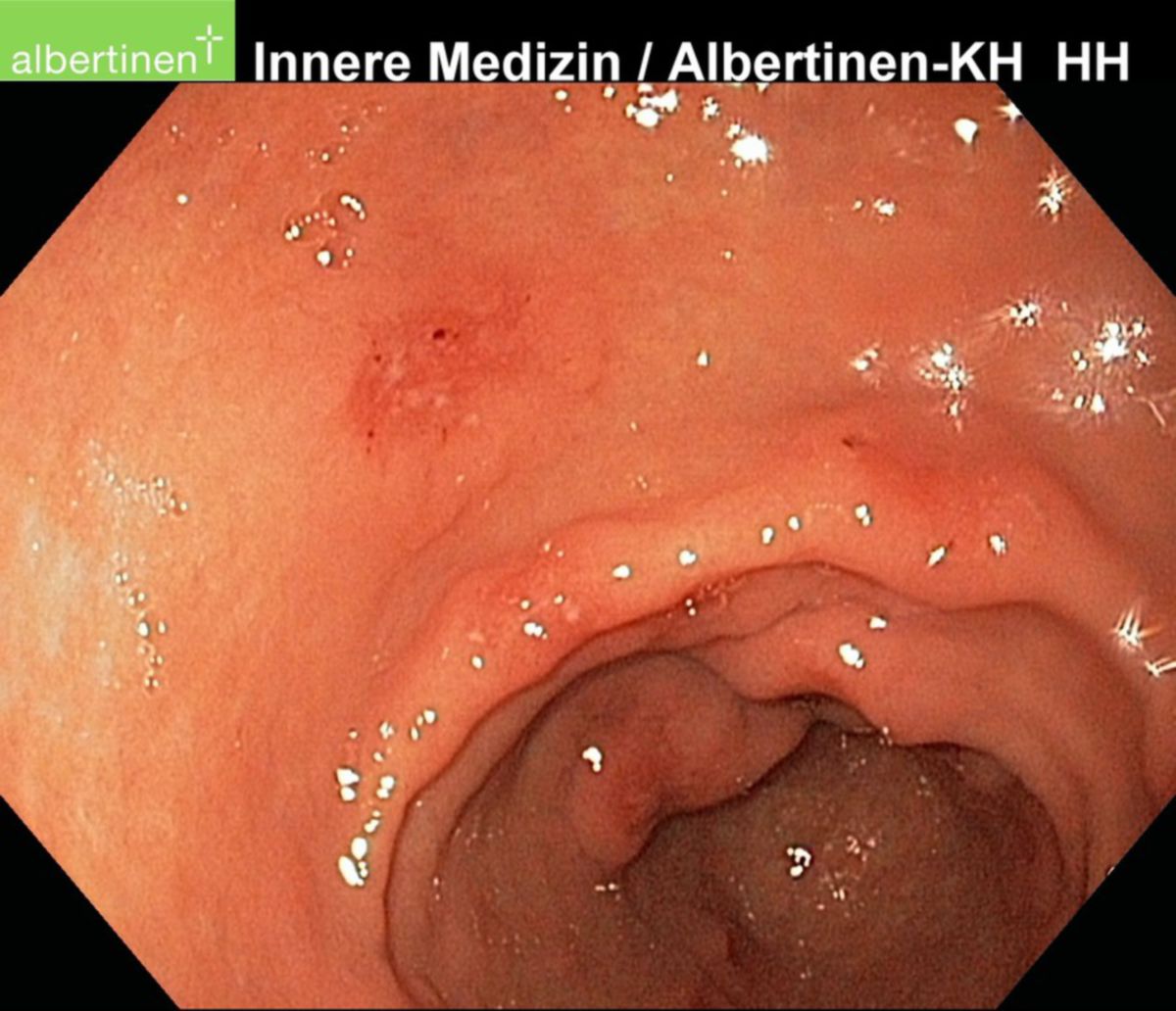
Zur klinischen Diagnostik einer Helicobacter-pylori-Infektion steht ein breites Spektrum an invasiven und nichtinvasiven Testverfahren zur Verfügung. Bei Verdacht auf eine durch Helicobacter pylori hervorgerufene Erkrankung (z.B. chronische Gastritis) empfiehlt sich die Durchführung einer Gastroskopie mit Entnahme von Biopsien aus Antrum und Corpus des Magens. Zusätzlich werden Testverfahren eingesetzt, die dem Nachweis einer aktuellen Infektion mit HP dienen.
Die Auswahl des Testverfahrens sollte nach der klinischen Indikation erfolgen und die Abwägung von Risiken, Kosten und Zeitaufwand beinhalten.
Invasive Testverfahren
Als invasive Testverfahren bezeichnet man Verfahren, die im Rahmen einer Gastroskopie durchgeführt werden. Hierzu zählen:
- Kultureller Nachweis von HP aus dem Magenbiopsat (Spezialnährmedium bei 37°C)
- Histopathologischer Nachweis von HP aus dem Magenbiopsat
- PCR zum Nachweis von Erreger-DNA aus dem Magenbiopsat
- Durchführung eines Urease-Schnelltests während der Gastroskopie
Laut den Handlungsempfehlungen der S2k-Leitlinie von 2016 wird das Anfertigen einer Kultur und der Nachweis mittels PCR nur bei der Frage nach Resistenzen empfohlen.
Nichtinvasive Testverfahren
Alternativ oder zusätzlich zur endoskopischen Diagnostik können nichtinvasive Testverfahren durchgeführt werden. Dies kann beispielsweise bei kontraindizierter Gastroskopie oder uneindeutigen Befunden der invasiven Diagnostik notwendig sein:
- Durchführung eines 13C-Atemtests
- serologischer Nachweis von Helicobacter-pylori-Antikörpern
- Nachweis von Helicobacter-pylori-Antigen im Stuhl
Helicobacter-pylori-Antigen im Stuhl
Der Stuhl-Antigentest auf Helicobacter pylori ist eine Alternative zum 13C-Atemtest. Bei ähnlicher Sensitivität und Spezifität (85 bis 95% für beide Verfahren) hat der Antigentest gegenüber dem Atemtest die Vorteile, dass er bei jeder Patientengruppe durchgeführt werden kann (keine Mitarbeit des Patienten nötig) und deutlich einfacher auszuwerten ist.
Mögliche Indikationen eines Antigentests sind:
- Kontrolluntersuchung nach Helicobacter-pylori-Eradikationstherapie (mindestens vier Wochen abgeschlossen)
- Ausschluss einer Reinfektion bei gastroskopisch gesichertem Ulcus duodeni
- Kontraindizierte Gastroskopie (z.B. bei Blutgerinnungsstörungen)
- Verdacht auf eine Helicobacter-pylori-Infektion bei Kindern
- Erregernachweis bei uneindeutigen diagnostischen Befunden (serologisch oder gastroskopisch)
Helicobacter-pylori-Antikörper im Serum
Die Bestimmung von Antikörpern gegen Helicobacter pylori kann helfen, eine aktuelle (akute oder chronische) Infektion mit Helicobacter pylori nachzuweisen. Da die Antikörper nach einer Infektion lange persistieren, ist eine Unterscheidung zwischen aktueller oder durchgemachter Infektion oft schwierig.
Der Antikörpernachweis gelingt mittels ELISA (Suchtest) und Immunoblot (Bestätigungstest).
Material
Für die Untersuchung wird 1 ml Serum benötigt.
Referenzbereich
| Antikörperklasse | Ergebnis | |
|---|---|---|
| IgG + IgA (ELISA) | negativ | unter 20 U/l |
| grenzwertig positiv | 20 bis 30 U/l | |
| positiv | über 30 U/l | |
Beim Nachweis von IgG-Antikörpern im ELISA erfolgt die Bestätigung mittels Immunoblot.
Interpretation
Für ein akutes Geschehen sprechen hoch-positive IgA-Werte sowie ein Anstieg der IgG-Werte innerhalb von zwei Wochen.
Bei einer chronischen Infektion zeigen sich vornehmlich positive IgG-Antikörper.
Therapie
Die Behandlung erfolgt unter anderem mit einer Bismut-Quadrupeltherapie oder einer Triple-Therapie. Hierbei empfiehlt die aktuelle Leitlinie (Stand 2022) zur Eradikation als Erstlinientherapie die Bismut-Quadrupeltherapie und die Triple-Therapie erst im Rahmen der Zweitlinientherapie.
Bei der Bismut-Quadruple-Therapie werden Tetracyclin, Metronidazol, Bismutsalz und Protonenpumpeninhibitoren (PPI), wie beispielsweise Pantoprazol, gegeben. Die Therapiedauer beträgt mindestens 10 Tage.[2]
Die Triple-Therapie erfolgt entweder nach dem französischen oder italienischen Schema:
- Französisches Schema: Amoxicillin, Clarithromycin, PPI
- Italienisches Schema: Metronidazol, Clarithromycin, PPI
siehe auch: Helicobacter-pylori-Eradikation
Quellen
- ↑ Mulchandani et al. Detection of Helicobacter Species from Dog Stomachs. Research and Reviews: Journal of Veterinary Science and Technology; 2013
- ↑ Pharmazeutische Zeitung - Therapie nach Resistenzlage, abgerufen am 04.04.2022
Literatur
- S2k-Leitlinie Helicobacter pylori und gastroduodenale Ulkuskrankheit, abgerufen am 16.01.2023
- Kusters et al. Pathogenesis of Helicobacter pylori Infection. Clin Microbiol Rev; 2006