Checkpoint-Inhibitor
Synonyme: Immuncheckpoint-Inhibitor, Immun-Checkpoint-Inhibitor
Englisch: immune checkpoint inhibitor
Definition
Checkpoint-Inhibitoren, kurz ICIs, sind Arzneistoffe aus der Gruppe der Checkpoint-Modulatoren, die Immuncheckpoints hemmen. Sie modifizieren dadurch die immunologische Eigentoleranz und werden in der Immunonkologie zur medikamentösen Tumortherapie eingesetzt.
Hintergrund
Immuncheckpoints sind wichtige Kontrollpunkte des Immunsystems. Sie basieren auf Oberflächenrezeptoren, die zusammen mit ihren Liganden verhindern, dass das Immunsystem körpereigene Zellen angreift. Bei vielen malignen Tumoren sind die Proteine hochreguliert, die inhibitorische Immuncheckpoints ansprechen. Damit entgehen die Tumorzellen den Angriffen des Immunsystems (Immunevasion).
Wirkmechanismus
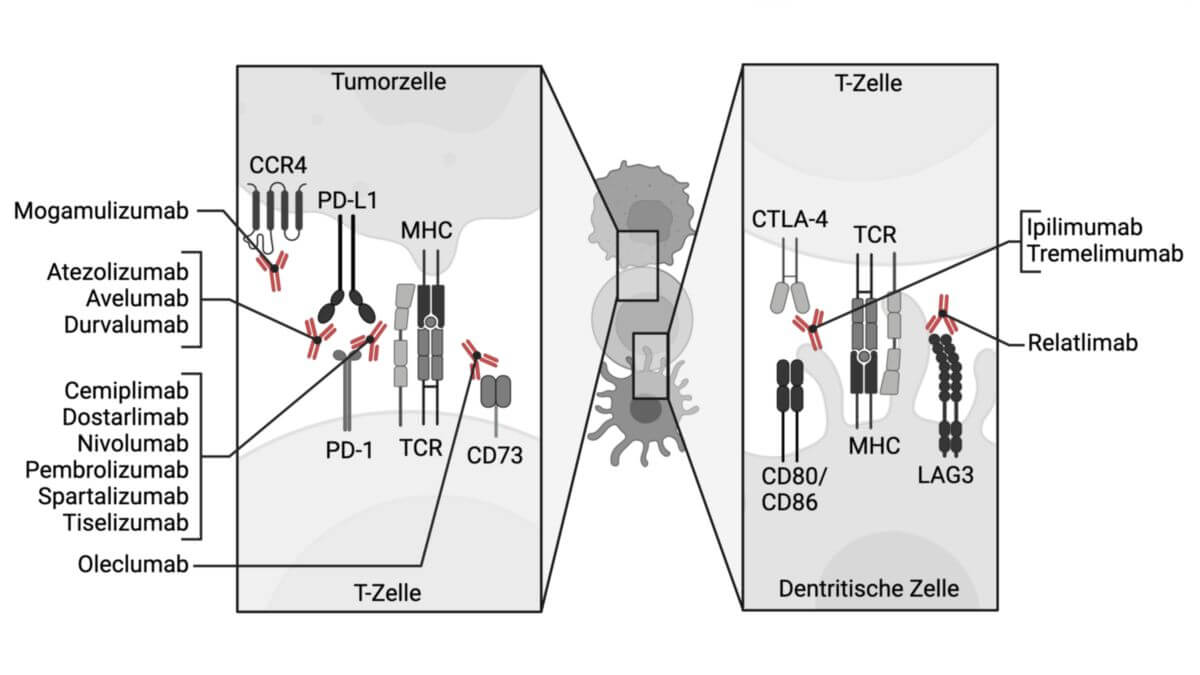
Checkpoint-Inhibitoren blockieren inhibitorische Immuncheckpoints und triggern dadurch die intrinsische Anti-Tumor-Immunantwort von T-Zellen. Sie können sich gegen einen bestimmten Rezeptor (z.B. PD-1) oder seinen Liganden (PD-L1) richten. Bei den Checkpoint-Inhibitoren handelt es sich daher in der Regel um monoklonale Antikörper ("-mab").
Checkpoint-Inhibitoren haben in vielen klinischen Studien signifikante Behandlungsresultate erzielt. Ihre Wirkung ist jedoch – wie bei der konventionellen Chemotherapie – oft nicht dauerhaft, da Tumorzellen durch Mutation und Selektion genetische Varianten entwickeln, die durch neue Wege der Immunevasion den therapeutischen Effekt der Checkpoint-Inhibitoren umgehen.[1]
Einteilung
Etablierte Checkpoint-Inhibitoren richten sich u.a. gegen CTLA-4, PD-1 und PD-L1. Entsprechend unterscheidet man:
Aktuell (2024) werden zahlreiche weitere Angriffspunkte erforscht, unter anderem gegen CCR4, TIM-3, LAG3 und TGF-β. Von den Checkpoint-Inhibitoren abgegrenzt werden Checkpoint-Agonisten, die an stimulatorische Immuncheckpoints binden.
Substanzen
Derzeit (2024) verfügbare oder in klinischer Prüfung befindliche Checkpoint-Inhibitoren sind u.a.:[2]
| Substanz | Target |
|---|---|
| Atezolizumab | PD-L1 |
| Avelumab | PD-L1 |
| Cemiplimab | PD-1 |
| Dostarlimab | PD-1 |
| Durvalumab | PD-L1 |
| Ipilimumab | CTLA-4 |
| Lirilumab | KIR |
| Mogamulizumab | CCR4 |
| Nivolumab | PD-1 |
| Oleclumab | CD73 |
| Pembrolizumab | PD-1 |
| Relatlimab | LAG3 |
| Serplulimab | PD-1 |
| Spartalizumab | PD-1 |
| Tislelizumab | PD-1 |
| Tremelimumab | CTLA-4 |
Im weiteren Sinn werden von einigen Autoren auch kleinmolekulare Verbindungen wie Ciforadenant (A2A-Rezeptor) und Galunisertib (TGF-β) zu den Checkpoint-Inhibitoren gerechnet.[2]
Nebenwirkungen
Checkpoint-Inhibitoren können eine dysregulierte Immunantwort mit unerwünschten Autoimmunreaktionen in Gang setzen, da sie die immunologische Eigentoleranz verändern und dadurch auch eine Autoaggression gegen gesundes Gewebe auslösen. Diese Immune-related Adverse Events (irAEs) können jedes Organsystem betreffen.
Zu den möglichen Folgen zählen u.a. Arthritis (bis zu 16 % der Patienten), Hypophysitis, Meningitis, Pneumonitis, Colitis, Hepatitis, Pankreatitis mit Diabetes mellitus, Nephropathie bzw. Nephritis, Myokarditis, Thyreoiditis mit Hypothyreose, Erytheme, Uveitis, Nebenniereninsuffizienz, Thrombozytopenie und Thrombosen.[3]
Quellen
- ↑ Nicholas L Syn, Michele W L Teng Prof Tony S K Mok, Ross A Soo: De-novo and acquired resistance to immune checkpoint targeting. The Lancet Volume 18, Issue 12, PE731-E741, December 01, 2017
- ↑ 2,0 2,1 A Review of Cancer Immunotherapy, Esfahani et al. Current Oncology, Vol. 27, Supp. 2, 87-97, April 2020.
- ↑ Heinzerling L et al. Checkpoint-Inhibitoren. Diagnostik und Therapie von Nebenwirkungen. Dtsch Arztebl Int 2019