Atezolizumab
Handelsname: Tecentriq®
Synonyme: MPDL-3280A, RG-7446
Englisch: atezolizumab
Definition
Atezolizumab ist ein monoklonaler Antikörper aus der Gruppe der Checkpoint-Inhibitoren. Er wird zur Behandlung einer Reihe von Karzinomen eingesetzt, insbesondere beim nicht-kleinzelligen Lungenkarzinom (NSCLC).
Chemie
Atezolizumab ist ein im Fc-Teil modifizierter, humanisierter monoklonaler Antikörper des Typs IgG1κ mit einer molaren Masse von 145 kDa. Die Synthese erfolgt in Ovarialzellen des chinesischen Hamsters mittels rekombinanter Desoxyribonukleinsäure(DNA)-Technologie.
Wirkmechanismus
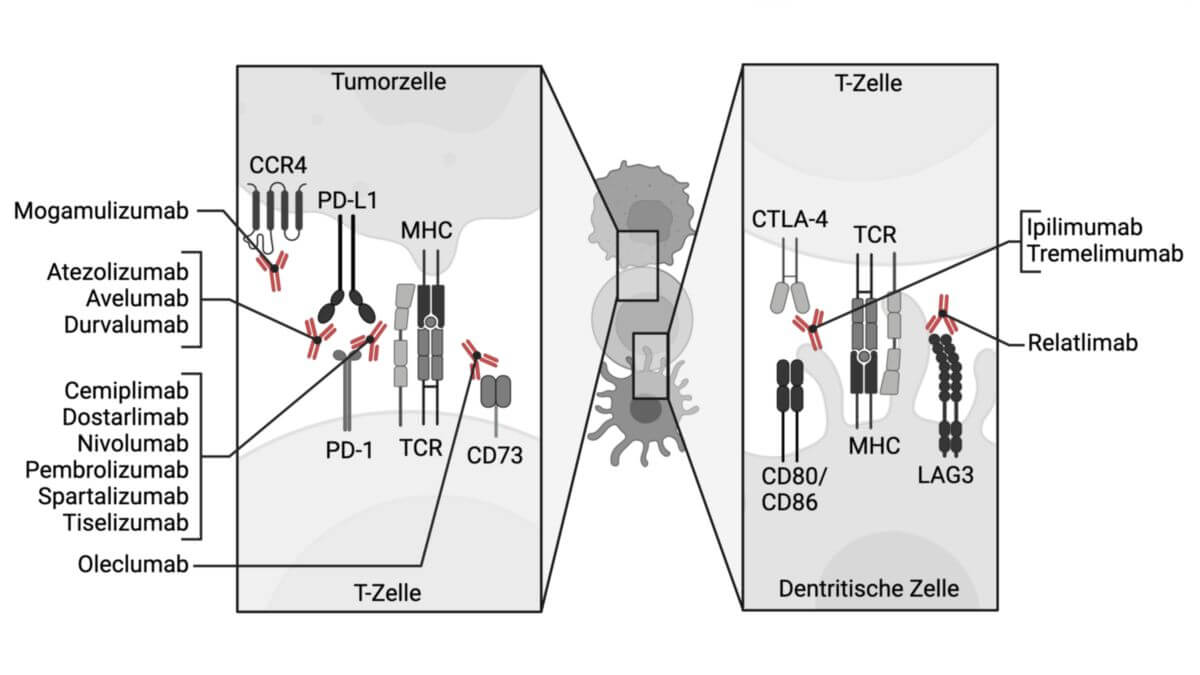
Atezolizumab bindet spezifisch an PD-L1 ("programmed cell death ligand 1") und blockiert dadurch die Wechselwirkung zwischen PD-L1 und dem PD-1-Rezeptor. Durch die Bindung an PD-L1 werden zytotoxische CD8+ T-Zellen aktiviert und zur Proliferation angeregt, was zu einer Verstärkung bzw. Wiederherstellung der gegen den Tumor gerichteten T-Zell-Antwort führt.
Pharmakokinetik
Atezolizumab hat nach intravenöser Applikation ein Verteilungsvolumen von 6,91 Litern (ca. 0,1 l/kgKG). Der Steady state wird nach ca. 6 bis 9 Wochen erreicht. Die Biotransformation wurde nicht untersucht; von einem langsamen proteolytischen Katabolismus ist auszugehen. Die Eliminationshalbwertszeit liegt bei rund 27 Tagen.[1]
Indikationen
Atezolizumab ist zur Behandlung folgender Tumoren bei erwachsenen Patienten indiziert:[1]
Urothelkarzinom
- Als Monotherapie bei lokal fortgeschrittenen oder metastasierten Tumoren
- nach vorheriger platinhaltiger Chemotherapie oder
- wenn eine Behandlung mit Cisplatin als ungeeignet angesehen wird und der Tumor eine PD-L1-Expression ≥ 5 % aufweist.
Nicht-kleinzelliges Lungenkarzinom (NSCLC) im Frühstadium
- Als Monotherapie zur adjuvanten Behandlung des NSCLC nach vollständiger Resektion und platinbasierter Chemotherapie mit hohem Risiko für ein Rezidiv und mit Tumoren
- zur Erstlinienbehandlung des metastasierten NSCLC mit nichtplattenepithelialer Histologie in Kombination mit Bevacizumab, Paclitaxel und Carboplatin; bei Patienten mit EGFR-mutiertem oder ALK-positivem NSCLC besteht eine Indikation nur nach Versagen der entsprechenden zielgerichteten Therapien;
- zur Erstlinienbehandlung des metastasierten NSCLC mit nicht-plattenepithelialer Histologie ohne EGFR-mutiertes oder ALK-positives NSCLC in Kombination mit nab-Paclitaxel und Carboplatin;
- als Monotherapie zur Erstlinienbehandlung des metastasierten NSCLC, bei Tumoren mit einer PD-L1-Expression ≥ 50 % der Tumorzellen oder ≥ 10 % bei tumorinfiltrierenden Immunzellen und ohne EGFR-mutiertes oder ALK-positives NSCLC haben;
- als Monotherapie bei lokal fortgeschrittenem oder metastasiertem NSCLC nach vorheriger Chemotherapie; Patienten mit EGFR-mutiertem oder ALK-positivem NSCLC sollen vor der Therapie bereits entsprechende zielgerichtete Therapien erhalten haben.
Kleinzelliges Lungenkarzinom (SCLC)
- Zur Erstlinienbehandlung des SCLC im fortgeschrittenen Stadium in Kombination mit Carboplatin und Etoposid.
Triple-negatives Mammakarzinom (TNBC)
- In Kombination mit nab-Paclitaxel bei nicht resezierbaren lokal fortgeschrittenen oder metastasierten TNBC bei Tumoren mit einer PD-L1-Expression ≥ 1 % und ohne vorherige Chemotherapie.
Hepatozelluläres Karzinom (HCC)
- In Kombination mit Bevacizumab bei fortgeschrittenen oder nicht resezierbaren HCC, die keine vorherige systemische Behandlung erhalten haben.
Darreichungsform
Atezolizumab steht in zwei verschiedenen Darreichungsformen zur Verfügung:
- als Konzentrat zur Herstellung einer Infusionslösung zur intravenösen Anwendung
- als Injektionslösung zur subkutanen Anwendung.
Dosierung
Die empfohlene Dosierung beträgt in Abhängigkeit vom zu behandelnden Tumor [1]
- 840 mg einmal alle zwei Wochen oder
- 1.200 mg einmal alle drei Wochen oder
- 1.680 mg einmal alle vier Wochen.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Zur Prävention infusionsbedingter Reaktionen kann eine Prämedikation mit einem Antipyretikum und Antihistaminikum eingesetzt werden.
Nebenwirkungen
Bedingt durch den spezifischen Wirkmechanismus von Atezolizumab kann es unter der Therapie zu immunvermittelten Nebenwirkungen kommen, die sich als immunvermittelte Pneumonitis, Hepatitis, Myokarditis[2], Nephritis, Kolitis, Pankreatitis, Meningoenzephalitis, Neuropathie oder Endokrinopathie (Diabetes mellitus Typ 1, Nebenniereninsuffizienz, Thyreopathie) manifestieren können.[1]
Folgende Nebenwirkungen treten unter Atezolizumab häufig (≥ 1:100, < 1:10) oder sehr häufig (≥ 1:10) auf:[1]
- Infusionsbedingte Reaktion
- Blutbildendes System: Thrombozytopenie[3]
- Immunsystem: Hypersensitivität
- Endokrines System: Hypothyreose, Hyperthyreose
- Kardiovaskuläres System: Hypotonie
- Atemwege: Dyspnoe
- Gastrointestinaltrakt: Nausea, Diarrhö, Erbrechen, Kolitis, Bauchschmerz, Inappetenz, Dysphagie
- Haut: Exanthem, Pruritus
- Bewegunsgapparat: Schmerzen, Arthralgie
- Fatigue, Fieber, Schüttelfrost, Influenza-ähnliche Symptome
Unter der Behandlung kann eine akute hepatozelluläre oder cholestatische Leberschädigung[4] und ein akutes Nierenversagen[3] eintreten, die schwerwiegend und sogar lebensbedrohlich sein können.
Wechselwirkungen
Da Atezolizumab wie andere Proteine über katabole Stoffwechselwege abgebaut wird, sind keine direkten Wechselwirkungen mit anderen Arzneimitteln zu erwarten.
Eine Verwendung systemischer Glukokortikoide oder Immunsuppressiva vor Behandlungsbeginn mit Atezolizumab sollte jedoch aufgrund möglicher Beeinträchtigungen der Wirksamkeit von Atezolizumab vermieden werden.
Kontraindikation
- Überempfindlichkeit gegen Atezolizumab oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft und Stillzeit
Experimentelle Untersuchungen zur Reproduktionstoxizität wurden bisher (2024) nicht durchgeführt. Es liegen keine Daten zur Anwendung von Atezolizumab bei Schwangeren vor. Frauen im gebärfähigen Alter müssen während und für 5 Monate nach der Behandlung mit Atezolizumab eine zuverlässige Verhütungsmethode anwenden.[1]
Es ist davon auszugehen, dass Atezolizumab in die Muttermilch übertritt, sodass ein Risiko für das gestillte Kind nicht ausgeschlossen werden kann. Ob das Stillen zu unterbrechen ist oder auf die Behandlung während der Stillzeit verzichtet werden soll, ist im Einzelfall zu entscheiden.[1]
Toxizität
Es liegen aktuell (2024) keine Erfahrungen zur Symptomatik einer Überdosierung oder Vergiftung mit Atezolizumab vor. Es ist davon auszugehen, dass es vor allem zu schweren immunvermittelten Nebenwirkungen kommen kann. Die Behandlung erfolgt in jedem Fall symptomatisch. Ein spezifisches Antidot steht bisher (2024) nicht zur Verfügung. Antikörper und Antigen-Antikörper-Komplexe lassen sich durch Plasmapherese oder Austauschtransfusion entfernen.
Nutzenbewertung
Der Zusatznutzen einer Therapie mit Atezolizumab wird vom G-BA auf der Basis der vom IQWiG ausgewerteten Studienergebnisse wie folgt eingeordnet:[7]
- Hinweis auf einen beträchtlichen Zusatznutzen gegenüber einer zweckmäßigen Vergleichstherapie mit Docetaxel
- nicht belegter Zusatznutzen gegenüber einer Best Supportive Care
Kosten
Die Jahrestherapiekosten betragen pro Patient rund 100.000 €.[8]
ATC-Code
- L01FF05 - Antineoplastische und immunmodulierende Mittel - Antineoplastische Mittel - Monoklonale Antikörper und Antikörper-Wirkstoff-Konjugate - PD-1/PDL-1 (Programmed Cell Death-1-Rezeptor/Programmed Cell Death-Ligand-1) - Inhibitoren
Quellen
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Zusammenfassung der Merkmale des Arzneimittels Tecentriq, EMA, abgerufen am 04.08.2024
- ↑ Tokunaga T et al. Fulminant myocarditis during postoperative adjuvant chemotherapy for lung cancer with atezolizumab: a case report. J Med Case Reports 2024
- ↑ 3,0 3,1 Yılmaz A et al. Possible atezolizumab-associated acute kidney injury and immune thrombocytopenia. J Oncol Pharm Pract. 2020 Oct;26(7):1791-1794. doi: 10.1177/1078155220913081. Epub 2020 Apr 1. PMID: 32237958.
- ↑ LiverTox: Clinical and Research Information on Drug-Induced Liver Injury; Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases; 2012, abgerufen am 01.04.2023
- ↑ Markham A. Atezolizumab: First Global Approval. Drugs. 2016 .
- ↑ Tecentriq, EMA, abgerufen am 04.08.2024
- ↑ G-BA: Atezolizumab Beschluss vom 16. März 2018, BAnz AT 16.04.2018 B2
- ↑ IQWiG-Berichte – Nr. 576 Atezolizumab (nicht kleinzelliges Lungenkarzinom) – Nutzenbewertung gemäß § 35a SGB V, abgerufen am 20.8.2018
Weblinks
- Drugbank - Atezolizumab, abgerufen am 04.08.2024
- Pharmazeutische Zeitung Arzneistoffe - Atezolizumab, abgerufen am 04.08.2024
- Gelbe Liste Wirkstoffe - Atezolizumab, abgerufen am 04.08.2024
- PharmaWiki - xxx, abgerufen am 04.08.2024
- PubChem: 481101521
- MeSH: xxx - nicht festgelegt