Cemiplimab
Handelsname: Libtayo®
Synonym: REGN-2810
Englisch: cemiplimab
Definition
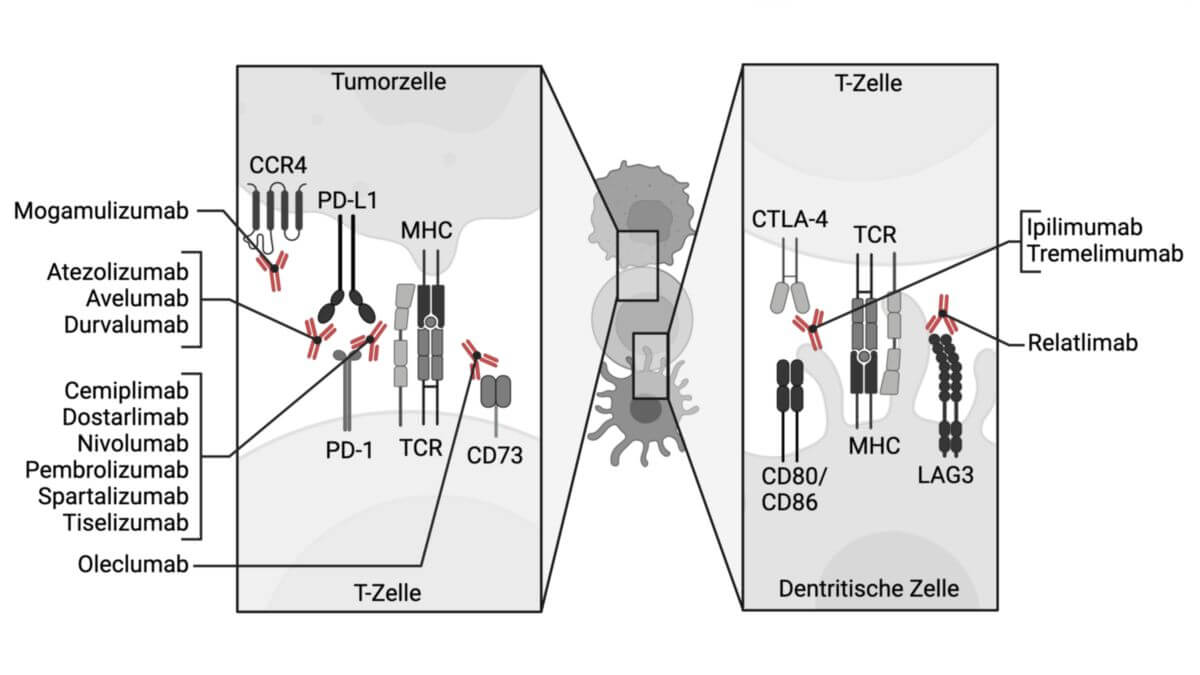
Cemiplimab ist ein monoklonaler Antikörper, der zu den Checkpoint-Inhibitoren zählt. Er wird u.a. zur Therapie von Plattenepithelkarzinomen der Haut (cSCC) eingesetzt.
Wirkmechanismus
Cemiplimab richtet sich gegen das Transmembranprotein "Programmed cell death protein 1", kurz PD-1. Die Aktivierung dieses Rezeptors reduziert Autoimmunreaktionen und fördert die immunologische Eigentoleranz. Die Hemmung des Rezeptors führt daher zu einer erhöhten Aktivität des Immunsystems gegen körpereigenes Gewebe und damit auch gegen das Tumorgewebe.
Indikation
Cemiplimab ist indiziert als Monotherapie zur Behandlung von erwachsenen Patienten mit metastasiertem oder lokal fortgeschrittenem kutanen Plattenepithelkarzinom, wenn eine kurative Operation oder kurative Strahlentherapie nicht möglich ist.
Nebenwirkungen
Zu den möglichen Nebenwirkungen von Cemiplimab gehören u.a.:
- Fatigue
- Diarrhö
- Hepatitis: Erhöhung der Transaminasen
- Hypothyreose, Hyperthyreose
- Pneumonie
- verzögertes Auftreten von Hauterkrankungen, u.a. lichenoide Dermatose, bullöses Pemphigoid, Erythema multiforme, Ekzeme, Lupus erythematodes und Sarkoidose.
Darreichungsformen
Cemiplimab steht als 350 mg Konzentrat zur Herstellung einer Infusionslösung zur Verfügung.
Dosierung
Die empfohlene Dosis beträgt 350 mg Cemiplimab alle 3 Wochen, verabreicht als intravenöse Infusion über einen Zeitraum von 30 Minuten.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.