Tremelimumab
Handelsnamen: IMJUDO®, Tremelimumab AstraZeneca
Synonyme: ticilimumab, CP 675, CP 675206
Englisch: tremelimumab
Definition
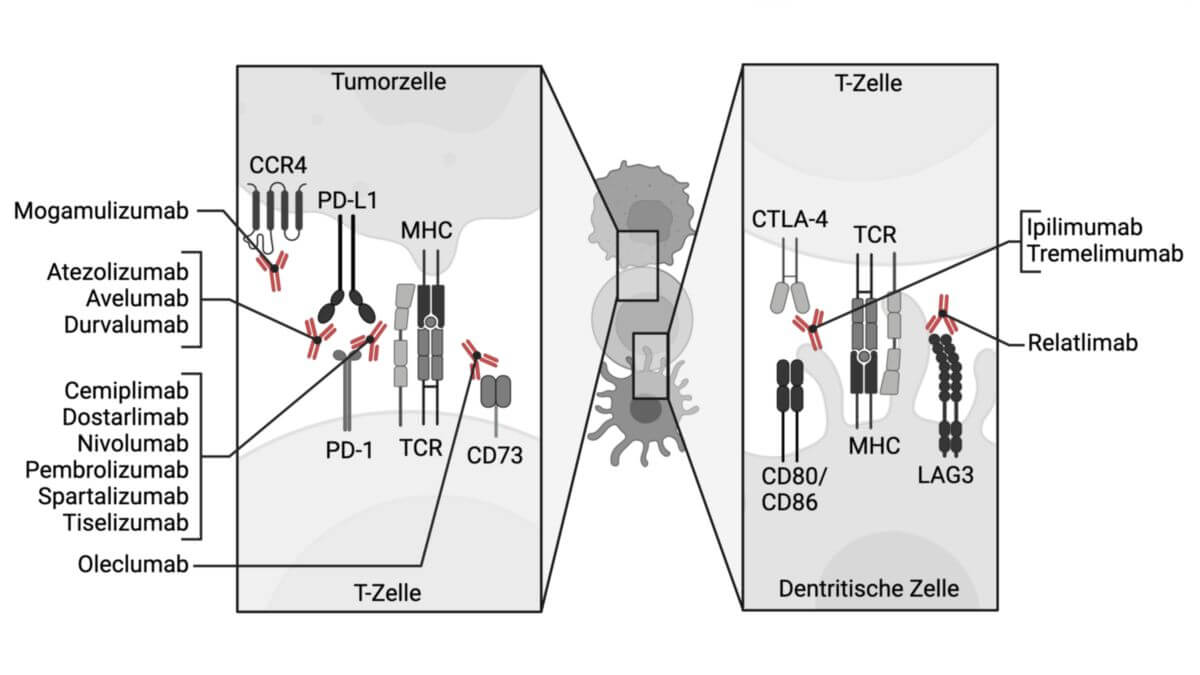
Tremelimumab ist ein CTLA-4-Inhibitor, der zu den so genannten Checkpoint-Inhibitoren gehört und zur Behandlung des metastasierten nichtkleinzelligen Lungenkarzinoms und des fortgeschrittenen oder nicht resezierbaren hepatozellulären Karzinoms eingesetzt wird.
Biochemie
Tremelimumab ist ein selektives, vollständig humanes Immunglobulin vom Isotyp IgG2. Die molare Masse beträgt 149 kDa. Tremelimumab wird als sterile, konservierungsmittelfreie, klare bis leicht opalisierende, farblose bis leicht gelbe Lösung angewendet.[1] Die CAS-Nummer lautet 745013-59-6.
Wirkmechanismus
Auf der Oberfläche von T-Lymphozyten wird zytotoxisches T-Lymphozyten-assoziiertes Antigen (CTLA-4) exprimiert, das einen Immuncheckpoint der Zelle darstellt und durch die Interaktion mit seinen Liganden CD80 (B7-1) und CD86 (B7-2) die Aktivierung von Effektor-T-Zellen begrenzt. Tremelimumab blockiert die Interaktion von CTLA-4 mit CD80 und CD86, sodass die Aktivierung und Proliferation der T-Zellen verstärkt, die Diversität der T-Zellen vermehrt und deren zytotoxische Aktivität verstärkt werden.[1]
Pharmakokinetik
Das Verteilungsvolumen im Steady-State (VSS) beträgt 6,33 Liter (ca. 0,1 l/kgKG). Humane IgG2 passieren die Plazenta und treten in die Muttermilch über. Die Elimination erfolgt durch Proteinkatabolismus über das retikuloendotheliale System oder durch den Abbau des Antikörper-Zielprotein-Komplexes. Die Eliminationshalbwertszeit beträgt 14,2 Tage.[1]
Indikation
Tremelimumab ist in Kombination mit Durvalumab zugelassen zur
- Erstlinienbehandlung des metastasierten nichtkleinzelligen Lungenkarzinoms (non-small cell lung cancer, NSCLC) ohne sensibilisierende EGFR-Mutationen oder ALK-positive Mutationen;[1]
- Erstlinienbehandlung des fortgeschrittenen oder nicht resezierbaren hepatozellulären Karzinoms (hepatocellular carcinoma, HCC).[2]
Darreichungsform
Tremelimumab steht in Form von Infusionslösung zur intravenösen Anwendung zur Verfügung.
Dosierung
Die Dosierung richtet sich bei der Behandlung des NSCLC nach der Therapiesituation:[1]
- Während einer platinbasierten Chemotherapie werden 75 mg Tremelimumab in Kombination mit 1.500 mg Durvalumab alle 3 Wochen (21 Tage) für 4 Zyklen (12 Wochen) verabreicht.
- Nach platinbasierter Chemotherapie werden 1.500 mg Durvalumab alle 4 Wochen und eine histologiebasierte Erhaltungstherapie mit Pemetrexed alle 4 Wochen verabreicht.
Bei der Behandlung des HCC beträgt die Einzeldosis 300 mg Tremelimumab in Kombination mit 1.500 mg Durvalumab in Zyklus 1/Tag 1, gefolgt von einer Durvalumab-Monotherapie alle 4 Wochen. Die Behandlung wird so lange fortgesetzt, bis eine Krankheitsprogression auftritt oder eine inakzeptable Toxizität auftritt.[2]
Weitere Einzelheiten zur Dosierung sind der Fachinformation zu entnehmen.[1][2]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Die häufigsten unerwünschten Wirkungen von Tremelimumab sind:[1][2]
Die häufigsten Veränderungen von Laborwerten sind
- Anstieg der Transaminasen, des Bilirubins, der alkalischen Phosphatase
- Abfall des Hämoglobins
- Hyponatriämie
- Abfall der Lymphozytenzahl
Unter der Therapie kann es zu einer Reihe von immunvermittelten Erkrankungen kommen:
- Pneumonitis oder interstitielle Lungenerkrankung
- Hepatitis, Pankreatitis, Kolitis
- Nephritis, Zystitis
- Dermatitis
- Myositis, Polymyositis, Myasthenia gravis, Guillain-Barré-Syndrom
- Myokarditis
- Meningitis, Enzephalitis
- Endokrinopathien der Schilddrüse, der Nebenniere, der Hypophyse, Diabetes mellitus Typ 1
- Thrombozytopenie
Wechselwirkungen
Die Wirksamkeit von Tremelimumab wird durch die systemische Anwendung von Kortikosteroiden und Immunsuppressiva beeinträchtigt. Diese Arzneimittel können aber zur Behandlung von immunvermittelten Nebenwirkungen eingesetzt werden.[1]
Pharmakokinetisch verursachte Wechselwirkungen sind bisher (2023) nicht bekannt.
Kontraindikationen
- Überempfindlichkeit gegen Tremelimumab oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft und Stillzeit
Daten zur Anwendung von Tremelimumab bei schwangeren Frauen liegen nicht vor. Frauen im gebärfähigen Alter müssen während der Behandlung mit Tremelimumab und noch mindestens 3 Monate nach der letzten Dosis von Tremelimumab eine zuverlässige Verhütungsmethode anwenden.[1]
Während der Behandlung und mindestens 3 Monate nach der letzten Dosis soll nicht gestillt werden.[1]
Zulassung
Das Arzneimittel ist in der EU seit 2023, in den USA seit 2022 zugelassen.[3]
ATC-Code
- L01FX20 - Antineoplastische und immunmodulierende Mittel - Monoklonale Antikörper und Antikörper-Wirkstoff-Konjugate
Quellen
Weblinks
- Drugs.com - Tremelimumab, abgerufen am , abgerufen am 07.05.2023
- Drugbank - Tremelimumab, abgerufen am 07.05.2023
- Gelbe Liste - Tremelimumab, abgerufen am 07.05.2023
- Pharmazeutische Zeitung Arzneistoffe - Tremelimumab, abgerufen am 07.05.2023
- MeSH: C520704