Hämoglobin
Synonym: Blutfarbstoff
Englisch: hemoglobin, haemoglobin
Definition
Als Hämoglobin, kurz Hb, bezeichnet man den eisenhaltigen, roten Blutfarbstoff in den Erythrozyten (roten Blutkörperchen) der Wirbeltiere und seine Varianten. Es ermöglicht den Sauerstoff-Transport im Körper über den Blutkreislauf.
Biochemie
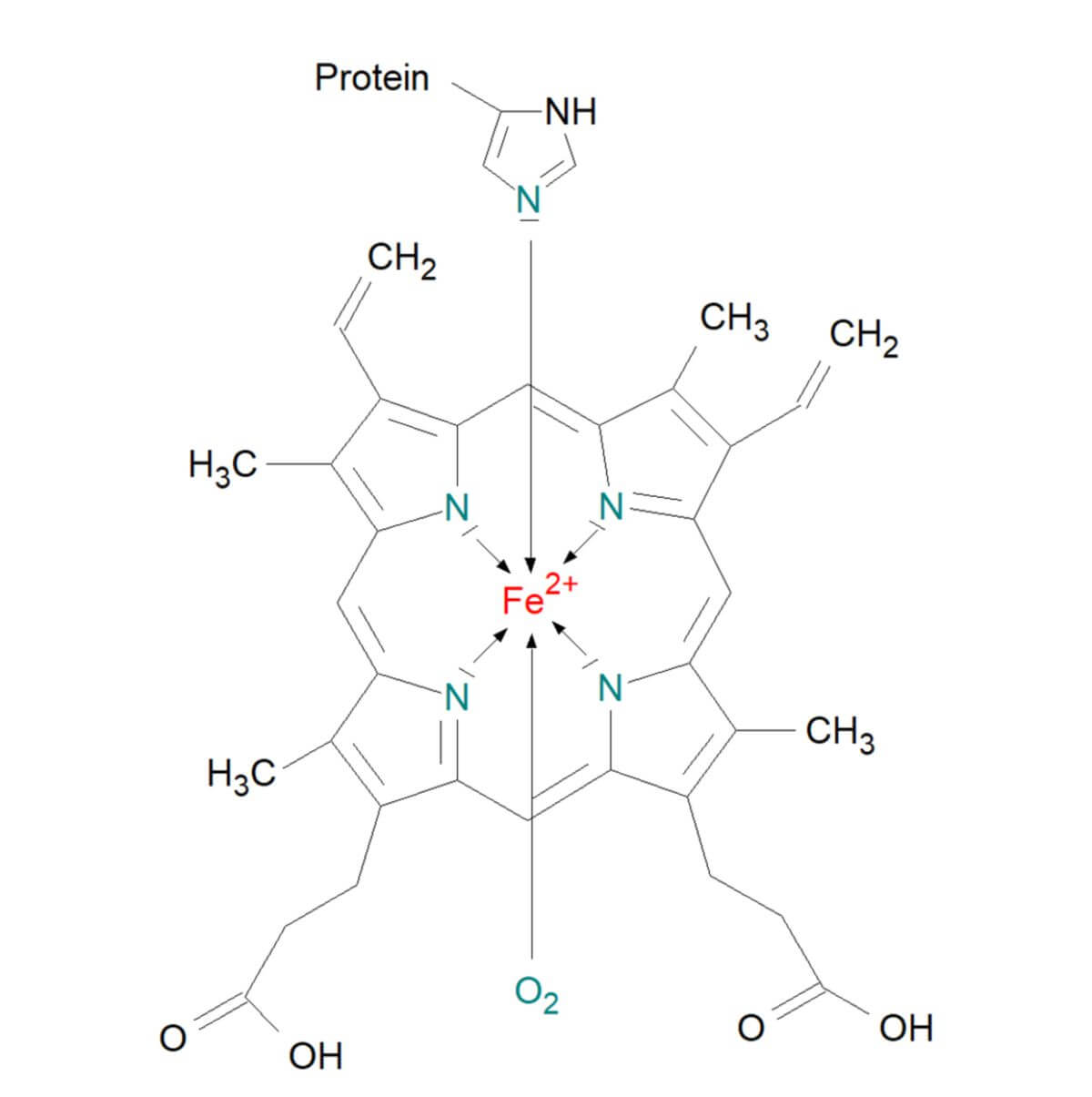
Die Grundstruktur des Hämoglobins besteht aus einem eisenhaltigen (Fe2+) Tetrapyrrolring, dem sauerstoffbindenden Häm als prosthetischer Gruppe und einem Proteinanteil, dem Globin.
Ein Hämoglobinmolekül wird als Heterotetramer aus zwei alpha- und zwei weiteren Untereinheiten gebildet, die eine Klassifikation des Hämoglobins ermöglichen. Die überwiegende Menge des adulten Hämoglobins (HbA) besteht aus zwei α- und zwei β-Ketten (α2β2), wohingegen das fetale Hämoglobin (HbF) aus zwei α- und zwei γ-Ketten besteht (α2γ2). Weiterhin sind δ-Untereinheiten beim adulten Hämoglobin beschrieben.
| Hämoglobinform | Zusammensetzung | % des Gesamt-Hb | |
|---|---|---|---|
| Adultes Hämoglobin | HbA0 | α2β2 | 97,5 % |
| HbA2 | α2δ2 | 2,5 % | |
| Fetales Hämoglobin | HbF | α2γ2 |
|
Jede dieser Untereinheiten besitzt eine prosthetische Gruppe, an der die eigentliche Sauerstoffbindung stattfindet, sodass das Hämoglobin-Tetramer insgesamt vier Sauerstoffmoleküle binden kann.
Genetik
Im menschlichen Genom sind zwei Gencluster auf Chromosom 11 und Chromosom 16 beschrieben, in denen die Hämoglobingene kodiert sind.
| Untereinheit | Gen | Genlokus | |
|---|---|---|---|
| Chromosom 11 | ε | HBE1 | 11p15.4 |
| Gγ | HBG2 | 11p15.4 | |
| Aγ | HBG1 | 11p15.4 | |
| δ | HBD | 11p15.4 | |
| β | HBB | 11p15.4 | |
| Chromosom 16 | ζ | HBZ | 16p13.3 |
| α2 | HBA2 | 16p13.3 | |
| α1 | HBA1 | 16p13.3 |
Physiologie
Gesunde Erwachsene bilden täglich 6 bis 7 g Hämoglobin. Hierfür werden 30 bis 40 mg Eisen benötigt, das zum Großteil durch den Abbau gealterter Erythrozyten bereitgestellt wird. Die Eisenresorption aus dem Darm beläuft sich auf etwa 1 mg pro Tag.
Je nach Beladungszustand mit Sauerstoff werden zwei Varianten des Hämoglobins unterschieden:
- sauerstoffreiches Oxyhämoglobin
- sauerstoffarmes Desoxyhämoglobin
Die Messung des Hämoglobins spielt eine große Rolle bei der Diagnostik von Anämien und erfolgt durch Abnahme von Vollblut mit anschließender Bestimmung der sog. Hämoglobin-Konzentration (Hb).
siehe auch: Hämoglobinsynthese, Hämoglobinabbau
Labormedizin
Die Bestimmung der Hämoglobinkonzentration (Hb-Wert) ist Teil der ärztlichen Routinediagnostik. Sie ermöglicht die Einschätzung der Sauerstofftransportkapazität des Blutes und dient der Aufdeckung von Anämien und Polyglobulien.
Bei Hyperlipidämie und Leukozytose kann es zu falsch erhöhten Hämoglobinwerten kommen.
| g/dl | mmol/l | |
|---|---|---|
| Männer | 13,5 bis 17,5 | 8,7 bis 11,2 |
| Frauen | 12 bis 16 | 7,5 bis 9,9 |
Für Kinder gelten altersspezifische Referenzbereiche.
Umrechnung
Varianten
HbA1c
Bei einer hohen Glukosekonzentration im Blut kommt es zu einer verstärkten, nicht-enzymatischen Glykierung des Hämoglobins. Das stabile Ketoamin, das durch die Glykierung von β-Hämoglobin an der Aminosäure Valin in Position 2 entsteht, wird als HbA1c bezeichnet. Da diese Reaktion nur bei längerfristig erhöhter Glukosekonzentration in relevantem Umfang stattfindet, wird HbA1c zur Kontrolle der Blutzuckereinstellung bei Diabetes mellitus verwendet.
Dyshämoglobine
Dyshämoglobine sind Hämoglobin-Derivate, die nicht mehr oxygenierbar sind, weil die Bindungsstelle für Sauerstoff am zentralen Eisenatom blockiert ist. Wird das Eisenion des Hämoglobins z.B. zu dreiwertigem Eisen oxidiert, entsteht das Methämoglobin (MetHb). Methämoglobin kann durch die NADH-abhängige Methämoglobin-Reduktase wieder in Hämoglobin überführt werden. Beim Menschen liegen in der Regel nicht mehr als 2 % des Hämoglobins als Methämoglobin vor.
Weitere Dyshämoglobine sind Carboxyhämoglobin (COHb, hat Kohlenmonoxid gebunden) und Sulfhämoglobin (SulfHb, Porphyrinspaltung durch Kontakt mit Schwefelverbindungen).
Klinik
Hämoglobinstörungen, die zu Erkrankungen führen, können in zwei Kategorien unterteilt werden:
- Quantitative Störungen: Eine der Untereinheiten wird gar nicht oder in geringen Mengen exprimiert. Störungen dieser Art werden Thalassämien genannt. Zu dieser Gruppe gehören alle angeborenen und erworbenen Thalassämie-Subtypen, die auf Strukturvarianten und Deletionsmutationen der Hämproteine oder auf Mutationen der Transkriptionsfaktoren zurückzuführen sind und die Expressionsstärke so beeinflussen.
- Qualitative/strukturelle Störungen: Hier besteht eine strukturelle Störung eines oder mehrerer der Proteinuntereinheiten, etwa durch Mutationen des kodierenden Gens. Zu dieser Gruppe gehören Mutationen der Untereinheiten-Gene oder Störungen der posttranslationalen Modifikation, welche die Struktur und Bindungsaffinität des Hämoglobins negativ beeinflussen. Beispiele sind die Sichelzellenanämie und die Methämoglobinämie.
Sichelzellenanämie und Beta-Thalassämie manifestieren sich bei Säuglingen erst etwa ab dem 3. Lebensmonat, wenn ein großer Teil des fetalen Hämoglobins durch das adulte Hämoglobin ausgetauscht wurde.
Skript
Podcast

Bildquelle
- Bildquelle Podcast: © Midjourney
Quellen
- Bernard G. Forget and H. Franklin Bunn: Classification of the Disorders of Hemoglobin. Cold Spring Harb Perspect Med. 2013 Feb; 3(2): a011684. doi: 10.1101/cshperspect.a011684
- Thieme via medici
- Laborlexikon.de; abgerufen am 08.03.2021
- Koolmann et al. Taschenatlas Biochemie des Menschen, 4. Auflage, Thieme-Verlag
- https://learn.genetics.utah.edu/content/genetics/hemoglobin