Sichelzellanämie
Synonyme: Sichelzellenanämie, homozygote Sichelzellerkrankung, Drepanozytose
Englisch: sickle cell anaemia
Definition
Die Sichelzellanämie ist eine Erbkrankheit, die zu den hämolytischen Anämien bzw. Hämoglobinopathien gehört. Sie wird durch einen genetischen Defekt (Punktmutation) ausgelöst, der zur Bildung von irregulärem Hämoglobin, dem sogenannten Sichelzellhämoglobin (Hämoglobin S, HbS) führt.
Genetik
Die Sichelzellanämie folgt einem autosomal-rezessiven Erbgang. Es besteht eine Punktmutation der ß-Globinkette, wobei an Position 6 hydrophiles Glutamat gegen hydrophobes Valin substituiert wurde. Dadurch werden hydrophobe Wechselwirkungen zwischen den ß-Globinketten ermöglicht. Im desoxygenierten Zustand des HbS bilden sich bei ausreichend hoher Konzentration Aggregate und es kommt zur Hämolyse.
Es erkranken nur homozygote Merkmalsträger, bei denen das mütterliche und väterliche Gen verändert ist. Heterozygote Merkmalsträger sind weitgehend symptomfrei, da beide Allele kodominant sind, d.h. die Merkmalsträger produzieren sowohl normales als auch defektes Hämoglobin. Allerdings wird auch bei ihnen unter starkem Sauerstoffmangel, wie zum Beispiel während einer Narkose, die Sichelform der Erythrozyten ausgebildet, sodass es zu einer Beeinträchtigung der Organdurchblutung kommen kann. Compound-Heterozygote, das heißt Patienten mit einem HbS-Allel und einem weiteren pathologischen Allel (z.B. HbC, HbE), zeigen ein der Sichelzellanämie ähnelndes Krankheitsbild (Sichelzellsyndrom).
Epidemiologie
Die Sichelzellanämie hat die größte Verbreitung in den Malariagebieten Afrikas und Asiens. In Äquatorialafrika sind 25 bis 40 % der Bevölkerung heterozygote Merkmalsträger. Die Häufigkeit des Defekts nimmt mit dem Abstand zum Äquator deutlich ab. Bei der afroamerikanischen Bevölkerung Amerikas liegt die Häufigkeit nur noch zwischen 5 und 10 %.
Dieses Phänomen lässt sich dadurch erklären, dass heterozygote Merkmalsträger eine relative Resistenz gegen Malaria besitzen – ein Umstand, der in Malariagebieten einen deutlichen Selektionsvorteil darstellt. In gemäßigten Breiten ist der Selektionsvorteil aufgrund der fehlenden Malaria nicht wirksam.
In Deutschland sind jährlich etwa 300 Kinder und Erwachsene von der Sichelzellerkrankung betroffen. Meist handelt es sich um Einwanderer aus Endemiegebieten.
Klinik
Die Sichelzellanämie manifestiert sich in der Regel erst ab dem 6. Lebensmonat. Zuvor ist fetales Hämoglobin (HbF) in den Erythrozyten enthalten.
Das akute Krankheitsgeschehen der Sichelzellanämie findet während einer sogenannten Sichelzellkrise statt, die mit akuten Schmerzen und Angstzuständen verbunden ist. Die Häufigkeit und Schwere der Sichelzellkrisen variieren stark. Die Schmerzen können überall auftreten und wenige Stunden bis zwei Wochen anhalten.
Auslöser
Mögliche Auslöser von Sichelzellkrisen sind:
- Infektionen, Fieber
- Hypoxie (beispielsweise auch beim Fliegen in großer Höhe)
- Dehydratation
- Azidose
- Hämolyse durch Medikamente, Kontrastmittel
- große körperliche Anstrengung
Organschäden
Vasookklusionen bei Sichelzellanämien führen zu wiederholten Mikroinfarzierungen, die wiederum Organschäden nach sich ziehen. Bereits in den ersten Lebensjahren kommt es zur funktionellen Asplenie mit erhöhter Infektneigung. Die akute venöse Obstruktion der Milz (splenische Sequestrationskrise) ist eine lebensbedrohliche Komplikation. Die Obstruktion der Netzhautgefäße führt zu einer Sichelzellretinopathie. Nierenpapillennekrosen bedingen eine Isosthenurie bis hin zum Nierenversagen. Ischämien von Knochen und Gelenken resultieren in aseptischen Nekrosen, chronischer Arthropathie und Anfälligkeit für Osteomyelitiden.
Das Hand-Fuß-Syndrom entsteht durch schmerzhafte Infarkte in den Fingern. Eine Infarzierung der venösen Ausstrombahn im Penis kann zum Priapismus mit bleibender Impotenz führen. Chronische Ulzerationen der Unterschenkel beruhen auf Ischämien der Haut, meist mit zusätzlicher Superinfektion. Ausdruck einer Sichelzellkrise der Lunge ist das akute Thoraxsyndrom mit Schmerzen, Tachypnoe, Fieber und Husten. Dabei begünstigt die verminderte arterielle Sauerstoffsättigung die Progression bis hin zur pulmonalen Hypertonie und zum Cor pulmonale. Schlaganfälle treten bereits bei Kindern auf. Chronische subakute Schäden des ZNS zeigen sich oft durch subtile Verhaltensänderungen.
Weiterhin führt die hämolytische Anämie neben den typischen Anämiesymptomen zu multiplen Komplikationen (z.B. Ikterus, Gallensteine).
Labordiagnostik
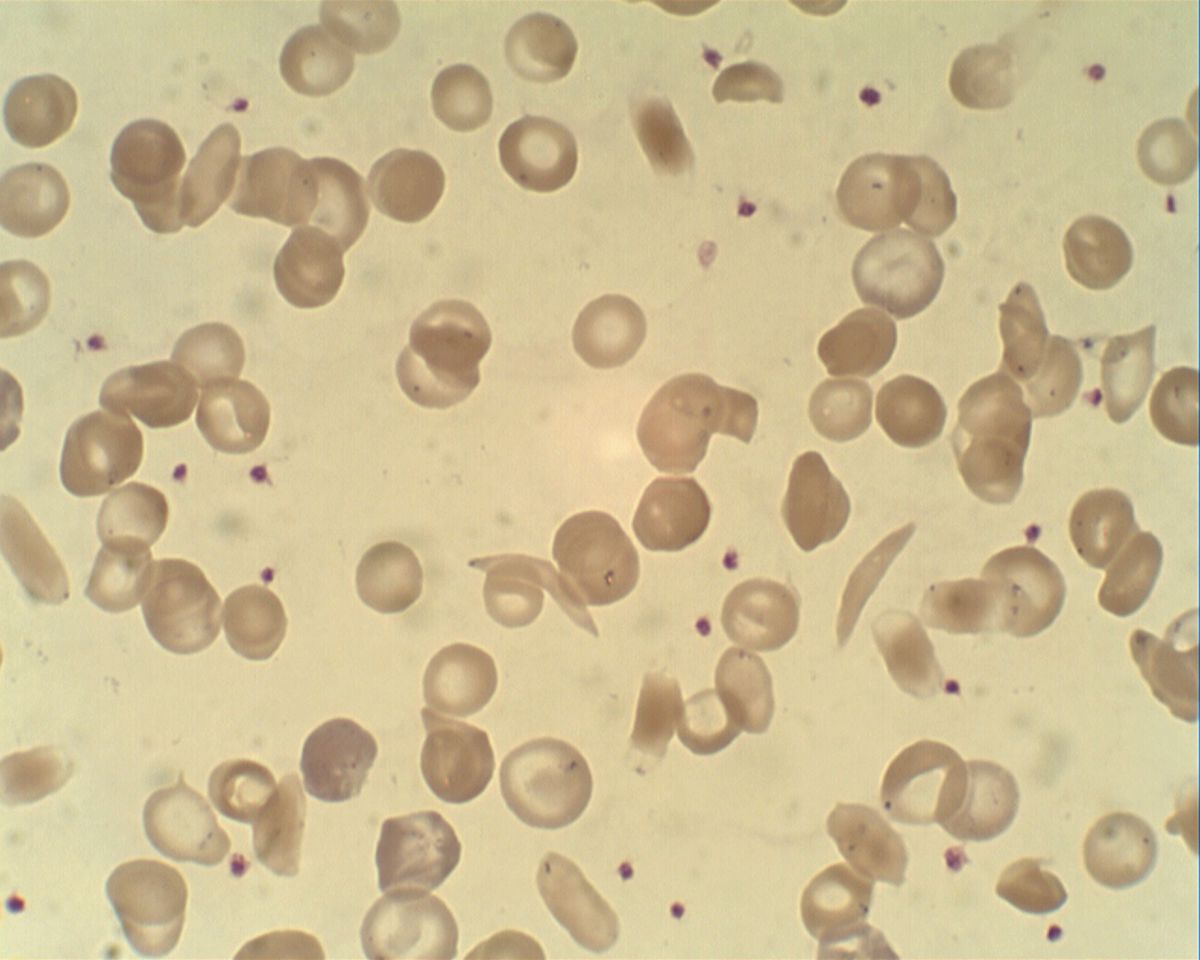
Infolge der hämolytischen Anämie sind Hämoglobin-Konzentration und Hämatokrit deutlich erniedrigt. Begleitend findet sich meist eine Retikulozytose und eine Granulozytose. Im Blutausstrich sind Sichelzellen erkennbar, gelegentlich auch Howell-Jolly-Körperchen als Zeichen einer gestörten Milzfunktion.
Der definitive Nachweis einer Sichelzellanämie erfolgt durch Hämoglobinelektrophorese, Massenspektrometrie und Sichelzelltest. Die molekulargenetische Untersuchung kann die Diagnose bestätigen. Auch eine Präimplantationsdiagnostik ist möglich.
Das Neugeborenenscreening auf Sichelzellanämie ist eine wichtige Untersuchung, die seit 2021 in Deutschland Teil der erweiterten Neugeborenen-Früherkennung ist. Durch eine Fersenblutprobe, die zwischen dem 3. und 5. Lebenstag entnommen wird, können betroffene Kinder frühzeitig erkannt werden, was ggf. lebensbedrohliche Komplikationen verhindert.
Therapie
Standardtherapie
Die therapeutischen Maßnahmen, die zurzeit (2024) bei Sichelzellanämie ergriffen werden, sind abhängig von der Schwere des Krankheitsverlaufs. Sie umfassen unter anderem:
- Symptomatische Therapie
- Medikamentöse Therapie
- Erythrozytentransfusionen
- Einmalige Transfusion
- Partielle Blutaustauschtransfusion, Erythrozytapherese
- Chronisches Transfusionsprogramm
- Chirurgische Therapie
- Splenektomie
- Cholezystektomie (bei Gallensteinen)
- Allogene Knochenmarkstransplantation von HLA-identischem Familienspender
In den USA ist seit November 2019 der gegen P-Selektin gerichtete monoklonale Antikörper Crizanlizumab zur Prävention einer vasookklusiven Krise zugelassen.
Gentherapie
Einen neuen Therapieansatz bietet das Gentherapeutikum Exagamglogen-Autotemcel. Bei diesem Verfahren werden autologe hämatopoetische Stammzellen des Patienten mithilfe des CRISPR/Cas-Systems genetisch so modifiziert, dass sie vermehrt fetales Hämoglobin (HbF) produzieren. Dadurch lässt sich die Symptomatik deutlich verbessern.
Der Arzneistoff wurde im Dezember 2023 vom CHMP der Europäischen Arzneimittelagentur (EMA) zur Zulassung empfohlen. Eine Zulassung durch die FDA erfolgte im gleichen Monat.[1]
Literatur
- Manger B et al.: Checkliste Rheumatologie. 4. Auflage, 2012. Thieme Verlag
- Schifferli J et al.: Internistische Notfälle: Sicher durch die Akutsituation und die nachfolgenden 48 Stunden. 8. Auflage, 2008. Thieme Verlag
- Ploier R: Differenzialdiagnosen in der Kinder- und Jugendmedizin. 1. Auflage, 2012. Thieme Verlag
Quelle
- ↑ Full Prescribing Information Casgevy, FDA. Abgerufen am 19.12.2023