Mogamulizumab
Handelsname: Poteligeo®
Synonym: KW-0761
Englisch: mogamulizumab
Definition
Mogamulizumab ist ein rekombinanter humanisierter Antikörper mit antineoplastischer Wirkung, der bei kutanen T-Zell-Lymphomen eingesetzt wird. Er gehört zur Gruppe der sogenannten Checkpoint-Inhibitoren.
Chemie
Mogamulizumab ist ein defucosyliertes, humanisiertes IgG1-Kappa-Immunglobulin. Es wird mittels DNA-Rekombinationstechik aus Ovarialzellen des Chinesischen Hamsters gewonnen (CHO-Zellen).
Wirkmechanismus
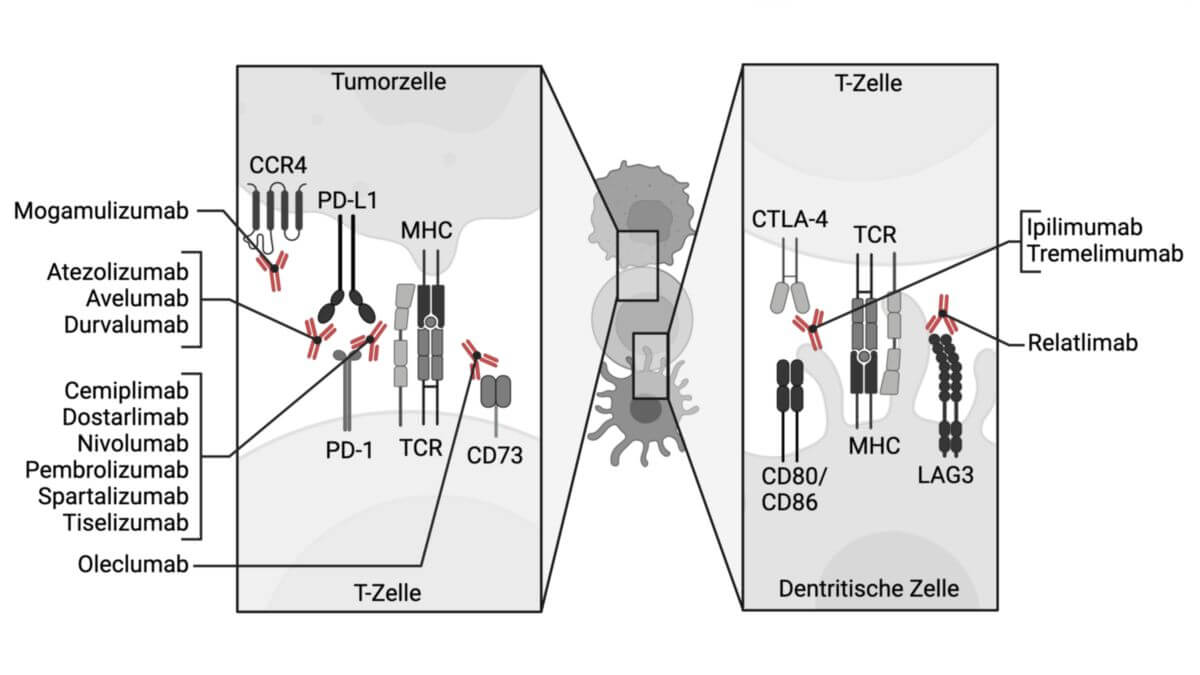
Mogamulizumab bindet selektiv an den G-Protein-gekoppelten Rezeptor CCR4, der an der Chemotaxis von Lymphozyten zu verschiedenen Organen beteiligt ist. CCR4 wird vermehrt auf der Oberfläche von einigen Krebszellen (z.B. bei T-Zell-Lymphomen) exprimiert. Die Bindung von Mogamulizumab an CCR4 löst auf der Oberfläche der T-Lymphozyten eine Antikörper-abhängige zelluläre Zytotoxizität (ADCC) aus, sodass die Population der entsprechenden T-Zellen verringert wird. Die ADCC wird durch NK-Zellen vermittelt.
Pharmakokinetik
Mogamulizumab ist nach intravenöser Gabe vollständig bioverfügbar und wird vermutlich wie endogenes IgG über katabole Wege in kleine Peptide und Aminosäuren abgebaut. Die Clearance beträgt ca. 12 ml/h, die Eliminationshalbwertszeit 17 Tage. Der Steady State wird bei empfohlenem Anwendungsschema nach 12 Wochen erreicht.
Indikation
- erwachsene Patienten mit Mycosis fungoides (MF) oder Sézary-Syndrom (SS), die mindestens eine vorherige systemische Therapie erhalten haben.
Die Anwendung bei anderen Malignomen (z.B. bei B-Zell-Lymphomen in Kombination mit Pembrolizumab) oder bei HTLV-1-assoziierter Myelopathie (HAM) wird im Rahmen von Studien untersucht.
Darreichungsform
Mogamulizumab ist als Konzentrat (4 mg/ml) zur Herstellung einer Infusionslösung verfügbar. Die Lösung muss im Kühlschrank bei 2 bis 8 °C im Umkarton gelagert werden.
Zur Herstellung der Infusionslösung wird Mogamulizumab in einen Infusionsbeutel mit 0,9%iger Natriumchloridlösung übertragen. Die Endkonzentration der Lösung sollte zwischen 0,1 und 3,0 mg/ml liegen.
Dosierung
Mogamulizumab wird in einer Dosis von 1 mg/kgKG als intravenöse Infusion über mindestens 60 Minuten verabreicht. Dabei erfolgt die Anwendung wöchentlich an den Tagen 1, 8, 15 und 22 des ersten 28-tägigen Zyklus. Anschließend werden die Infusionen alle 2 Wochen an den Tagen 1 und 15 jedes nachfolgenden 28-tägigen Zyklus gegeben.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Zu den Nebenwirkungen von Mogamulizumab zählen u.a.:
- Kopfschmerzen
- Ermüdung
- periphere Ödeme
- Obstipation, Diarrhö, Übelkeit, Erbrechen, Stomatitis
- Erhöhung von Aspartat-Aminotransferase, Alanin-Aminotransferase und Alkalische Phosphatase
- Anämie, Neutropenie, Leukopenie, Thrombopenie
- Hypothyreose
- Fieber
- akute Infusionsreaktionen bis hin zur anapyhalktischen Reaktion
- arzneimittelbezogene Hautreaktionen bis hin zu Stevens-Johnson-Syndrom (SJS) und toxischer epidermaler Nekrolyse (TEN)
- Tumorlysesyndrom: insbesondere im ersten Monat der Behandlung
Weiterhin besteht unter Therapie mit Mogamulizumab ein erhöhtes Risiko für Infektionen und/oder Virusreaktivierungen (z.B. Follikulitis, Zellulitis, Candidose, Pneumonie, Otitis externa, Herpes-zoster-Infektion). Vor Therapiebeginn sollte auf eine Hepatitis-B-Infektion getestet werden. Die Kombination von Mogamulizumab mit systemischen immunmodulierenden Arzneimitteln oder mit anderen für MF oder SS zugelassenen Therapien wird nicht empfohlen. Systemische Immunsuppressiva sollten ebenfalls vermieden werden. Topische oder niedrigdosierte systemische Glukokortikoide können jedoch verwendet werden.
Aufgrund der möglichen Nebenwirkungen wird vor der ersten Infusion eine Prämedikation mit einem Antipyretikum und einem Antihistaminikum empfohlen. Bei Auftreten einer Infusionsreaktion ist die Prämedikation auch bei nachfolgenden Infusionen indiziert.
Wechselwirkungen
Studien zur Erfassung von Wechselwirkungen wurden nicht durchgeführt.
Kontraindikationen
- Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile
Für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren sowie bei Patienten mit schwerer Leberfunktionsstörung liegen keine Daten vor.
Weiterhin fehlen Daten über die Anwendung von Mogamulizumab bei Schwangeren, sodass die Anwendung vermieden werden sollte. Bei klinischer Notwendigkeit kann Mogamulizumab in der Stillzeit eingesetzt werden. Weiterhin hat Mogamulizumab einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Studienlage
Mogamulizumab wurde im Rahmen einer randomisierten, multizentrischen Phase-3-Studie (MAVORIC-Studie) an 372 Patienten mit kutanen T-Zell-Lymphomen getestet. Dabei zeigte der Wirkstoff im Vergleich zu Vorinostat eine signifikante Verbesserung des progressionsfreien Überlebens (7,7 vs. 3,1 Monate) und der Lebensqualität.[1][2]
Zulassung
Die Zulassung seitens der EMA wurde am 22.11.2018 erteilt. In Deutschland ist der Wirkstoff seit dem 15. Juni 2020 verfügbar.
Inhaber der Zulassung ist Kyowa Kirin Holdings B.V.
Kosten
Der Preis von Mogamulizumab ist noch (2020) nicht bekannt. Gerechnet wird mit Jahrestherapiekosten von 50.000 bis 170.000 €.
Literatur
- Fachinformation Poteligeo®, abgerufen am 14.07.2020
- Ärztezeitung Poteligeo jetzt in Deutschland verfügbar
- DGHO e.V. NUB Antrag 2018/2019
Quellen
- ↑ Kim YH et al. Mogamulizumab versus vorinostat in previously treated cutaneous T-cell lymphoma (MAVORIC): an international, open-label, randomised, controlled phase 3 trial, Lancet Oncol. 2018;19(9):1192-1204, abgerufen am 14.07.2020
- ↑ clinicaltrials.gov Study of KW-0761 Versus Vorinostat in Relapsed/Refractory CTCL, abgerufen am 14.07.2020