G-Protein-gekoppelter Rezeptor
Abkürzung: GPCR
Englisch: G protein-coupled receptor
Definition
G-Protein-gekoppelte Rezeptoren, kurz GPCR, sind eine Klasse von Rezeptoren, die über G-Proteine (GTP-bindende Proteine) eine zelluläre Signalkaskade auslösen. Die G-Protein-gekoppelten Rezeptoren formieren mit mehr als 1.000 verschiedenen Mitgliedern die größte Proteinsuperfamilie.
Struktur
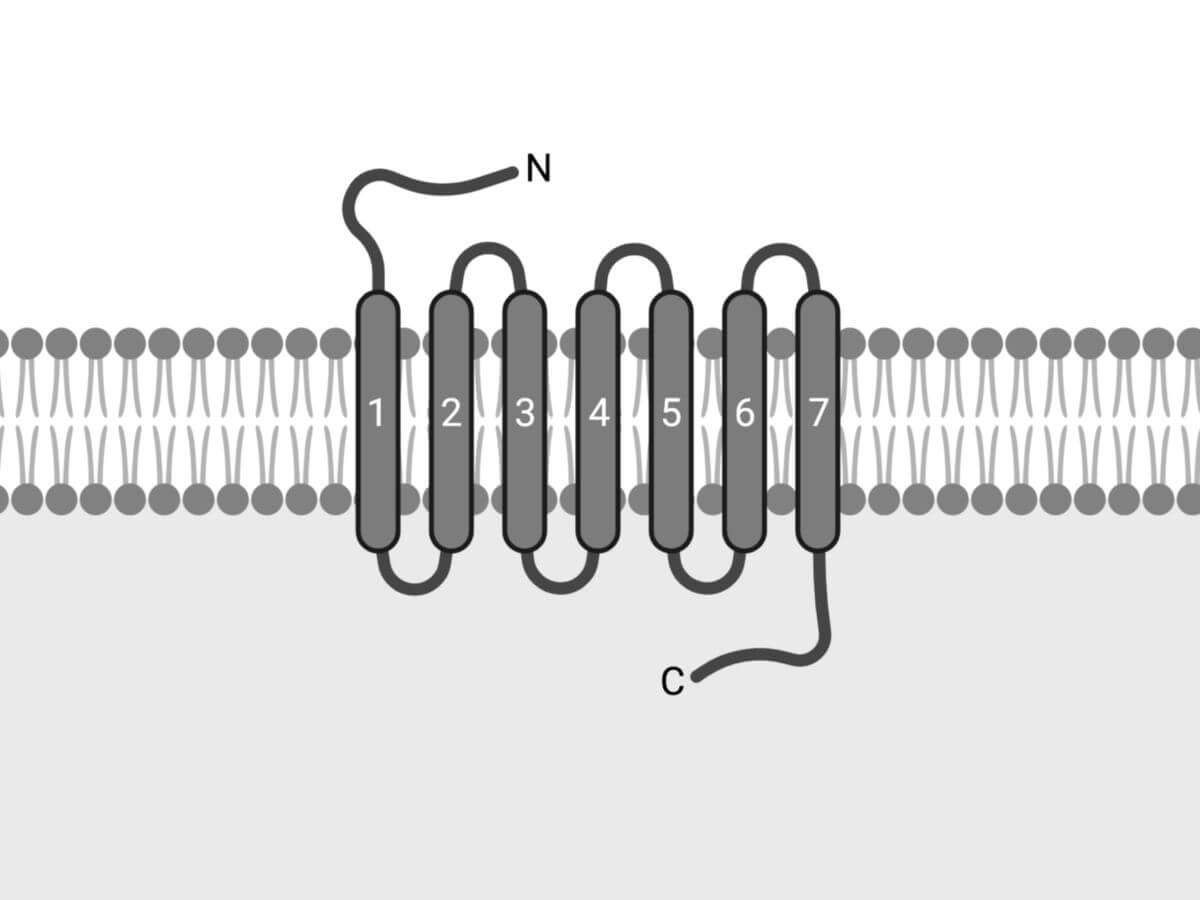
Charakteristisch für G-Protein-gekoppelte Rezeptoren sind die stets vorhandenen sieben Transmembrandomänen. Eine Transmembrandomäne besteht aus ca. 20 Aminosäuren, die jeweils zu einer α-Helix angeordnet sind. Daher werden GPCR auch weitgehend synonym als heptahelikale Rezeptoren bezeichnet. Der N-Terminus des Proteins liegt an der extrazellulären Seite, der C-Terminus intrazellulär.
Einteilung
Basierend auf ihrer Sequenzhomologie und funktioneller Ähnlichkeit werden die G-Protein-gekoppelten Rezeptoren in 6 Klassen eingeteilt:
- Klasse A (1): Rhodopsin-ähnliche Rezeptoren
- Klasse B (2): Sekretinrezeptor-Familie
- Klasse C (3): Metabotrope Glutamate/Pheromone
- Klasse D (4): Fungal-mating-Pheromonrezeptoren
- Klasse E (5): Zyklische AMP-Rezeptoren (cAMP)
- Klasse F (6): Frizzled/Smoothened (Wnt-Signalweg)
Alternativ können G-Protein-gekoppelte Rezeptoren über die Eigenschaften des gebundenen G-Proteins klassifiziert werden in:
| G-Protein | Signalkaskade |
|---|---|
| Gs | Gs-gekoppelte-Rezeptoren lösen über Aktivierung einer Adenylatzyklase eine stimulierende Kaskade aus. |
| Gi | Gi-gekoppelte-Rezeptoren lösen über Hemmung einer Adenylatzyklase eine inhibierende Kaskade aus. |
| Gq | Gq-gekoppelte-Rezeptoren aktivieren über den Second Messenger Pathway (Phospholipase C vermittelt) via IP3 und DAG die Proteinkinase C. |
| Gt | Gt-gekoppelte-Rezeptoren sind v.a. in Photorezeptoren relevant. Hier führt eine licht-abhängige Reaktion des Rezeptors über das assoziierten G-Protein, das Transducin genannt wird, zur Aktivierung der cGMP-abhängigen Phosphodiesterase. |
| Golf | Golf-gekoppelte-Rezeptoren sind in den Sinneszellen der Riechschleimhaut zu finden und dienen dem olfaktorischen Signalweg. |
| Ggust | Ggust-gekoppelte-Rezeptoren sind in die Signalwege der Geschmacksqualitäten süß, umami und bitter involviert. |
Beispiele
Glucagonrezeptor
Ein Beispiel für einen G-Protein-gekoppelten Rezeptor ist der Glukagon-Rezeptor. Der Glukagonrezeptor ist ein membranständiges 62 kDa Protein, das sein Signal über G-Proteine und den Effektor Adenylatzyklase übermittelt.
Bindet das Hormon Glukagon an den Rezeptor, wird am G-Protein der Austausch von GDP zu GTP gefördert. Dabei findet jedoch keine Phosphorylierung von GDP statt. GDP wird lediglich gegen GTP ausgetauscht. Nachdem GTP an das G-Protein gebunden hat, spaltet es sich in die aktive α-Untereinheit und die inaktive β/γ-Untereinheit.
Die α-Untereinheit wandert in Richtung Adenylatzyklase und aktiviert sie. Diese fördert nun die Umlagerung von ATP zu cAMP, dem sog. "Hungersignal" der Zelle. cAMP führt jetzt die Signalkaskade fort und aktiviert verschiedene Kinasen wie z.B. die Proteinkinase A (PK-A), welche wiederum andere Enzyme des Zellstoffwechsels phosphoryliert und diesen so reguliert.
Kontraktion der glatten Muskulatur
Regulation am Myosin
Die Aktivierung der Phospholipase C über die alpha-Untereinheit des G-Proteins, die über einen Lipidschwanz an die zytosolische Seite der Plasmamembran verankert ist, führt zur Bildung des second messengers IP3 (Inositol-1,4,5-triphosphat) und DAG (Diacylglycerin) aus dem Phospholipid PIP2 (Phosphatidylinositol-4,5-bisphosphat). IP3 induziert die intrazelluläre Ausschüttung von Ca2+. Ca2+ bindet nun an das Calmodulin der glatten Muskelzelle und führt zu deren Konformations- und Aktivitätsänderung. Der entstandene Ca2+-Calmodulin-Komplex stößt in weiterer Folge die Aktivität der Myosin-leicht-Ketten-Kinase (MLCK) an, welche dann die Phosphorylierung der regulatorischen leichten Kette des Myosins katalysiert. Auf diese Weise kommt es über die IP3-Signaltransduktion zur Aktivierung des Myosins der glatten Muskelzelle.
Regulation am Aktin
Der Ca2+-Calmodulin-Komplex führt gleichzeitig auch zur Aktivierung von Caldesmon, das sich in weiterer Folge vom Aktin-Tropomyosin-Komplex löst. Dadurch wird die Myosinbindungsstelle am Aktin freigelegt und die Kontraktion der Muskelzelle eingeleitet.
Muskarinischer Acetylcholinrezeptor
Ein weiteres Beispiel für einen G-Protein-gekoppelten-Rezeptor ist der muskarinische Acetylcholinrezeptor der Herzmuskelzellen (M2-Rezeptor). Acetylcholin wird bei einer Aktivierung des Parasympathikus ausgeschüttet, der eine Verlangsamung des Herzschlags verursacht. Acetylcholin bindet an den G-Protein-gekoppelten-Rezeptor und führt durch dessen herbeigeführte Konformationsänderung zu einer Aktivierung des beta-gamma-Komplexes des Gi-Proteins. Dieser Komplex öffnet die Kaliumkanäle und K+-Ionen strömen in den extrazellulären Raum ein.
Weitere Beispiele
Klinische Bedeutung
Die Wirkung einer großen Zahl von Medikamenten beruht auf der Interaktion mit G-Protein-gekoppelten Rezeptoren. Hierzu zählen zum Beispiel die Betablocker und eine Subgruppe der Thrombozytenaggregationshemmer.
Autoantikörper gegen G-Protein-gekoppelte Rezeptoren können verschiedene Krankheitsbilder verursachen, zum Beispiel dilatative Kardiomyopathien.
Literatur
- G Protein-Coupled Receptors, British Journal of Pharmacology, 2011
- Becker et al., Cardiomyopathy - An approach to the autoimmune background, Autoimmun Rev, 2017