Wnt-Signalweg
Englisch: Wnt signaling pathway
Definition
Der Wnt-Signalweg ist wichtig für viele Vorgänge bei der Embryonalentwicklung (Embryogenese), wie zum Beispiel der Ausbildung der Körperachse (Primitivstreifen) und der Bildung von Organanlagen. In adulten Zellen hingegen ist er zumeist inaktiv, in Tumorzellen kann er aber wieder aktiviert vorliegen.
Hintergrund
Benannt ist dieser Signalweg nach seinem Liganden, dem Wachstumsfaktor Wnt. Das "W" stammt aus "Wg", welches für wingless (englisch - flügellos) steht – der Wachstumsfaktor der Wnt-Familie, der als erster entdeckt wurde. Ist das Wg-Gen mutiert, entsteht bei der Drosophila melanogaster eine flügellose Variante. Das "nt" stammt von dem Int-Gen, das bei der Maus die Entwicklung von Brustkrebs triggert, wenn es aktiviert ist. Insgesamt wurden inzwischen 19 verschiedene Wnt-Gene identifiziert.
Ablauf
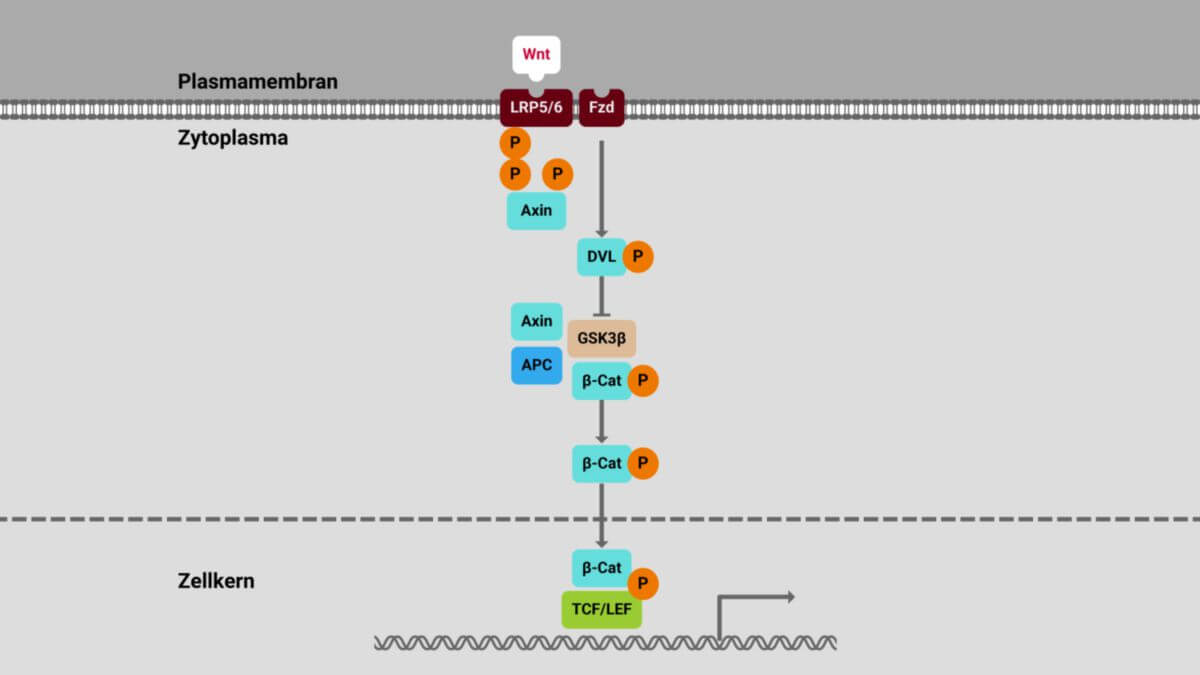
In Zellen, in denen der Wnt-Signalweg inaktiv ist, liegt beta-Catenin in einem Komplex gebunden vor, der dazu führt, dass beta-Catenin ständig abgebaut wird. Auf diese Weise wird beta-Catenin daran gehindert, die Transkription bestimmter Gene zu aktivieren.
Dieser Komplex, auch als "destruction-Komplex" bezeichnet, besteht aus verschiedenen Proteinen, zu den wichtigsten gehören Axin, die Kinase GSK3B und das Tumorsuppressor-Protein APC. Wenn beta-Catenin in diesem Komplex vorliegt, kann es von beta-TrCP gebunden und ubiquitiniert werden. Diese Ubiquitinierung führt dazu, dass beta-Catenin im Proteasom abgebaut wird.
Bindet aber Wnt an seinen Rezeptor "Frizzled" und den Co-Rezeptor "LRP" (Low-density lipoprotein receptor-related protein), wird das Protein "DVL" (Dishevelled) aktiviert, welches den destructions-Komplex inhibiert. Beta-Catenin wird freigesetzt und kann nicht mehr abgebaut werden. Es akkumuliert und gelangt auch in den Zellkern. Dort bindet es mit anderen Proteinen zusammen an Transkriptionsfaktoren, die auf diese Weise aktiviert werden. Dies resultiert in der Transkription verschiedener Gene, z.B. Cyclin D1 und MYC, welche die Zellproliferation regulieren.
Kremen-Proteine und Dickkopf-Proteine bilden einen Komplex mit dem Co-Rezeptor LRP6 und führen zu einer Endozytose und Entfernung des Rezeptors von der Zelloberfläche. Dadurch inaktivieren sie den Wnt-Signalweg.[1]
Mutationen
Der Wnt-Signalweg in der Tumorzelle
In Tumorzellen kann dieser Signalweg auch ohne den Liganden Wnt aktiviert werden. Dies geschieht zum Beispiel durch die Loss-of-Function-Mutation eines Proteins des destructions-Komplexes. Bei dem durch die Erbkrankheit FAP (Familiäre adenomatöse Polyposis) ausgelösten Kolonkarzinom ist der Tumorsuppressor APC betroffen. Auf diese Weise kann der Komplex nicht mehr gebildet und beta-Catenin nicht mehr abgebaut werden. Die beta-Catenin-abhängigen Gene werden nicht mehr stimulusabhängig, sondern konstitutiv transkribiert. Weil diese Gene u.a. eine wichtige Rolle bei der Regulation des Zellzyklus spielen und proliferationsfördernd wirken, kann eine solche Mutation zu der Entstehung von Krebs beitragen.
Weitere Krankheiten
Defekte im Wnt-Signalweg können auch mit vielen weiteren Krankheiten in Verbindung gebracht werden, wie Knochenkrankheiten, Nierenschäden, Lungenfibrose oder Schizophrenie.
Hemmung
Die Hemmung des Wnt-Signalwegs ist ein wichtiger biochemischer Mechanismus der Morphogenese des Embryos. Sie wird zum Beispiel durch Dkk1 ausgelöst.
Quellen
- ↑ Mao B, Wu W, Davidson G, Marhold J, Li M, Mechler BM, Delius H, Hoppe D, Stannek P, Walter C, Glinka A, Niehrs C. Kremen proteins are Dickkopf receptors that regulate Wnt/beta-catenin signalling. Nature. 2002 Jun 6;417(6889):664-7. doi: 10.1038/nature756. Epub 2002 May 26. PMID: 12050670.