Mammakarzinom
Synonym: Brustkrebs
Englisch: breast cancer, carcinoma of the breast
Definition
Das Mammakarzinom ist ein maligner Tumor, der von Zellen der Brustdrüse ausgeht. Es ist die häufigste Krebserkrankung bei Frauen.
- ICD10-Code: C50.-
Epidemiologie
Die Inzidenz des Mammakarzinoms liegt bei ca. 150 Neuerkrankungen pro 100.000 Frauen. Pro Jahr werden in Deutschland 57.000 Neuerkrankungen festgestellt. Statistisch betrachtet erkrankt jede 8. Frau im Laufe ihres Lebens an Brustkrebs. Mammakarzinome sind am häufigsten zwischen der 6. und 7. Lebensdekade, vor dem 35. Lebensjahr kommen sie selten vor.
Auch Männer können an einem Mammakarzinom erkranken, die Erkrankung tritt bei ihnen aber deutlich seltener auf als bei Frauen. Das M/W-Verhältnis beträgt bei den Neuerkrankungen etwa 1:100. In Deutschland sind etwas mehr als 700 Männer pro Jahr betroffen.[1]
Risikofaktoren
Die Risikofaktoren für die Entstehung von Brustkrebs sind derzeit (2023) noch nicht vollständig geklärt. Es gibt jedoch eine Reihe von Faktoren, die bezüglich ihrer Mitwirkung bei der Entstehung von Brustkrebs gut erforscht sind.
Das Alter ist ein entscheidender Risikofaktor. Ab dem 30. Lebensjahr steigt das Risiko, ein Mammakarzinom zu entwickeln, stetig an. Frauen, bei denen die Menarche vor dem 12. Lebensjahr oder die Menopause nach dem 55. Lebensjahr auftritt, haben ebenfalls ein erhöhtes Risiko. Frauen, die vor ihrem 20. Lebensjahr gebären, haben gegenüber später gebärenden oder nicht gebärenden Frauen ein erniedrigtes Brustkrebsrisiko.
Alarmzeichen im Sinne eines erhöhten Risikos sollten sein:
- vorheriges Mammakarzinom der kontralateralen Brust
- vorheriges Carcinoma in situ
- Brustkrebs bei Verwandten ersten Grades vor dem 40. Lebensjahr
Genetische Faktoren
Nur 5 bis 10 % der Mammakarzinome sind erblich bedingt. Bei etwa der Hälfte der an erblichen Formen des Mammakarzinoms erkrankten Frauen lassen sich Mutationen im BRCA1-Gen (Chromosom 17) nachweisen. Bei einem weiteren Drittel der Fälle sind Mutationen im BRCA2-Gen (Chromosom 13) nachweisbar. Die Proteine BRCA1 und 2 sind, zusammen mit Rad51, an der DNA-Reparatur beteiligt. Sie sind durch vielfältige Genmutationen oder Fehler bei der Expression und Regulation betroffen, was zum Ausfall der Reparatur von DNA-Schäden führt.
Frauen, die Mutationen in diesen Genen tragen, entwickeln bis zum 80. Lebensjahr in ca. 70 % d.F. ein Mammakarzinom. Welche Rolle die beiden Gene bei der Entstehung der häufigeren sporadischen Mammakarzinome spielen, ist gegenwärtig nicht klar. Angenommen wird, dass die Gene beispielsweise durch Methylierung von regulatorischen Abschnitten inaktiviert werden und so ihre Wirkung als Tumorsuppressorgen verlieren.
Neben BRCA1 und BRCA2 gibt es weitere, seltene Gene, deren Mutation (Protein-truncating variants) mit einem signifikant erhöhten Mammakarzinomrisiko einhergeht. Sie kodieren für:[2]
- Serin-Proteinkinase ATM (ATM)
- Checkpoint-Kinase 2 (CHEK2)
- Partner and Localizer of BRCA2 (PALB2)
- TP53
- RAD51C
- RAD51D
- BARD1
- PTEN
Sowohl bei den sporadischen als auch bei den familiären Formen scheinen weitere genetische Faktoren (Ras, RB1, p53 und die Protoonkogene MYC und ERRB) an der Entstehung beteiligt zu sein.
Familiäres Mammakarzinom
Personen, die folgende Kriterien erfüllen, sollte eine genetische Beratung und Untersuchung angeboten werden, da die Wahrscheinlichkeit für den Nachweis einer ursächlichen Genmutation bei über 10 % liegt:[3]
Wenn in einer Linie der Familie
- mindestens 3 Frauen an einem Mammakarzinom erkrankt sind,
- mindestens 2 Frauen an einem Mammakarzinom erkrankt sind, davon 1 vor dem 51. Geburtstag,
- mindestens 1 Frau an Mammakarzinom und 1 Frau an Ovarialkarzinom erkrankt sind,
- mindestens 2 Frauen an einem Ovarialkarzinom erkrankt sind,
- mindestens 1 Frau an Mamma- und Ovarialkarzinom erkrankt ist,
- mindestens 1 Frau vor dem 36. Geburtstag an Mammakarzinom erkrankt ist,
- mindestens 1 Frau an bilateralem Mammakarzinom vor dem 51. Geburtstag erkrankt ist,
- mindestens 1 Mann an Mammakarzinom und 1 Frau an Brust- oder Ovarialkarzinom erkrankt sind,
- 1 Frau an triple-negativem Mammakarzinom (TNBC) vor dem 50. Geburtstag erkrankt ist, oder
- 1 Frau an Ovarialkarzinom vor dem 80. Geburtstag erkrankt ist.
Geographische Faktoren
Das Risiko an Brustkrebs zu erkranken ist bei der weißen Bevölkerung Nordamerikas und Nordeuropas im Vergleich zu Japanerinnen und Bewohnerinnen mediterraner Länder deutlich gesteigert. Allerdings haben Untersuchungen aufgezeigt, dass beispielsweise in die USA migrierte Asiatinnen ihr Risiko angleichen. Daher werden Umwelteinflüsse (z.B. Ernährung, Anzahl und Zeitpunkte von Schwangerschaften) als Ursache für die geographischen Differenzen angenommen.
Östrogen
Die postmenopausale Therapie mit Östrogenen (z.B. zur Verhinderung einer Osteoporose) geht mit einem leicht erhöhten Brustkrebsrisiko einher.
Die Einnahme oraler Kontrazeptiva bringt ebenfalls eine leichte Erhöhung des Brustkrebsrisikos mit sich. Jedoch ist bei Verwendung moderner Präparate 10 Jahre nach Absetzen kein erhöhtes Risiko mehr festzustellen.
Fest steht jedoch, dass die Brustdrüsen unter dem Einfluss von Östrogenen zyklischen proliferativen Veränderungen unterworfen sind und ein Überschuss an Östrogenen sowie starke Schwankungen des Hormonspiegels einen verstärkten Proliferationsreiz darstellen.
Bei einem Teil der Mammakarzinome ist eine erhöhte Dichte an Östrogenrezeptoren festzustellen. Diese Unterscheidung hat direkte therapeutische Konsequenzen.
Ionisierende Strahlen
Ionisierende Strahlen wirken mutagen. Dabei ist die verabreichte Strahlendosis und der Zeitpunkt der Bestrahlung entscheidend. Beispielsweise erkranken ein Viertel der Patientinnen, die während der Thelarche oder bis zum 30. Lebensjahr wegen eines Hodgkin-Lymphoms bestrahlt wurden, später an einem Mammakarzinom. Bestrahlungen bei älteren Frauen steigern das Brustkrebsrisiko hingegen nicht.
Die zum Screening eingesetzte Mammographie könnte durch die eingesetzten Röntgenstrahlen prinzipiell auch das Brustkrebsrisiko steigern – die geringe Strahlendosis und der große Nutzen einer möglichen Früherkennung wiegen diese theoretische Möglichkeit jedoch bei weitem auf.
Weitere Risikofaktoren
Als weitere Risikofaktoren des Mammakarzinoms werden Adipositas, Alkoholabusus, eine fettreiche Ernährung und der Nikotinabusus diskutiert. Jedoch ist die Evidenzlage in diesen Punkten widersprüchlich.
Histopathologie
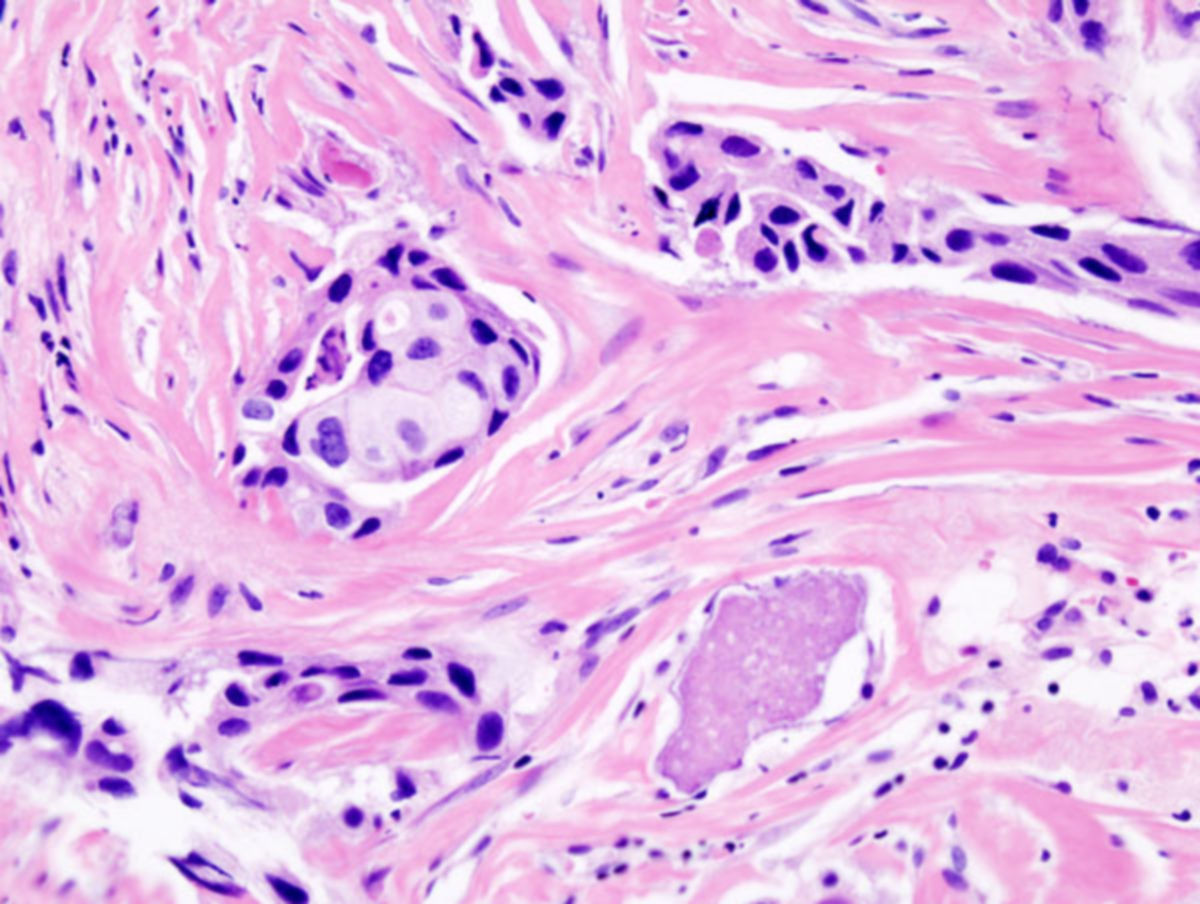
Histologisch sind fast alle Mammakarzinome Adenokarzinome, die sich vom Epithel der terminalen duktulolobulären Einheit (TDLE) ableiten.
Einteilung
...nach Histologie
Mammakarzinome werden in Abhängigkeit von ihrer Wachstumstiefe in invasive und nicht-invasive Karzinome (Carcinoma in situ) eingeteilt. Die verschiedenen Arten unterscheiden sich dabei stark in ihrer Häufigkeit.[4][5] Je nach histologischer Differenzierung und Wachstumsmuster unterscheidet man darüber hinaus zwischen duktalen (Tumorgewebe ähnelt dem Milchgangsepithel) und lobulären Karzinomen (Tumorgewebe ähnelt den Drüsenläppchen). Da die Tumoren oft histologisch heterogen sind, wird die Erfordernis mehrerer Biopsien zur repräsentativen Darstellung des gesamten Tumors diskutiert.[6]
Nicht-invasive Mammakarzinome
- Duktales Carcinoma in situ (DCIS) (90 % aller nicht-invasiven Mammakarzinome)
- Lobuläres Carcinoma in situ (LCIS) (5 %)
Invasive Mammakarzinome
- invasives Mammakarzinom ohne speziellen Typ (früher: invasives-duktales Karzinom nicht anders spezifiziert) (75 % aller invasiven Mammakarzinome)
- invasive Mammakarzinome mit speziellem Typ (25 %)
- andere
...nach klinischem Stadium
- Früher Brustkrebs (Early Breast Cancer, EBC)
- Metastasierter Brustkrebs (Metastatic Breast Cancer, MBC)
Klinik
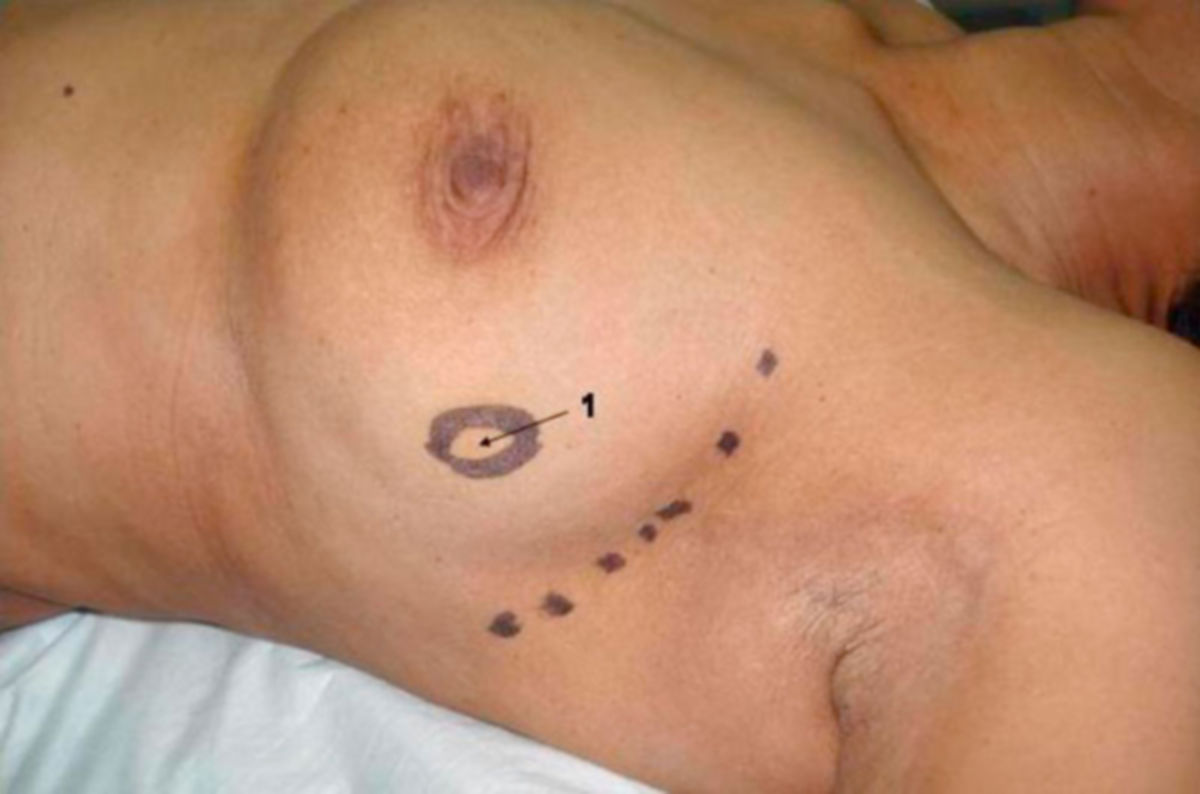
Das Tumorwachstum führt zu charakteristischen Veränderungen der betroffenen Brust, die den Untersuchenden hellhörig machen sollten. Ein palpabler, unscharf begrenzter Knoten in der Brust ist das bekannteste Zeichen des Mammakarzinoms. Mammakarzinome haben im Gegensatz zu benignen Veränderungen (Fibroadenom, Zysten) die Tendenz mit der Unterlage zu verwachsen, sodass der Knoten unverschieblich fixiert erscheint.
Bei retromamillären Formen kommt es zur Retraktion der Mamille und Einziehung der Haut über dem betroffenen Areal. Die Ausbildung einer sogenannten Zirkularfurche um die Mamille herum und eine orangenhautartige Beschaffenheit der Haut über dem Tumorareal werden ebenfalls regelmäßig beobachtet. Eine besondere Form des Mammakarzinoms, das sogenannte inflammatorische Mammakarzinom, ist rein morphologisch schwer von einer Mastitis zu unterscheiden.
Bei malignen Veränderungen der Brust kann über der Resistenz eine plateauartige Einziehung der Haut auftreten (Plateauphänomen). Diese kann durch eine Kompression der Haut über dem tastbaren Knoten dargestellt werden (Jackson-Test).
Fortgeschrittene Stadien eines Mammakarzinoms führen zur Ausbildung von Ulzerationen der Haut. Man spricht in einem solchen Fall von einem exulzerierten Mammakarzinom.
Befallsmuster
Bei 4 % der Patientinnen sind bei der Diagnosestellung beide Brüste betroffen.
50 % der Mammakarzinome sind im äußeren oberen Quadranten der Brustdrüse lokalisiert. 20 % sind an und um die Mamille herum lokalisiert. Je 10 % betreffen die restlichen drei Quadranten. Bei Vorliegen mehrerer Herde in einem Quadranten spricht man von einem multifokalen Befall, bei Befall mehrerer Quadranten der gleichen Brust von einem multizentrischen Befall.
Metastasierung
Mammakarzinome metastasieren lymphogen und hämatogen. Die Wahrscheinlichkeit der Metastasierung steigt mit dem Volumen des Tumors. Die außen oben und mamillär lokalisierten Karzinome metastasieren bevorzugt in die axillären Lymphknoten. In den inneren Quadranten lokalisierte Mammakarzinome metastasieren häufiger in die Lymphknotenstationen entlang der Arteria thoracica interna.
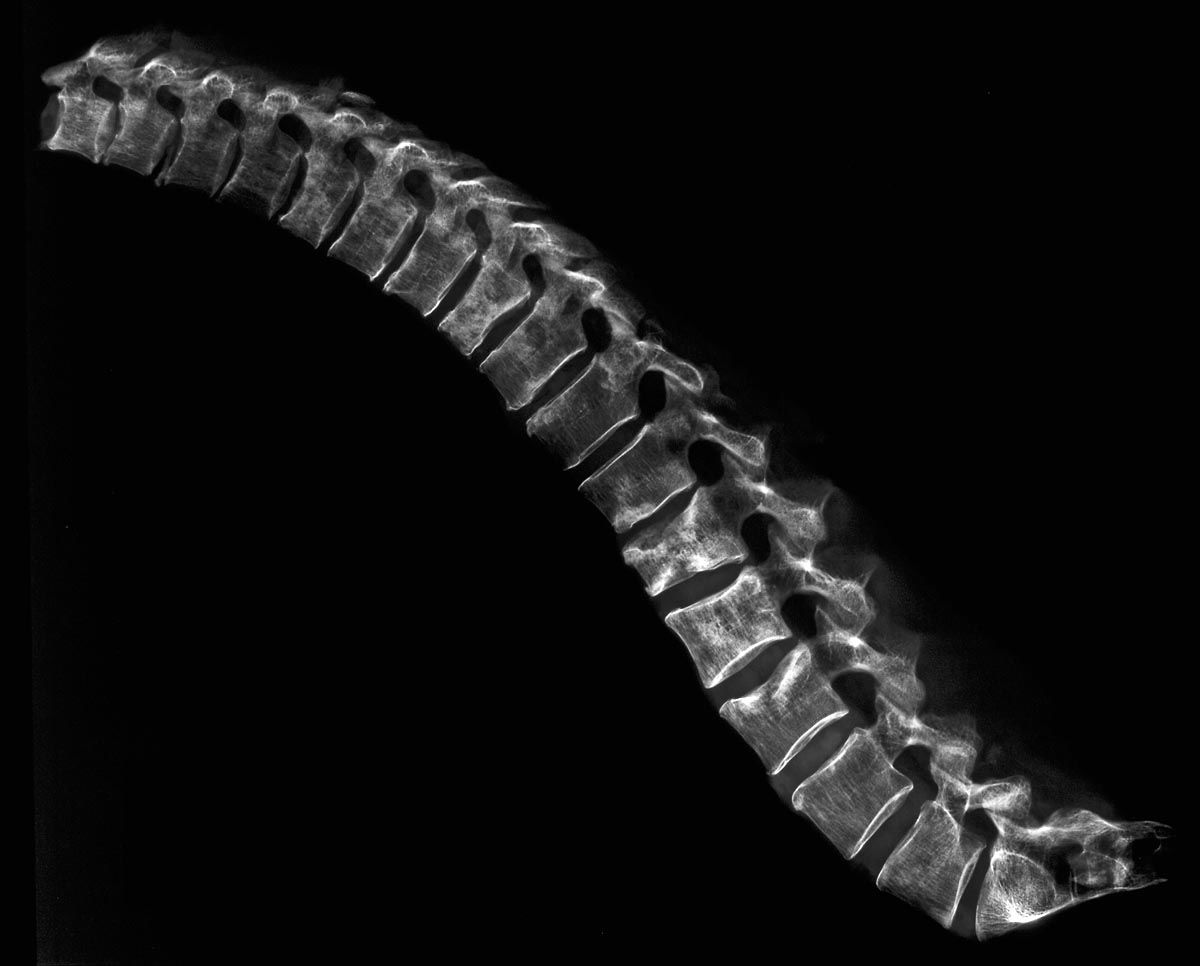
Durch die hämatogene Streuung kann prinzipiell jedes Organ von einer Metastasierung betroffen sein. Am häufigsten finden sich Knochenmetastasen, gefolgt von Leber- und Lungenmetastasen. Seltener sind Hirnmetastasen.
Fortgeschrittene Mammakarzinome können auch regionär in die benachbarte Haut metastasieren, was im Extremfall das Bild eines Cancer en cuirasse erzeugt.
Das individuelle Metastasierungsrisiko hängt wahrscheinlich auch von genetischen Faktoren ab. Bei Patientinnen mit homozygoten Mutationen des PCSK9-Gens (rs562556, V474I) ist das Risiko für Fernmetastasen erhöht.[7]
Diagnostik
Zur Diagnosesicherung des Mammakarzinoms gehören neben der körperlichen Untersuchung und Anamnese auch apparative und laborchemische Untersuchungen. Die körperliche Untersuchung muss stets im Seitenvergleich durchgeführt werden und beinhaltet:
- Inspektion (Einziehungen der Haut, Ulzerationen oder Ekzeme)
- Palpation der Mamma sowie der Lymphknotenstationen (Verschieblichkeit, Lymphadenopathien)
- Neurologische Untersuchung der Arme (Infiltration des Plexus brachialis)
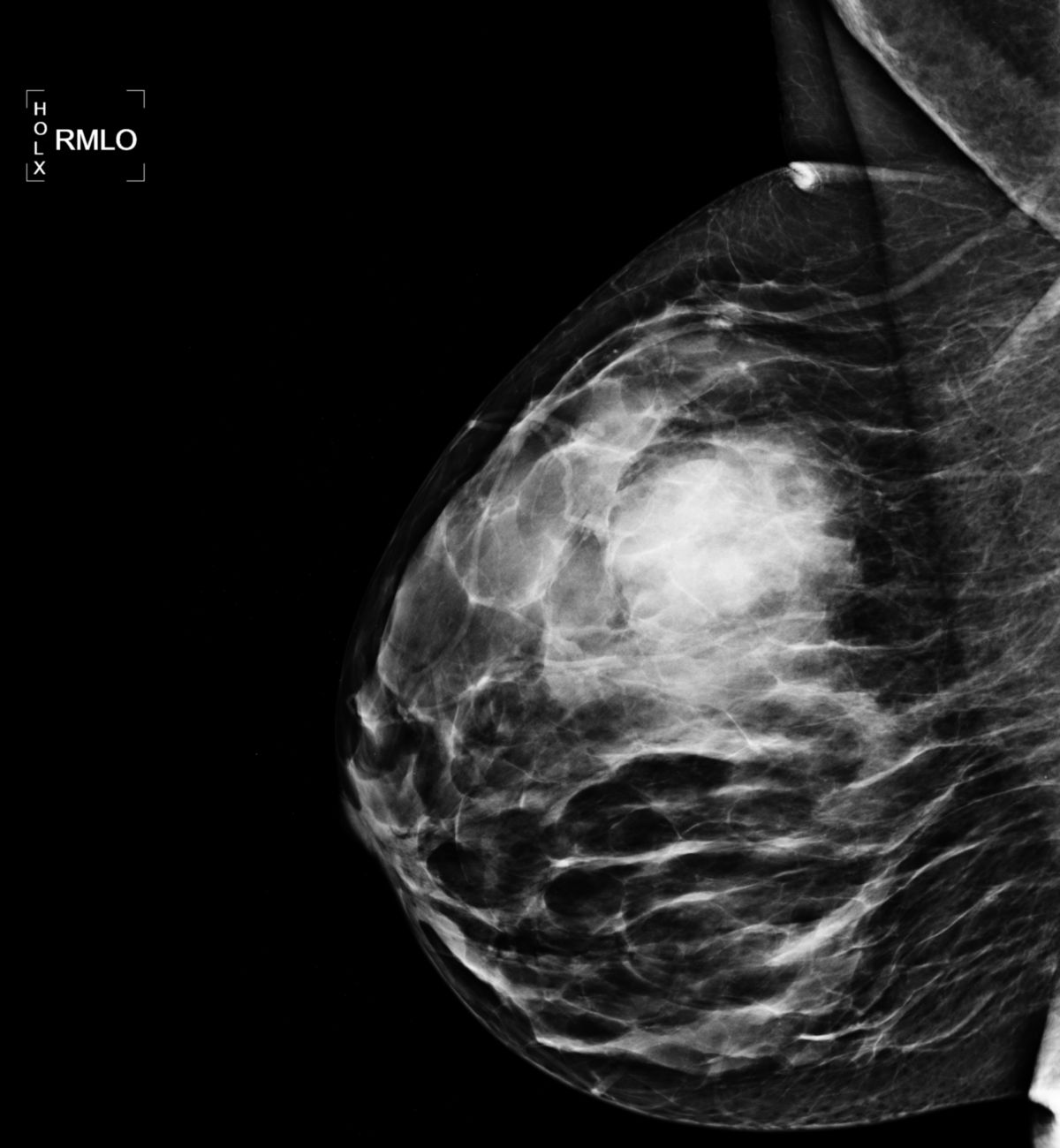
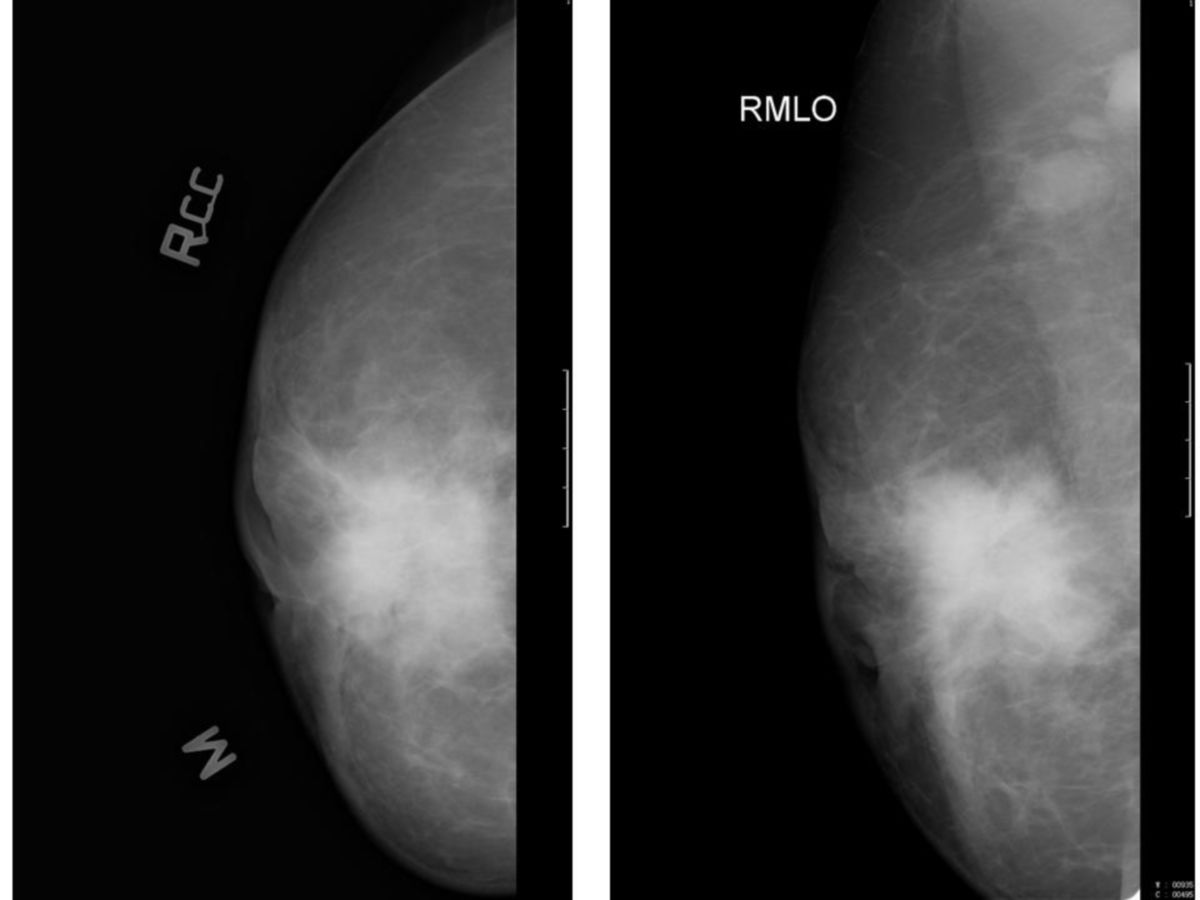
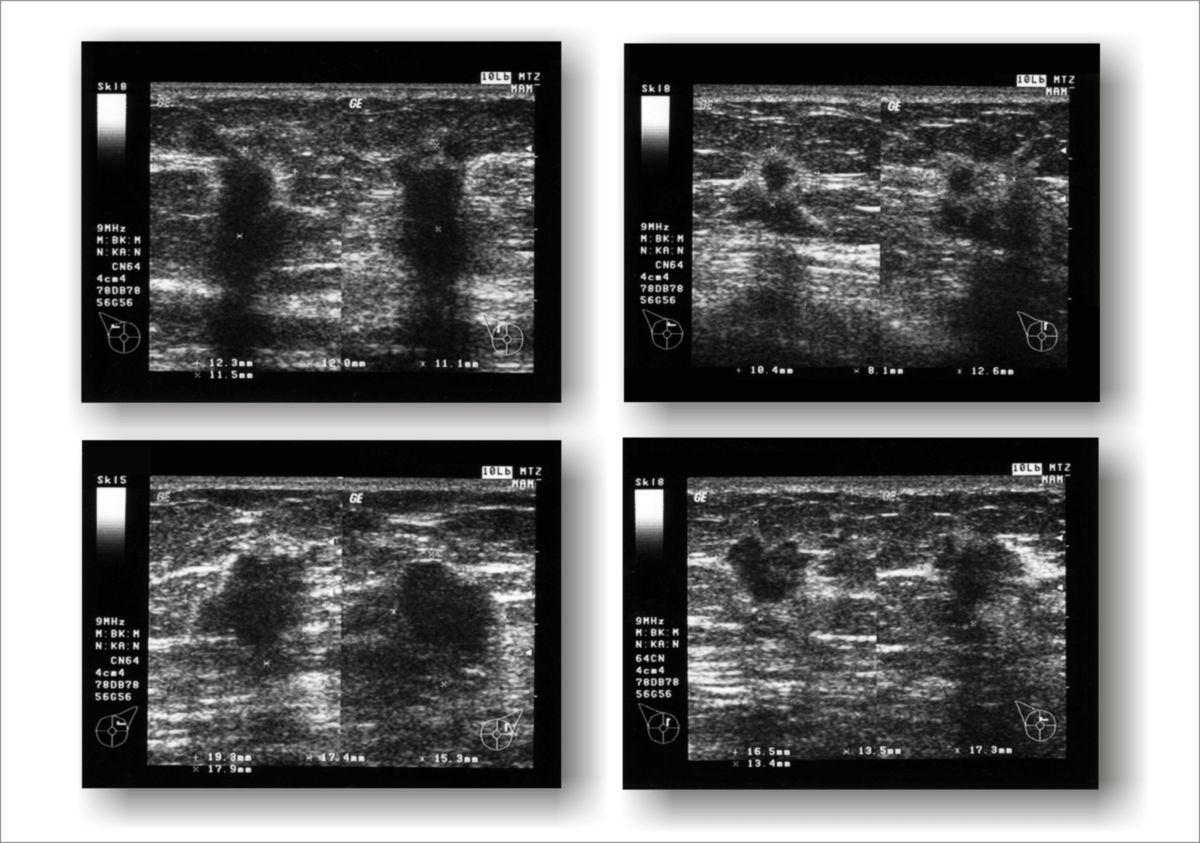
Bildgebung
Die Diagnostik wird apparativ ergänzt durch:
- Mammographie, ggf. Galaktographie
- Mammasonographie, ggf. Elastosonographie
- Mamma-MRT
Pathohistologie
Die endgültige Diagnosesicherung erfolgt durch eine Biopsie (Stanzbiopsie bzw. offene Probeexzision) mit anschließender histologischer Begutachtung. Hier kann außer dem Grading auch die Expression von Progesteron- (PR) und Östrogenrezeptoren (ER) sowie HER2/neu (c-erb-B2) bestimmt werden. Lassen sich PRs und/oder ERs nachweisen, liegt ein Hormonrezeptor-positives Mammakarzinom vor (HR+). Bei einer hohen Rate von PR und ER spricht man von Luminal-A-Tumoren. Diese haben eine niedrige Zellteilungsrate und machen den größten Anteil an Mammakarzinomen aus. Am zweithäufigsten treten Tumore vom Luminal-B-Typ auf, die eine hohe Zellteilungsrate und meist nur wenig bis keine PR aufweisen. Ist bei keinem der drei Rezeptorarten eine therapierelevante Ausprägung nachzuweisen, spricht man von triple-negativen Mammakazinomen.
Tumorgenomik
Neben der Pathohistologie spielt auch die Tumorgenomik mit Analyse der Tumor-DNA eine immer wichtigere diagnostische Rolle. Dabei wird das Expressionslevel verschiedener Gene der Tumorzellen bestimmt, was Aussagen zum Wachstumsverhalten und zur Metastasierung ermöglicht. Durch Bestimmung der Onkogene können u.a. auch Aussagen darüber getroffen werden, welche Patienten von bestimmten Therapien möglicherweise besser profitieren und welche nicht.
Labor
Laborchemisch wird hauptsächlich der Hormonstatus von Östrogen, Prolaktin, FSH und FH untersucht. Als Verlaufsparameter können Tumormarker wie z. B. CEA, CA 15-3, CA 19-9 und MCA bestimmt werden.
Weitere Untersuchungen
Für die Komplettierung des Stagings bei positiven Befunden werden je nach Ausprägung zusätzliche Untersuchungen benötigt:
- Röntgen-Thorax
- CT von Thorax, Abdomen und Kopf
- Skelettszintigraphie
- PET-CT
Staging
Das Staging der Mammakarzinome wird nach der TNM-Klassifikation durchgeführt.
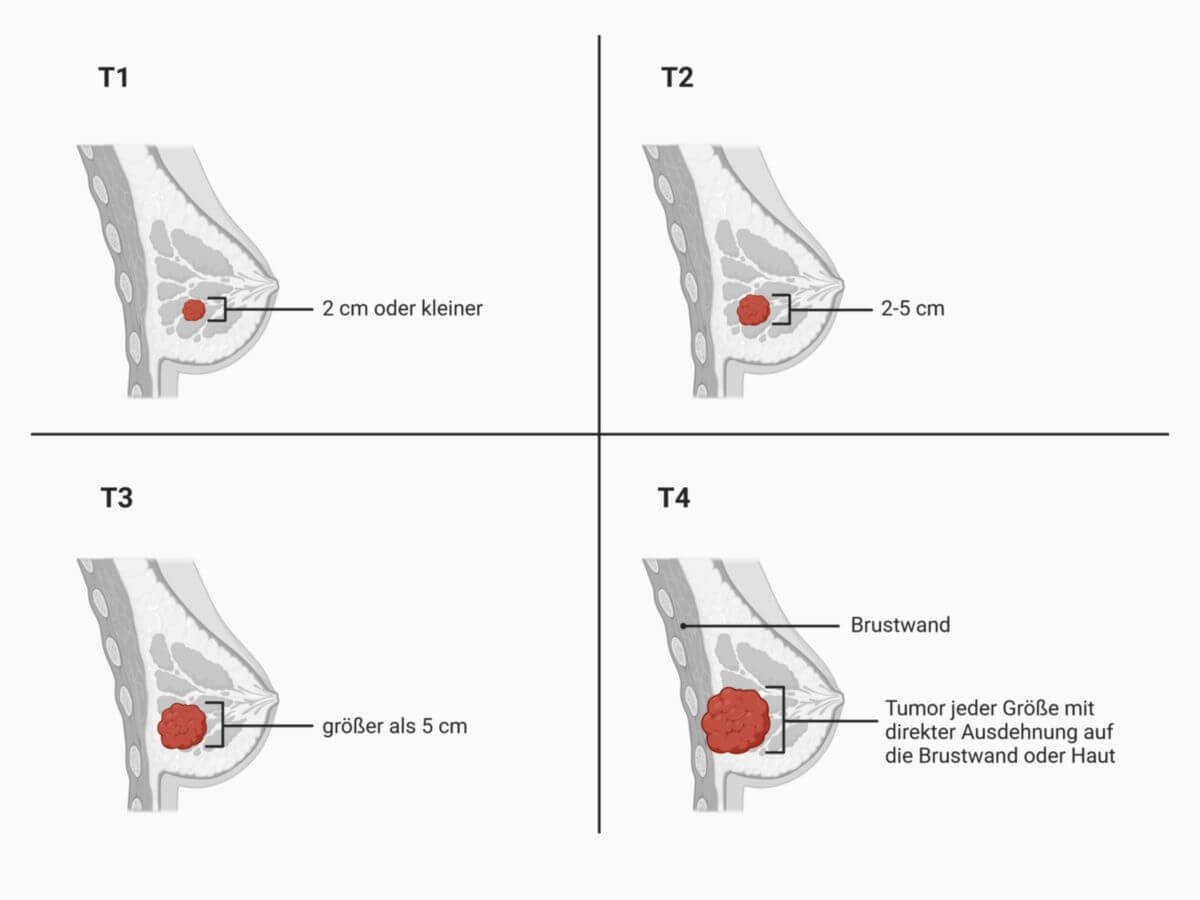
Tumorgröße
| T-Kategorie | Bedeutung |
|---|---|
| Tis | Duktales oder lobuläres Carcinoma in situ oder Morbus Paget der Mamille ohne nachweisbaren Tumor |
| T1 | Tumor 2 cm oder weniger in größter Ausdehnung T1a - > 0,1–0,5 cm |
| T2 | 2 cm < Tumor ≤ 5 cm in größter Ausdehnung |
| T3 | Tumor > 5 cm in größter Ausdehnung |
| T4 | Tumor jeder Größe mit direkter Ausdehnung auf die Brustwand oder Haut, soweit unter T4a bis T4d beschrieben T4a - Brustwand |
| TX | Primärtumor kann nicht beurteilt werden |
Lymphknoten
| N-Kategorie | Bedeutung |
|---|---|
| N0 | Keine regionären Lymphknotenmetastasen |
| N1 | Metastase(n) in beweglichen ipsilateralen axillären Lymphknoten der Level I und II |
| N2 | Metastase(n) in beweglichen ipsilateralen axillären Lymphknoten der Level I und II, untereinander oder an anderen Strukturen fixiert oder in klinisch erkennbaren ipsilateralen Lymphknoten entlang der Arteria mammaria interna in Abwesenheit klinisch erkennbarer axillärer Lymphknoten N2a - Befall eines axillären Lymphknotens, unverschieblich |
| N3 | Metastase(n) in ipsilateralen infraklavikulären Lymphknoten (Level III) mit oder ohne Beteiligung der axillären Lymphknoten des Levels I und II oder in klinisch erkennbaren ipsilateralen Lymphknoten entlang der Arteria mammaria interna in Anwesenheit klinisch erkennbarer axillärer Lymphknotenmetastasen der Level I und II oder Metastase(n) in ipsilateralen supraklavikulären Lymphknoten mit oder ohne Beteiligung der axillären Lymphknoten oder der Lymphknoten entlang der Arteria mammaria interna |
| NX | Regionäre Lymphknoten können nicht beurteilt werden |
Fernmetastasen
| M-Kategorie | Bedeutung |
|---|---|
| M0 | Keine Fernmetastasen |
| M1 | Fernmetastasen |
Differentialdiagnose
Differentialdiagnostisch kommen bei Verdacht auf Mammakarzinom eine Gruppe gutartiger Erkrankungen in Frage:
Therapie
Das therapeutische Vorgehen ergibt sich in erster Linie aus dem Tumorstaging und -grading, wobei zunehmend die Ergebnisse der Tumorgenomik (s.o.) einbezogen werden.
Grundsätzlich gilt zur allgemeinen Orientierung:
| Therapie | Indikation |
|---|---|
| primär kurativ (Operation, Bestrahlung und eventuelle Systemtherapie) |
|
| palliativ (Systemtherapie, palliative Maßnahmen) |
|
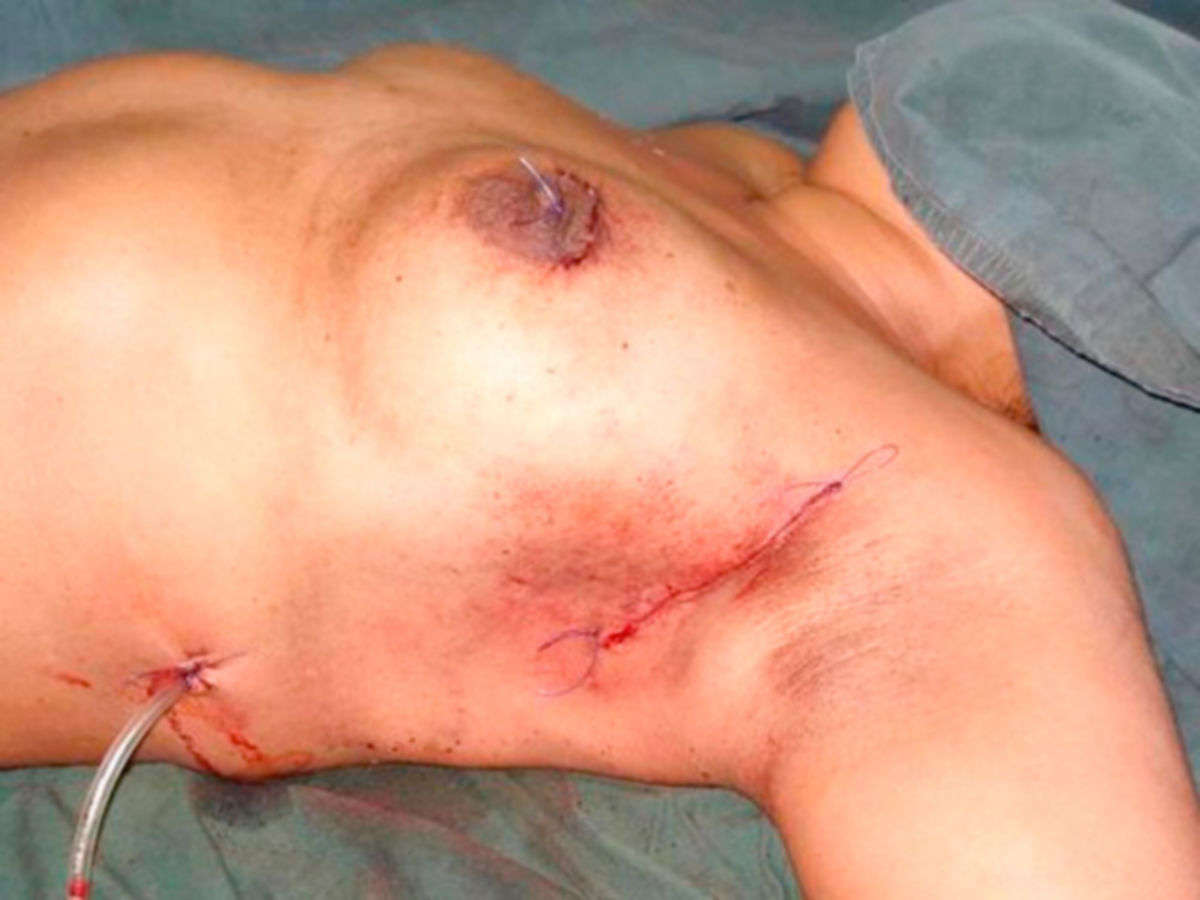
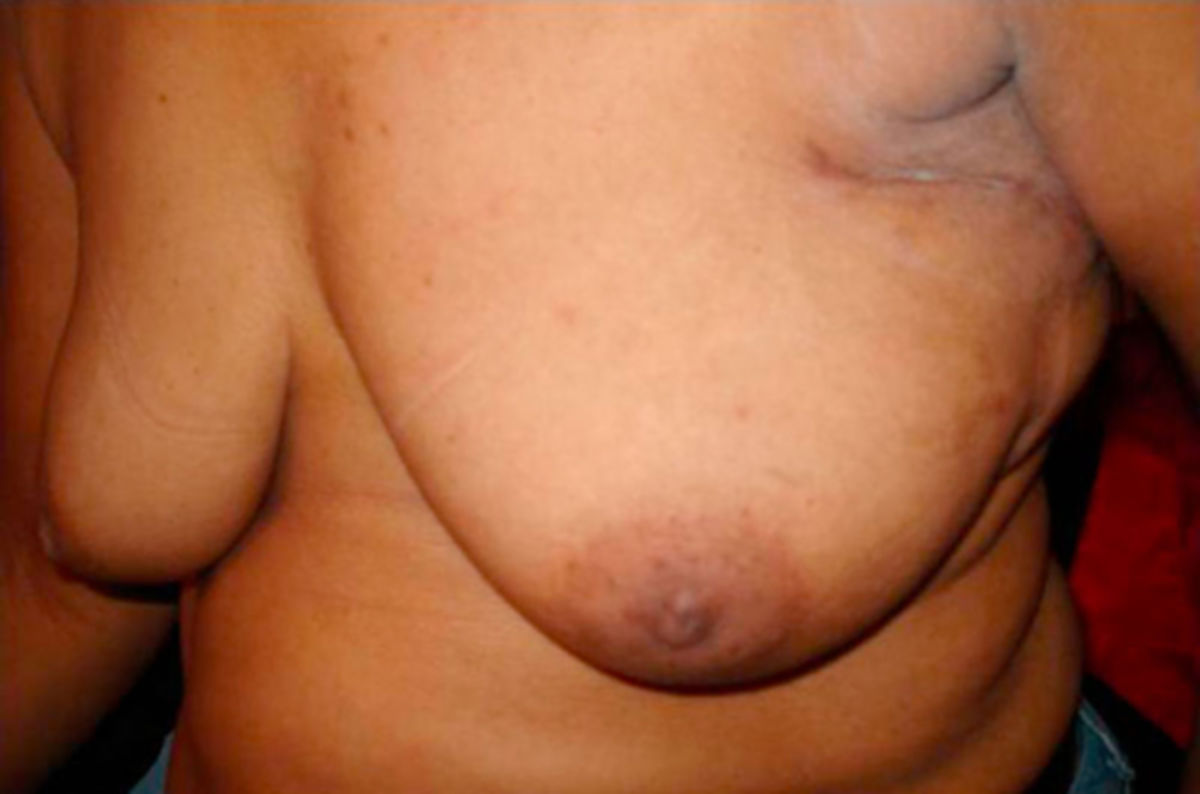
Operative Therapie
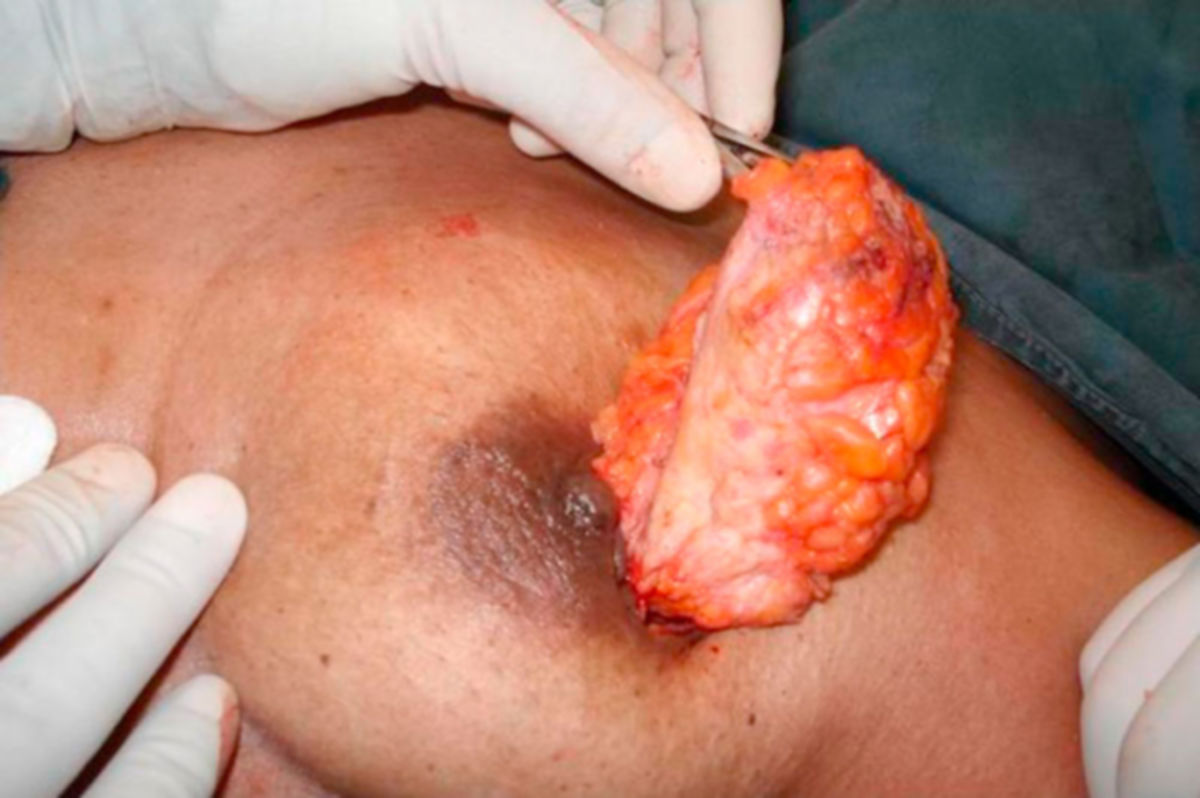
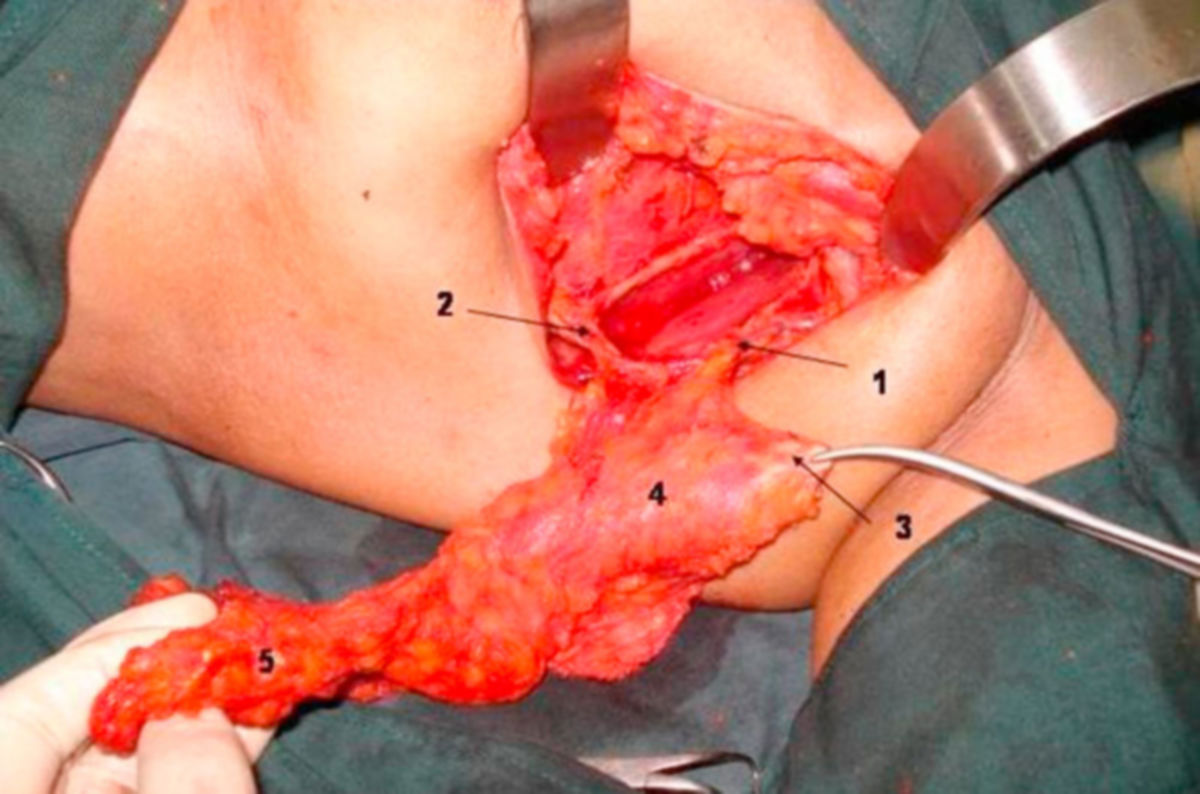
Die chirurgische Entfernung eines Mammakarzinoms erfolgt in Abhängigkeit vom Befund unter Erhaltung oder Amputation bzw. Ablation der betroffenen Brust. In jedem Fall sollte eine R0-Resektion angestrebt werden. Die Tumorentnahme wird in der Regel von einer Entfernung der regionalen Lymphknoten begleitet. Als Operationstechniken kommen u.a. in Betracht:
| Verfahren | Indikation | Beispiel |
|---|---|---|
| Brusterhaltende Therapie (BET) (R0-Resektion des Tumors) |
|
|
| Mastektomie (Entfernung von Drüsenkörper und weiteren Strukturen) |
|
|
| Operative Lymphknotenentfernung |
|
|
Nach Möglichkeit sollte die Durchführung einer BET immer bevorzugt werden. Zu beachten ist, dass eine BET bei invasiven Karzinomen zur lokalen Rezidiv- und Metastasenprophylaxe immer durch eine adjuvante Bestrahlung ergänzt werden sollte. Bei einer Mastektomie kann eine Bestrahlung vor allem bei fortgeschrittenen und LK-positiven Tumoren sinnvoll sein.
Medikamentöse Therapie
Die Wahl der medikamentösen Therapie richtet sich nach dem Befund und wird interdisziplinär getroffen. Von besonderer Bedeutung sind dabei Stadium, Grading und Rezeptorstatus des Tumors sowie das Alter und der Menopausenstatus der Patientin.
Zur Orientierung gelten folgende Richtlinien:
| Befund | Therapie |
|---|---|
| LK-negativ und Hormonrezeptoren-negativ | Polychemotherapie |
| LK-negativ und Hormonrezeptor-positiv | Antihormontherapie |
| LK-positiv und Hormonrezeptor-positiv | Polychemotherapie und Antihormontherapie |
| LK-positiv und Hormonrezeptor-negativ | Polychemotherapie |
| Metastasiert bzw. palliativ | Polychemotherapie ohne OP (bei hormonabhängigem Tumor auch endokrine Therapie) |
Weiterhin lässt sich die Gabe von systemisch-medikamentösen Therapien wie folgt unterteilen:
Neoadjuvant-systemisch
| Therapie | Indikation | Beispiel | Ziel |
|---|---|---|---|
|
|
|
|
Adjuvant-systemisch und palliativ
Chemotherapie
| Indikation | Beispiel |
|---|---|
|
|
Sollte die gleiche Chemotherapie vor und nach einer Operation indiziert sein, ist stets die neoadjuvante Option zu bevorzugen.
Antihormontherapie
| Indikation | Beispiel | Ziel |
|---|---|---|
|
|
|
Antikörpertherapie
| Indikation | Beispiel |
|---|---|
|
|
CDK4/6-Inhibition
| Indikation | Beispiel |
|---|---|
|
Frauen mit Kinderwunsch sollten vor einer Chemotherapie über eventuelle Maßnahmen zur Fruchtbarkeitserhaltung informiert werden. Eine Antikörpertherapie bei HER2-positiven Tumoren wird in der Regel zusammen mit der Chemotherapie verabreicht. Die Dauer einer Chemotherapie beträgt im Schnitt 18 bis 24 Wochen. Trastuzumab kann bis zu einem Jahr nach Operation gegeben werden. Zur Bestimmung eines unklaren Menopausenstatus bei einer Antihormontherapie können die Serumspiegel von Östrogen und FSH abgenommen werden. Eine antihormonelle Therapie sollte mindestens fünf Jahre verabreicht werden, mit möglicher Verlängerung.
Generell ist eine Aufklärung über etwaige Nebenwirkungen wie beispielsweise eine erhöhte Kardiotoxizität bei Trastuzumab oder ein erhöhtes Risiko von Endometriumkarzinomen bei Tamoxifen unbedingt erforderlich.
Vor der Entscheidung über eine Therapie kann die Erhebung einer Tumorgenomik sinnvoll sein (s.o.). Diese Gentests helfen zu differenzieren, bei welchen Patientinnen bestimmte Medikamente besonders wirksam sein könnten.
Prophylaxe
Jede Frau sollte einmal im Monat selbst die Brust schematisch abtasten. Der optimale Zeitpunkt liegt kurz nach der Menstruation. Ab dem 30. Lebensjahr sollte eine jährliche Tastuntersuchung durch den Arzt erfolgen.
Zwischen dem 35. und 40. Lebensjahr wird eine einmalige Mammographie empfohlen, die sogenannte Basis-Mammographie, die für spätere Aufnahmen als Vergleichsaufnahme dient. Vom 50. bis 69. Lebensjahr sollte dann alle 2 Jahre eine Mammographie durchgeführt werden. Bei Risikopatienten wird sie jährlich empfohlen.
Nachsorge
- In den ersten 3 Jahren nach Behandlung des Primärtumors vierteljährliche Kontrolle
- Ab dem 4. Jahr postoperative Kontrollen alle 6 Monate
- Ab dem 6. Jahr dann jährliche Kontrollen
Fallbeispiel
Leitlinie
Quellen
- ↑ Brustkrebs beim Mann, DKFZ 26.07.2018, abgerufen am 15.02.2025
- ↑ Breast Cancer Association Consortium;Breast Cancer Risk Genes — Association Analysis in More than 113,000 Women; NEJM January 20, 2021; DOI: 10.1056/NEJMoa1913948
- ↑ Engel, C. et al.; Prevalence of pathogenic BRCA1/2 germline mutations among 802 women with unilateral triple-negative breast cancer without family cancer history; BMC Cancer. 2018 Mar 7;18(1):265; abgerufen am 23.09.2021
- ↑ Frauenärztliche Praxis Dr. Ober; Histologische Typisierung von Mammakarzinomen; aufgerufen am 28.09.2022
- ↑ Frauenärztliche Praxis Dr. Rode; Brustkrebsarten; aufgerufen am 28.09.2022
- ↑ Gogiashvili, M. et al.; Impact of intrattumoral heterogenity of breast cancer tissue on quantitative metabolomics using high-resolution magic angle spinning. H NMR spectroscopy.; WILEY NMR in Biomedicine 2018; 31:e3862 (14 Seiten)
- ↑ Mei W et al. A commonly inherited human PCSK9 germline variant drives breast cancer metastasis via LRP1 receptor. Cell. 2025
Literatur
- Eucker, J. / Possinger K.; Mammakarzinome: Adjuvante Situation; Der Bayerische Internist 29 (2009). H.3, S.123-130.
- Regierer, A. C. / Bolbrinker, J. / Possinger, K.; Individualisierung der systemischen Therapie beim Mammakarzinom; Der Bayerische Internist 29 (2009). H.3, S.141-144.
- Wittekind C., Meyer H. J. (Ed); TNM Klassifikation maligner Tumoren; Weinheim: Wiley- Blackwell; 2010.
- Romagnolo A. P., Romagnolo D. F., Selmin O. I.; BRCA1 as target for breast cancer prevention and therapy; Anticancer Agents Med Chem. 2015;15(1):4-14.
- Paul A., Paul S.: The breast cancer susceptibility genes (BRCA) in breast and ovarian cancers; Front Biosci (Landmark Ed). 2014 Jan 1;19:605-18.
- Howell A., Anderson A. S., Clarke R. B., Duffy S. W., Evans D. G., Garcia-Closas M., Gescher A. J., Key T. J., Saxton J. M., Harvie M. N.; Risk determination and prevention of breast cancer; Breast Cancer Res. 2014 Sep 28;16(5):446; DOI: 10.1186/s13058-014-0446-2.
- Pschyrembel Online; Plateauphänomen; aufgerufen am 06.09.2021.
- Weyerstahl T. et al.; Duale Reihe - Gynäkologie und Geburtshilfe; Georg Thieme Verlag KG, 2014.