Proteinkinase A
Synonym: cAMP-abhängige Proteinkinase
Englisch: protein kinase A, cAMP-dependent protein kinase
Definition
Die Proteinkinase A, kurz PKA, ist ein Enzym aus der Gruppe der Serin/Threonin-Kinasen. Sie besitzt jeweils zwei regulatorische und zwei katalytische Untereinheiten und ist u.a. an zahlreichen Reaktionen des Energiestoffwechsels beteiligt.
Nomenklatur
Die Bezeichnung Proteinkinase A beruht darauf, dass das Enzym durch cAMP intrazellulär aktiviert wird.
Genetik
Es existieren verschiedene Isoformen der regulatorischen und katalytischen Untereinheiten, die durch folgende Gene kodiert werden:
| Typ | Genname | Genlokus |
|---|---|---|
| Katalytische Untereinheiten | PRKACA | 19p13.12 |
| PRKACB | 1p31.1 | |
| PRKACG | 9q21.11 | |
| Regulatorische Untereinheiten | PRKAR1A | 17q24.2 |
| PRKAR1B | 7p22.3 | |
| PRKAR2A | 3p21.31 | |
| PRKAR2B | 7q22.3 |
Die Isoformen unterscheiden sich durch ihre Expressionsmuster und spezifischen Substrate.
Biochemie
Struktur
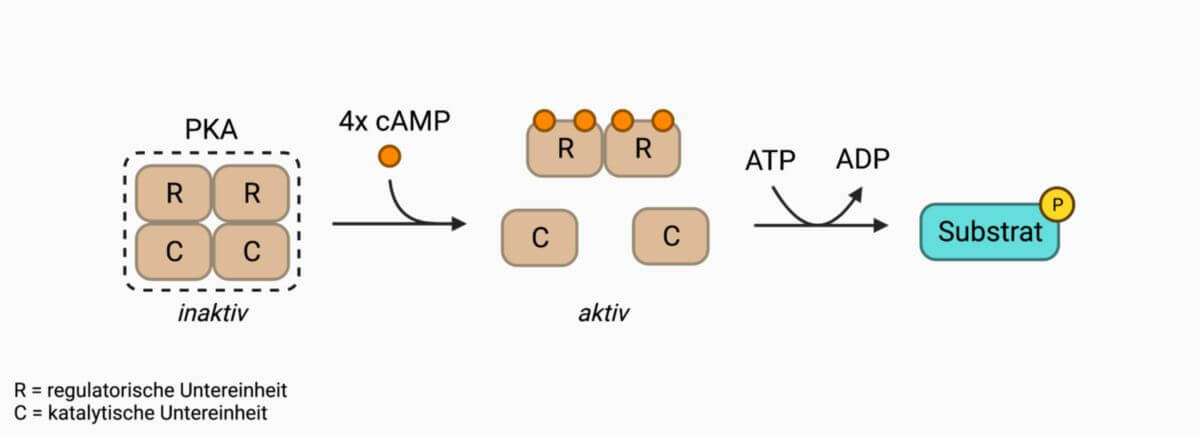
PKA liegt in höher entwickelten Eukaryoten als Heterotetramer vor, sofern keine Aktivierung durch den Second Messenger cAMP vorliegt. Sie besteht aus zwei regulatorischen Untereinheiten (R), die jeweils eine hohe Bindungsaffinität zu cAMP aufweisen, sowie zwei katalytischen Untereinheiten (C), an denen Coenzym und Substrat binden können.
In einzelligen Eukaryoten, wie beispielsweise Schleimpilzen oder Protozoen, liegt die PKA als Heterodimer vor. Hier existiert nur jeweils eine der o.g. Untereinheiten.
Aktivierung
Zur Aktivierung ist eine allosterische, kooperative Bindung zweier cAMP-Moleküle an beide R-Untereinheiten notwendig. Dies induziert die Dissoziation des Enzymkomplexes. Die monomeren C-Untereinheiten sind nun aktiv und in der Lage, ihre Proteinsubstrate zu phosphorylieren.
Regulation
PKA wird zum einen durch die cAMP-Konzentration reguliert. Gs-gekoppelte-Rezeptoren bewirken durch Aktivierung der Adenylatzyklase einen Anstieg der intrazellulären cAMP-Konzentration. Zu den PKA-Substraten zählt auch die cAMP-Phosphodiesterase (PDE). Dieses Enzym wandelt cAMP mittels Hydrolyse zu AMP um und bewirkt so eine Feedback-Inhibition der PKA-Aktivität.
Ein weiterer Feedback-Mechanismus wird über die E3-Ligase Praja-2 vermittelt, die nach Aktivierung durch PKA die regulatorischen Untereinheiten ubiquitiniert und somit für den Abbau durch das Proteasom markiert. Sie moduliert darüber die Stärke und Dauer der PKA-Aktivierung.
Weiterhin spielt die subzelluläre Lokalisation eine Rolle für die Aktivität.
Funktion
Die Proteinkinase A ist an der Regulation zahlreicher biologischer Funktionen beteiligt. Im Zytosol hat sie folgende Wirkungen:
- Hydrolyse der Triglyceride durch PKA-kontrollierte Lipasen
- Hemmung der Acetyl-CoA-Carboxylase (Schrittmacherenzym der Fettsäuresynthese)
- Interkonvertierung von Enzymen
- Vermittlung von Lipolyse und Glykogenolyse
- Regulation der Steroidsynthese durch reversible Phosphorylierung der hormonsensitiven Lipase
- Modifikation von Synapsen über die Phosphorylierung von Synapsinen
- Regulation von Ionenkanälen
Im Zellkern reguliert die Proteinkinase A die Transkription bestimmter Gene (z.B. für Ionenkanäle) durch Aktivierung spezieller Transkriptionsfaktoren. Diese sogenannten CREBs ("cAMP-responsive element-binding proteins") binden an definierte DNA-Sequenzen, die als cAMP response elements (CRE) bezeichnet werden, und rekrutieren daraufhin Coaktivatoren. Dadurch wird die Transkription angeregt.
Substrate
PKA hat mehr als 200 verschiedene Substrate. Sie phosphoryliert Serin (S) und Threoninreste (T) innerhalb der basischen Konsensussequenz (R/K)(R/K)X(pS/pT), wobei X für jegliche Aminosäure stehen kann. Zu den Substraten zählt u.a.:
Weblinks
Literatur
- Rassow: Duale Reihe Biochemie, 3. Auflage, 2012, Thieme