Ubiquitinligase
Synonyme: E3-Ligase, Ubiquitin-Protein-Ligase
Englisch: ubiquitin ligase
Definition
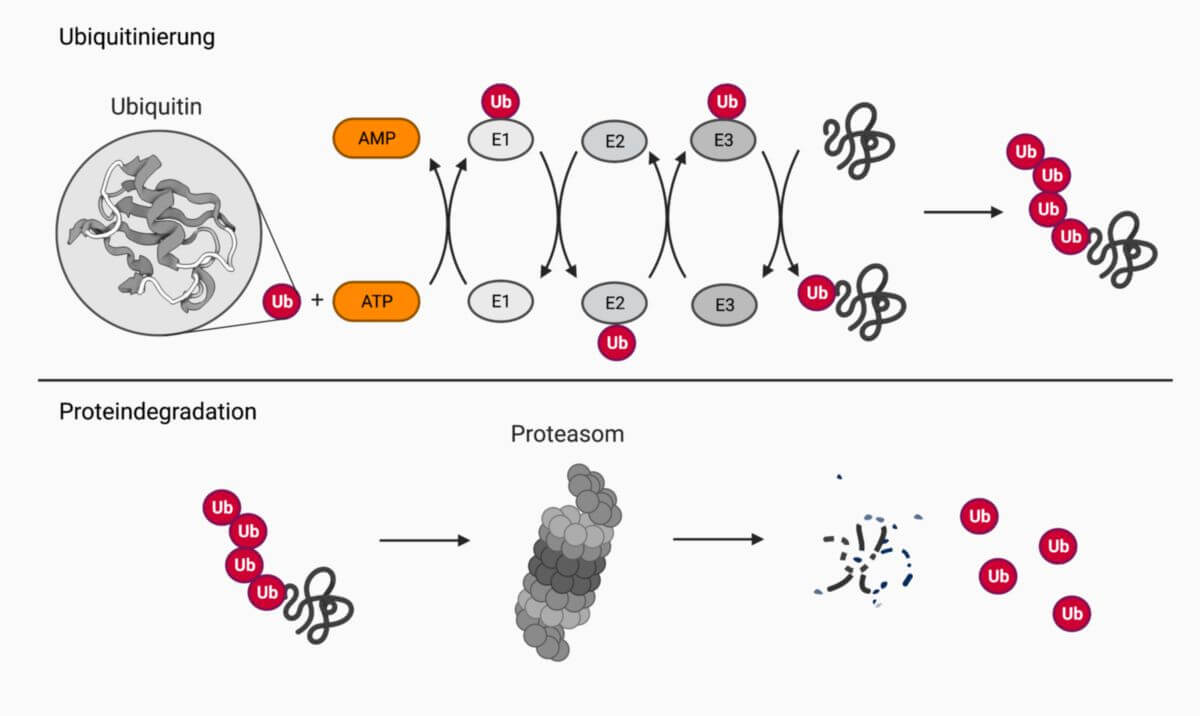
Ubiquitinligasen bzw. E3-Enzyme sind eine Klasse von Enzymen, die während der Ubiquitinierung Ubiquitin auf Zielproteine übertragen. Sie agieren in einer Enzymkaskade nach E1- und E2-Enzymen.
Biochemie
Ubiquitin wird unter ATP-Verbrauch von E1-Enzymen aktiviert und anschließend auf E2-Enyzme übertragen. Ubiquitinligasen sorgen zum einen dafür, dass ein mit Ubiquitin beladenes E2-Enzym das richtige Substrat findet und katalysieren anschließend die Bindung von Ubiquitin an das Substrat. Sie bilden dabei eine Isopeptidbindung zwischen dem C-terminalen Glycins des Ubiquitins und einer ε-Aminogruppe eines internen Lysins des Substrats.
Ubiquitinligasen sind im Vergleich zu den E1- und E2-Enzymen eine sehr große Klasse mit mehreren hundert Vertretern. Sie können in drei Gruppen unterteilt werden, je nachdem, ob sie eine RING- HECT- oder RBR-Domäne besitzen. Sie sind somit verantwortlich für die Spezifität der Ubiquitinierungsreaktion.
Pharmakologie
Die Rekrutierung von Ubiquitinligasen ist die Wirkrationale der Proteolysis Targeting Chimeras (PROTACs).
Quellen
- Ye et al Building ubiquitin chains: E2 enzymes at work. Nat Rev Mol Cell Biol; 2009
- Chaugule et al Specificity and disease in the ubiquitin system. Biochem Soc Trans; 2016