Gs-gekoppelter-Rezeptor
Englisch: Gs-coupled receptor
Definition
Die Gs-gekoppelten-Rezeptoren sind eine Untergruppe der G-Protein-gekoppelten-Rezeptoren. Sie vermitteln ihre Wirkung über die Steigerung der intrazellulären cAMP-Konzentration.
Struktur
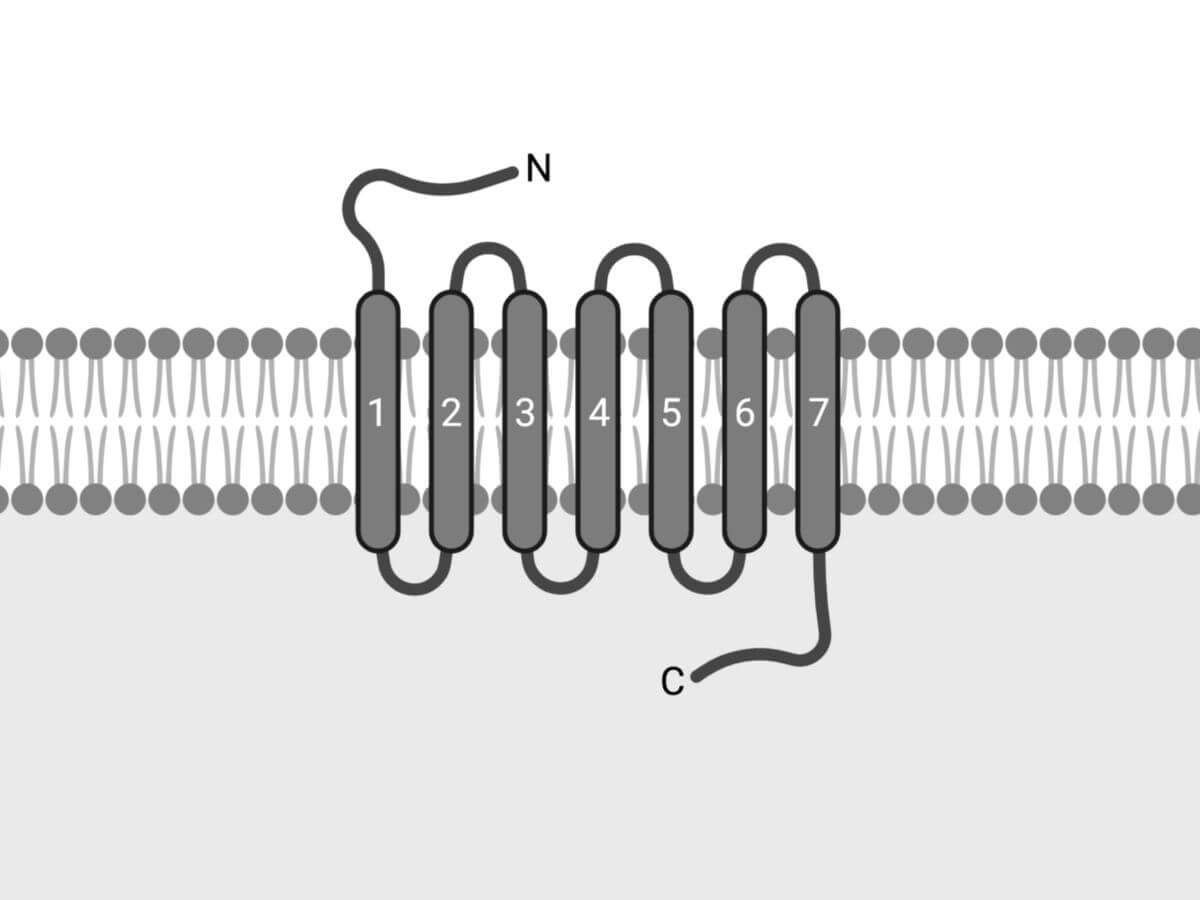
Alle G-Protein-gekoppelten-Rezeptoren bestehen aus sieben Transmembrandomänen, die jeweils aus ca. 20 Aminosäuren aufgebaut und zu einer α-Helix angeordnet sind. Abgeleitet von dieser Struktur bezeichnet man sie auch als heptahelikale Rezeptoren. Der N-Terminus liegt dabei extrazellulär, der C-Terminus intrazellulär.
Wirkmechanismus
Nach der Bindung eines extrazellulären Liganden wird an der α-Untereinheit des G-Proteins GDP zu GTP getauscht. Sie dissoziiert danach von der βγ-Untereinheit. Die aktivierte α-Untereinheit bindet anschließend an die Adenylatzyklase (AC). Diese setzt nun ATP zu cAMP um. cAMP kann darauf hin die Proteinkinase A (PKA) aktivieren oder direkt Ionenkanäle stimulieren. Die Proteinkinase A ist in der Lage, Enzyme, Ionenkanäle oder Transportproteine zu phosphorylieren.
Je nach Ort können Gs-gekoppelte Proteine gegenläufige Effekte verursachen. So kommt es in Herzmuskelzellen über die PKA und Phosphorylierung von L-Typ-Calciumkanälen zu einer Calciumausschüttung und somit zu einer Verstärkung der Kontraktion (positive Inotropie). In der glatten Gefäßmuskulatur wird jedoch durch die Aktivierung der PKA (hemmt Myosin-Leichtketten-Kinase) eine Vasodilatation vermittelt.
Beispiele
Literatur
- Freissmuth, M., Offermanns, S. & Böhm, S. Pharmakologie und Toxikologie. Springer Publishing, 2016
- Schmidt, R. F., Lang, F. & Heckmann, M. Physiologie des Menschen. Springer Publishing, 2010
- Reiner. β-Arrestin/Rezeptor-Interaktionen, Dissertation, 2010