Ggust-gekoppelter-Rezeptor
Englisch: Ggust-coupled receptor, taste receptor
Definition
Struktur
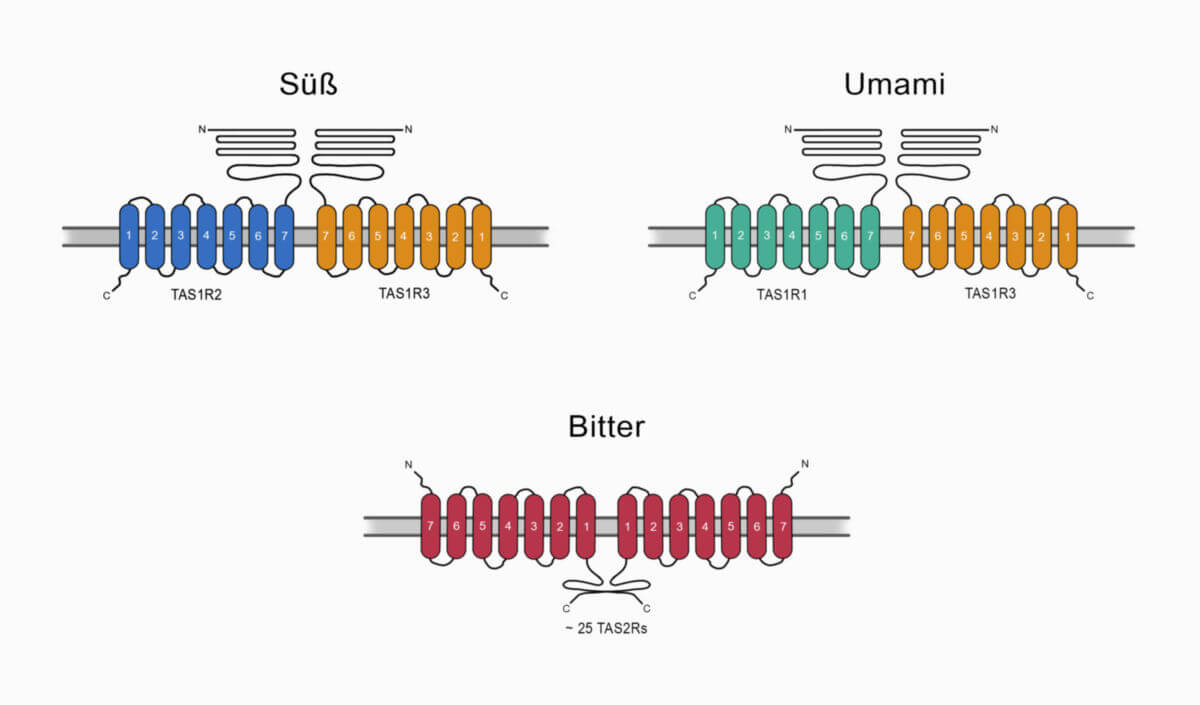
Wie alle G-Protein-gekoppelten-Rezeptoren bestehen Ggust-Rezeptoren aus sieben Transmembrandomänen, die jeweils aus ca. 20 Aminosäuren aufgebaut und zu einer α-Helix angeordnet sind. Abgeleitet von dieser Struktur bezeichnet man sie auch als heptahelikale Rezeptoren. Der N-Terminus liegt extrazellulär, der C-Terminus intrazellulär.
Ggust-gekoppelten-Rezeptoren sind immer als Homo- oder Heterodimere innerhalb der Zellmembran der Geschmackssinneszellen organisiert.
Vertreter
Funktion
Nach der Bindung eines extrazellulären Liganden wird an der α-Untereinheit des heterotrimeren G-Proteins GDP zu GTP getauscht. Daraufhin dissoziiert sie von der βγ-Untereinheit. Während die α-Untereinheit durch Aktivierung der Phosphodiesterase den cAMP-Spiegel senkt, bindet die βγ-Untereinheit an die Phospholipase Cβ2 und aktiviert diese. Dadurch steigt die intrazelluläre Calciumkonzentration (Ca2+) an.
Die erhöhte Calciumkonzentration sorgt nun dafür, dass einwertige Ionenkanäle (TRPM5) geöffnet werden und anschließend mittels Depolarisation Transmitter (ATP) freigesetzt werden.
Die Geschmackqualitäten süß, bitter und umami werden durch die Kombination verschiedener Ggust-gekoppelter-Rezeptoren vermittelt:
- süß: TAS1R2/TAS1R3-Heterodimer oder TAS1R3-Homodimer
- umami: TAS1R1/TAS1R3- Heterodimer
- bitter: Taste-Rezeptoren vom Typ 2
Im Vergleich zu den anderen Geschmacksqualitäten hat der Geschmack von Bitterstoffen einen extrem niedrige Schwellenwert. Dies ist auch sinnvoll, da diese häufig toxisch auf den menschlichen Körper wirken können.
Literatur
- Physiologie des Menschen: Mit Pathophysiologie, Springer-Lehrbuch, 32. Auflage