Avelumab
Handelsname: Bavencio®
Definition
Avelumab ist ein monoklonaler Antikörper aus der Gruppe der Checkpoint-Inhibitoren. Er wird in der Onkologie zur Immunmodulation im Rahmen der Tumortherapie eingesetzt.
Wirkmechanismus
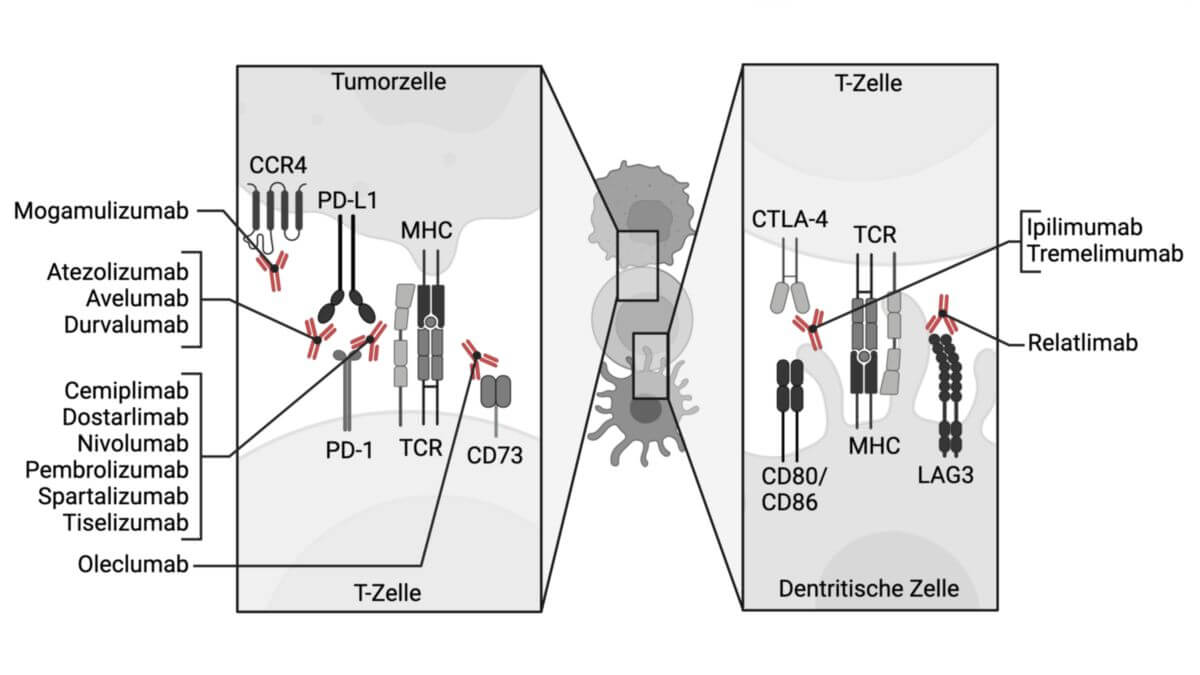
Avelumab ist ein humaner monoklonaler Antikörper des Typs IgG1, der spezifisch an PD-L1 ("programmed cell death ligand 1") bindet. Er hemmt die Wechselwirkung zwischen PD-L1 und dem PD-1-Rezeptor. Dadurch wird die hemmende Wirkung von PD-L1 auf zytotoxische CD8+ T-Zellen aufgehoben, was zur Verstärkung bzw. Wiederherstellung der gegen den Tumor gerichteten T-Zell-Antwort führt.
Darüber hinaus induziert Avelumab mittels antikörperabhängiger zellvermittelter Zytotoxizität (ADCC) eine direkte Tumorzelllyse, die durch NK-Zellen vermittelt wird.
Pharmakokinetik
Die Plasmahalbwertszeit liegt bei rund 6 Tagen. Der Steady state wird bei wiederholter Gabe von 10 mg/kgKG alle 2 Wochen nach ca. 4 bis 6 Wochen erreicht. Eine leichte oder mäßige Einschränkung der Nierenfunktion hat keinen relevanten Einfluss auf die Clearance von Avelumab.
Indikationen
- Monotherapie des metastasierten Merkelzellkarzinoms (MCC)
Darüber hinaus wird Avelumab in den USA als Zweitlinientherapie des metastasierten Urothelkarzinoms eingesetzt.
Avelumab wurde auch bei anderen Tumoren untersucht. Bei der Therapie des nicht-kleinzelligen Bronchialkarzinoms (NSCLC) mit Avelumab wurden jedoch in klinischen Studien die primären Endpunkte nicht erreicht.
Dosierung
Die empfohlene Dosis von Avelumab beträgt 10 mg/kgKG alle 2 Wochen. Der Wirkstoff wird intravenös über 60 Minuten verabreicht.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Prämedikation
Vor den ersten 4 Infusionen von Avalumab ist eine Prämedikation mit einem Antihistaminikum und Paracetamol notwendig. Wenn die vierte Infusion ohne infusionsbedingte Reaktion abgeschlossen wurde, kann die Prämedikation bei darauffolgenden Anwendunden nach Ermessen des behandelnden Arztes verabreicht werden.
Nebenwirkungen
Bedingt durch den spezifischen Wirkmechanismus von Avelumab kann es unter der Therapie zu immunvermittelten Nebenwirkungen kommen, die sich als immunvermittelte Pneumonitis, Hepatitis, Nephritis, Kolitis oder Endokrinopathie (Diabetes mellitus Typ 1, Nebenniereninsuffizienz, Thyreopathie) manifestieren können.
Folgende Nebenwirkungen treten unter Avelumab häufig (≥ 1:100, < 1:10) oder sehr häufig (≥ 1:10) auf:
- Infusionsbedingte Reaktion
- Blutbildendes System: Anämie, Lymphopenie
- Endokrines System: Hypothyreose
- Nervensystem: Kopfschmerzen, Schwindel, periphere Neuropathie
- Kardiovaskuläres System: Hypertonie, Hypotonie
- Atemwege: Husten, Dyspnoe, Pneumonitis
- Gastrointestinaltrakt: Nausea, Diarrhö, Obstipation, Erbrechen, Abdominalschmerz, Mundtrockenheit, Inappetenz, Gewichtsverlust
- Haut: Exanthem (makulopapulös), Pruritus, trockene Haut
- Bewegunsgapparat: Rückenschmerzen, Arthralgie, Myalgie
- Fatigue, Fieber, periphere Ödeme, Schüttelfrost, Influenza-ähnliche Symptome
Labormedizinisch kommt es zu einer Erhöhung von Gamma-GT, alkalischer Phosphatase, alpha-Amylase, Lipase und Kreatinin im Blut
Wechselwirkungen
Da Avelumab wie andere Proteine über katabole Stoffwechselwege abgebaut wird, sind keine direkten Wechselwirkungen mit anderen Arzneimitteln zu erwarten.
Kontraindikation
- Überempfindlichkeit gegenüber dem Wirkstoff
- Schwangerschaft, Stillzeit
Lagerung
Das Arzneimittel muss im Kühlschrank gelagert werden (2 °C bis 8 °C).
Zulassung
Nutzenbewertung
Der Zusatznutzen einer Therapie mit Avelumab wird vom G-BA auf der Basis der vom IQWiG ausgewerteten Studienergebnisse als "nicht quantifizierbar" eingeordnet.[1]
Kosten
Die Jahrestherapiekosten betragen pro Patient rund 114.000 €.[2]