Kolorektales Karzinom
Synonyme: Dickdarmkrebs, "Darmkrebs"
Englisch: colorectal carcinoma, colon carcinoma
Definition
ICD-10-Codes
- C18.-: Bösartige Neubildung des Kolons
- C19: Bösartige Neubildung am Rektosigmoid, Übergang
- C20: Bösartige Neubildung des Rektums
Nomenklatur
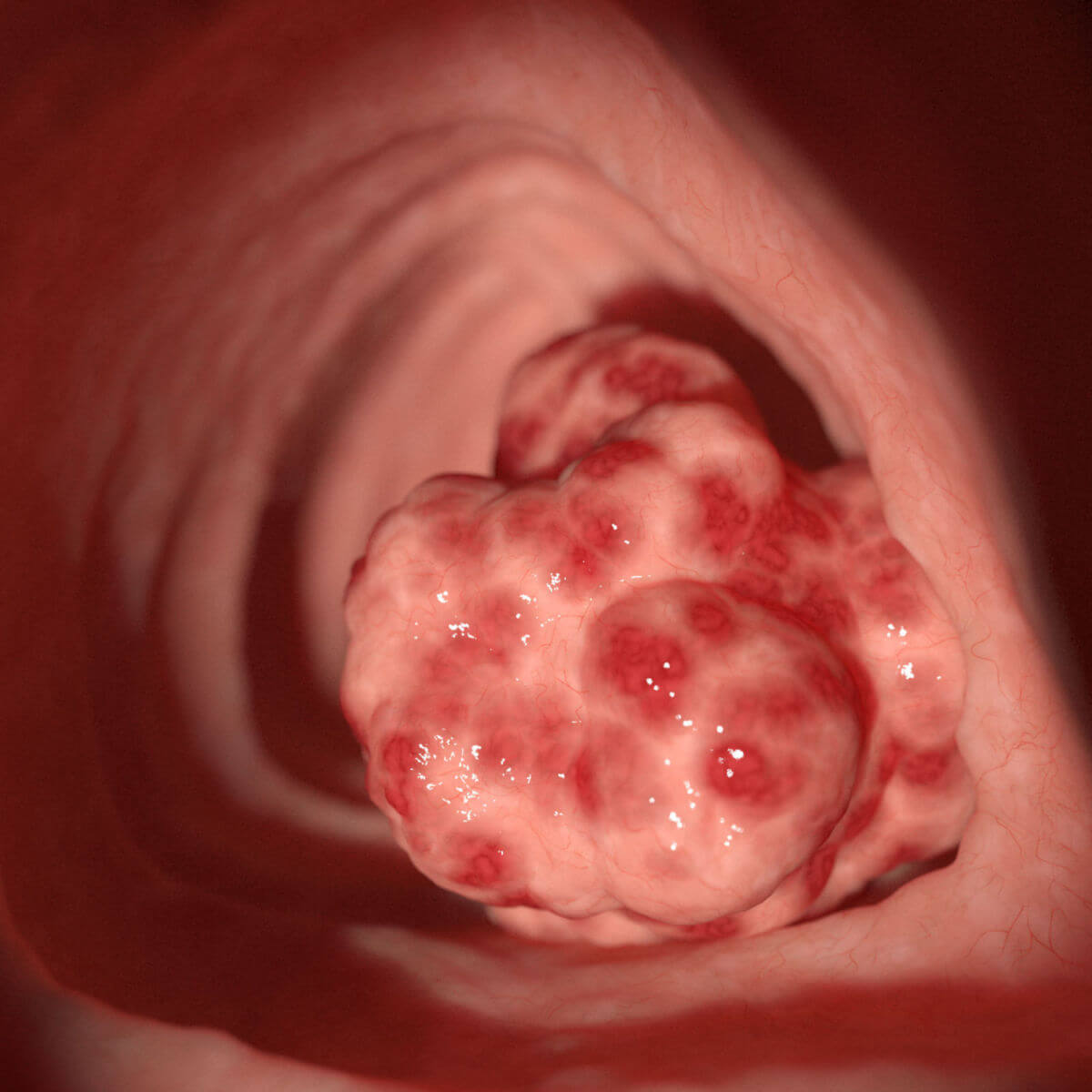
Unter dem übergeordneten Begriff "kolorektales Karzinom" werden maligne Tumoren des Kolons (Colon ascendens, transversum, descendens und sigmoideum) und des Rektums zusammengefasst. Kolonkarzinome und Rektumkarzinome haben eine sehr ähnliche Klinik. Aufgrund von anatomischen Besonderheiten (u.a. Lage, Peritonealverhältnisse und Gefäßversorgung) bestehen jedoch Unterschiede hinsichtlich Diagnostik, Therapie und Prognose.
Epidemiologie
Das kolorektale Karzinom ist in Deutschland bei Frauen die zweithäufigste und bei Männern die dritthäufigste Krebserkrankung. Die Inzidenz liegt bei etwa 57.000 Neuerkrankungen pro Jahr, wobei 90% nach dem 50. Lebensjahr diagnostiziert werden. Das mediane Erkrankungsalter liegt bei ca. 75 Jahren. Obwohl die Erkrankung meist im letzten Lebensdrittel auftritt, hat die Inzidenz des CRC bei unter 50-jährigen in den letzten Jahren zugenommen.
Die Mortalität des kolorektalen Karzinoms in Deutschland ist rückläufig.[1] Trotzdem handelt es sich nach wie vor um die zweithäufigste Krebstodesursache bei Männern bzw. um die dritthäufigste bei Frauen.
Ätiologie
Kolorektale Karzinome sind lokal infiltrierende und potentiell metastasierende Neubildungen des Epithels. Dabei entsteht ein Großteil der kolorektalen Karzinome auf dem Boden einer epithelialen Dysplasie. Man vermutet eine Kombination aus endogenen und exogenen Ursachen und Risikofaktoren.
Das Dickdarmepithel zeigt im Vergleich zum Dünndarm eine höhere Anfälligkeit für neoplastische Veränderungen. Maligne Tumoren treten im Dünndarm deutlich seltener auf. Mögliche Gründe dafür sind:
- längere Verweildauer potenziell kanzerogener Noxen im Kolon
- hohe bakterielle Stoffwechselaktivität mit entsprechender Antigenexposition
- geringere epitheliale Erneuerungsdynamik
Das immunologische Containment des Darmmikrobioms stellt hohe Anforderungen an das Dickdarmepithel. Barrierestörungen können Entzündungsprozesse in Gang setzen, welche die Karzinogenese triggern.
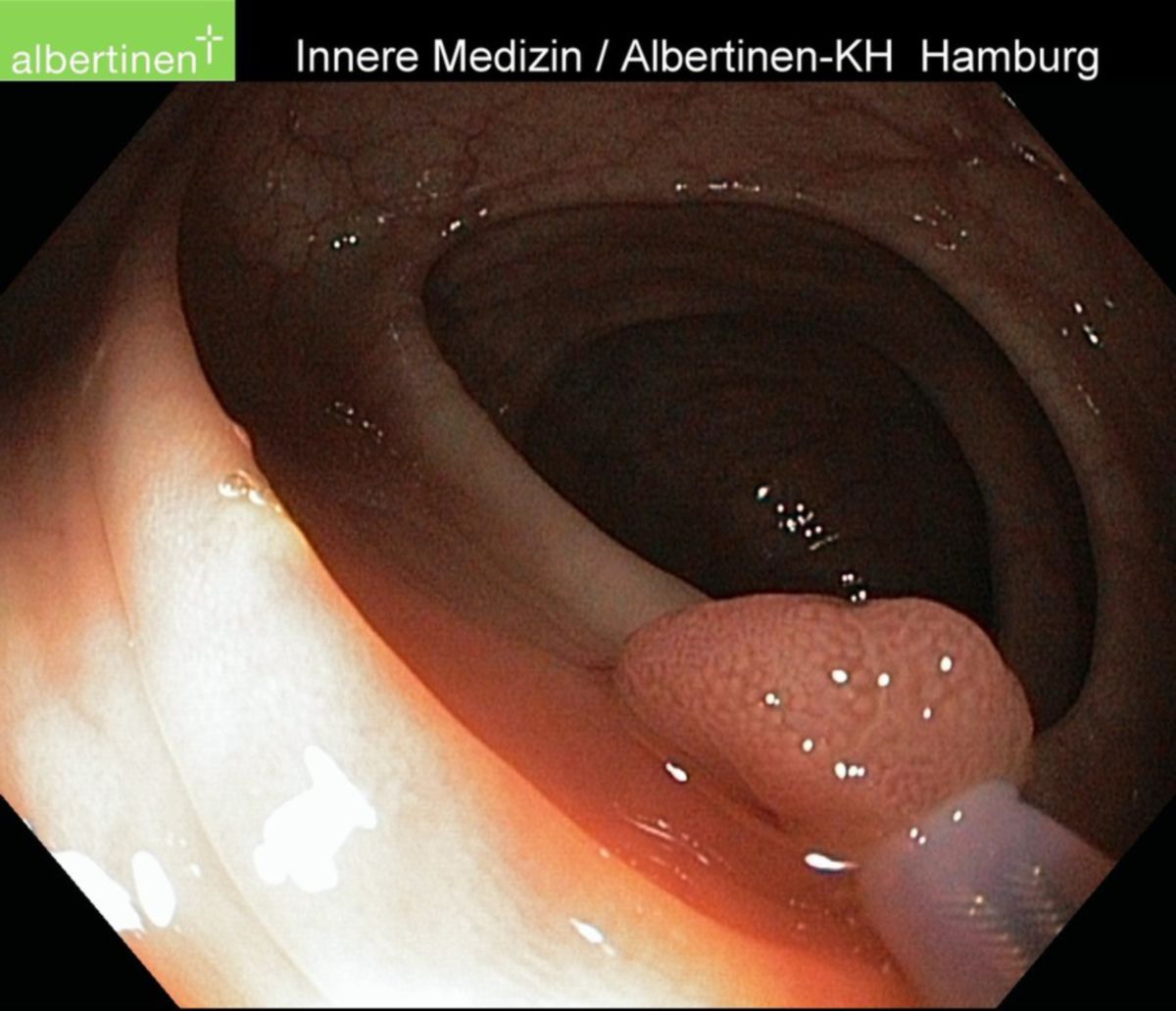
Im Besonderen wurde für kolorektale Karzinome eine lineare Pathogenese, die Adenom-Karzinom-Sequenz postuliert, die von einem progredienten Entartungsvorgang über das kolorektale Adenom ("Polypen") bis zum Karzinom ausgeht. Die eher seltenen villösen Adenome weisen dabei das höchste, die häufigeren tubulären Adenome ein geringeres Entartungsrisiko auf.
Genetische Risikofaktoren
Molekularbiologische Veränderungen können die Entstehung eines Karzinoms begünstigen. Dazu zählt z.B. der Verlust von Tumorsuppressorgenen (APC-Tumorsuppressorgen, DCC-Tumorsuppressorgen) und die Aktivierung von Onkogenen (K-Ras-Onkogen). In einem Teil der Fälle werden diese Veränderungen durch eine Mismatch-Reparatur-Defizienz verursacht. Häufen sich die DNA-Schäden, kommt es im vulnerablen Epithel mit einer höheren Wahrscheinlichkeit zu einer malignen Transformation.
Etwa 20 bis 30 % der KRK-Fälle treten familiär gehäuft auf, ohne dass konkrete genetische Ursachen identifiziert werden können. Für Verwandte I° eines Patienten mit einem KRK ist das mittlere Risiko zwei- bis dreifach erhöht. Wenn bei dem Indexpatienten das KRK vor dem 60. Lebensjahr aufgetreten ist und/oder mindestens zwei Verwandte I° von einem KRK betroffen sind, ergibt sich eine weitere, drei- bis vierfache Risikosteigerung.
Weiterhin existieren definierte genetische Erkrankungen, die mit einem hohen KRK-Risiko einhergehen. Dazu zählen:
- das hereditäre nicht-polypöse Kolonkarzinom-Syndrom (HNPCC) sowie
- familiäre Polyposis-Syndrome (z.B. familiäre adenomatöse Polyposis, MUTYH-assoziierte Polyposis, Peutz-Jeghers-Syndrom, Cowden-Syndrom, Cronkhite-Canada-Syndrom, Turcot-Syndrom)
Weitere Risikofaktoren
- Rauchen, Alkohol
- Adipositas
- ballaststoffarme, fettreiche Ernährung
- übermäßiger Fleischkonsum (v.a. rotes Fleisch)
- Alter über 40 Jahre
- assoziierte Krankheiten:
- kolorektale Adenome
- Colitis ulcerosa
- Morbus Crohn
- Diabetes mellitus Typ 2
Symptome
Das kolorektale Karzinom zeigt i.d.R. keine auffälligen Frühsymptome. Typische Beschwerden treten häufig erst in fortgeschrittenen Stadien auf. Neben B-Symptomen (Gewichtsverlust, Nachtschweiß, Fieber) und unspezifischen Allgemeinsymptomen (z.B. reduzierte Leistungsfähigkeit) sind Veränderungen des Stuhlgangs typisch. Dazu zählen:
- Obstipation
- rektaler Blutabgang (z.B. Hämatochezie, Meläna, okkultes Blut)
- paradoxe Diarrhoe
- ungewollter Stuhlabgang bei Flatus ("falscher Freund")
- Bleistiftstuhl
Bei Sitz des Tumors im Colon ascendens kann eine Obstipation fehlen, da der Stuhl hier noch nicht eingedickt ist und die Tumorengstelle passieren kann.
In gravierenden Fällen kann ein stenosierendes kolorektales Karzinom zu einem Ileus bzw. zu einem akuten Abdomen führen und damit einen Notfall darstellen.
Lokalisation
Je nach Abstand von der Anokutanlinie unterscheidet man zwischen:
- Kolonkarzinom: > 16 cm Abstand
- Rektumkarzinom:
- oberes Drittel: 12 – 16 cm
- mittleres Drittel: 6 – 12 cm
- unteres Drittel: < 6 cm
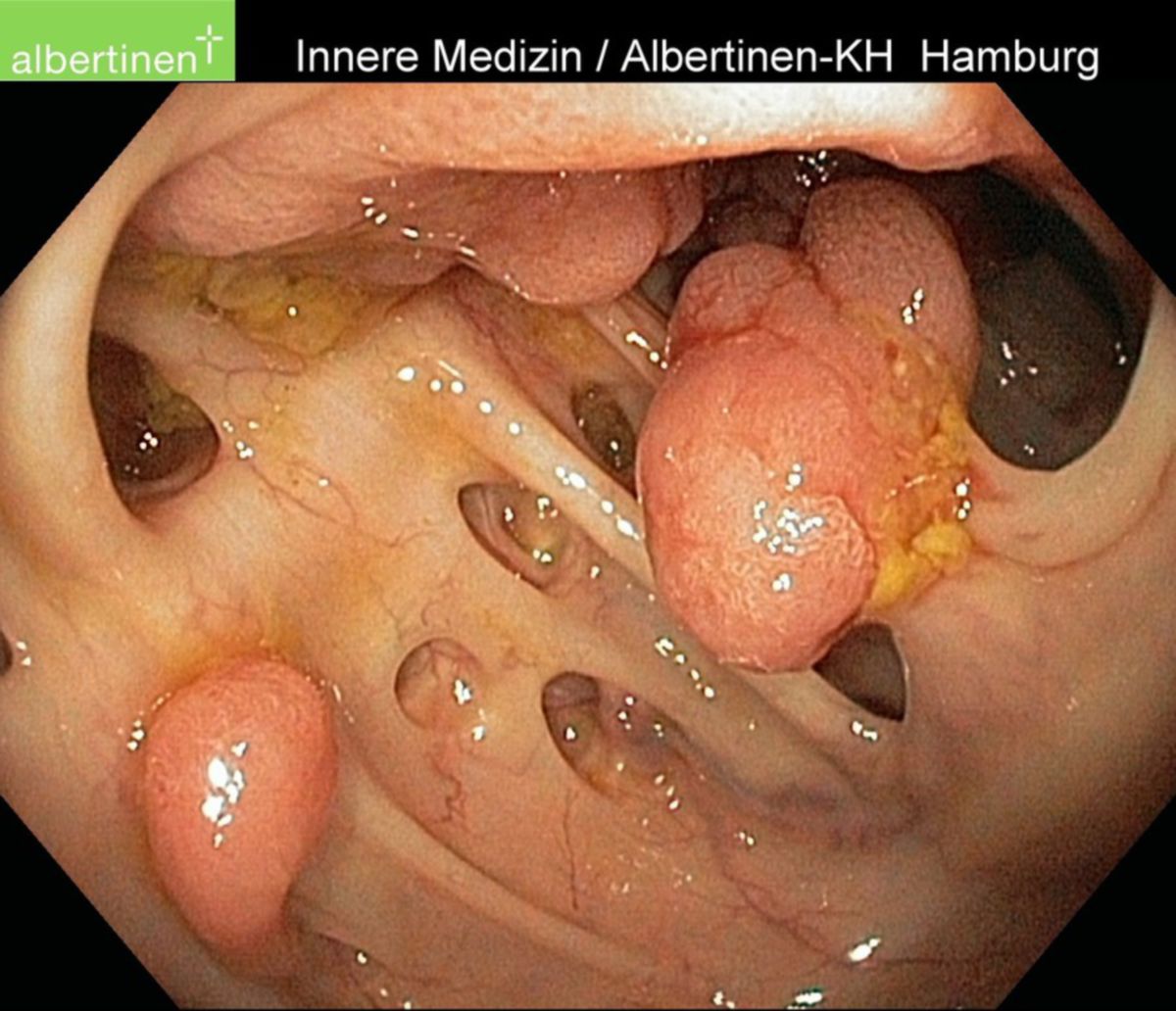
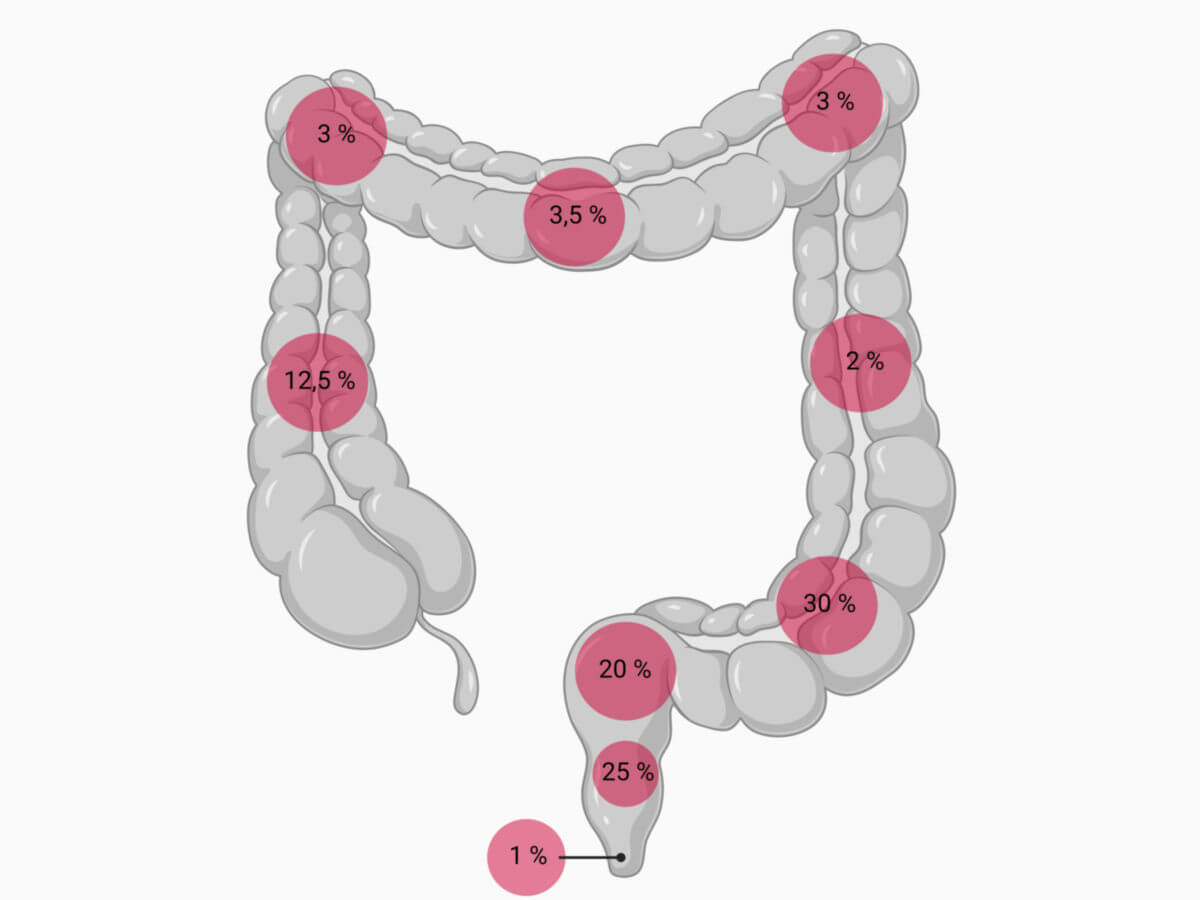
Am häufigsten treten kolorektale Karzinome im Bereich des Rektums (30 bis 50 %) und des Colon sigmoideum (18 bis 30 %) auf, in absteigender Häufigkeit sind auch Caecum und Colon ascendens (12 bis 18 %), sowie Colon transversum und descendens (2 bis 4 %) betroffen.
Da in bis zu 5 % d.F. mehrere Karzinome gleichzeitig auftreten können, ist im Rahmen einer Koloskopie immer eine Betrachtung des gesamten Kolons notwendig.
Aus der Lokalisation eines kolorektalen Karzinoms ergeben sich klinische Konsequenzen, insbesondere bei Rektumkarzinomen: Zum einen liegt das Rektum extraperitoneal, ferner unterliegt es einer besonderen Gefäßversorgung. Während die anderen Abschnitte des Colons ihr Blut aus den mesenterialen Gefäßen erhalten, erfolgt dies im Falle des Rektums über die Leistengefäße (Arteria iliaca interna); ebenso verhält es sich beim venösen Abfluß.
Metastasierung
Zum Zeitpunkt der Erstdiagnose eines kolorektalen Karzinom liegen bei etwa 25 % der Patienten bereits Fernmetastasen vor. Die Häufigkeit von Lymphknotenmetastasen bei T2-Karzinomen liegt bei ca. 10 bis 20 %.
Lokale Ausbreitung
Die lokale Ausbreitungstendenz wird maßgeblich durch die Lageverhältnisse zum Peritoneum bestimmt. In retroperitoneal gelegenen Darmabschnitten kann sich der Tumor per continuitatem in das angrenzende perirektale Fettgewebe ausbreiten. Liegt der Tumor in einem intraperitonealen Darmsegment, kann er durch die Adventitia und Serosa in die Bauchhöhle durchbrechen und Peritonealmetastasen absiedeln. Relativ selten kommt es zu einer Infiltration von Nachbarorganen wie der Harnblase oder des Dünndarms.
Hämatogene Metastasierung
Kolorektale Karzinome metastasieren hämatogen über die Mesenterialvenen und die Vena portae in die Leber, sekundär in die Lunge, in das Gehirn und in das Skelettsystem. Eine Ausnahme stellen Rektumkarzinome des unteren und z.T. des mittleren Drittels dar, die aufgrund der unterschiedlichen Abflussverhältnisse primär über die Vena cava inferior in die Lunge metastasieren.
Lymphogene Metastasierung
Die lymphogene Metastasierung der Kolonkarzinome erfolgt insbesondere über mesenteriale Lymphknoten. Das Metastasierungsverhalten wird dabei durch den Cannon-Böhm-Punkt bestimmt: Tumoren des Colon ascendens und Colon transversum nutzen die Abflusswege entlang der Arteria mesenterica superior und ihrer Äste, die des Colon descendens die Lymphgefäße entlang der Arteria mesenterica inferior. Rektumkarzinome des oberen Drittels breiten sich hingegen über paraaortale Lymphknoten aus. Rektumkarzinome des mittleren Drittels metastasieren zusätzlich über Lymphknoten der Beckenwand, die des unteren Drittels zusätzlich über inguinale Lymphknoten.
Diagnostik
Bis zu 10 % der KRK, insbesondere Tumore des tiefen Rektums, können bei digital-rektaler Untersuchung ertastet werden. Als Screening eignet sich der Stuhltest auf okkultes Blut (FOBT). Dabei wird eine Stuhlprobe laborchemisch untersucht und ggf. vorhandenes Hämoglobin nachgewiesen. Bei einem positiven Befund sollte sich eine endoskopische Untersuchung des gesamten Dickdarms anschließen.
Die Koloskopie mit Entnahme von Probebiopsien besitzt die höchste Sensitivität und Spezifität aller Untersuchungen und stellt somit den diagnostischen Goldstandard dar. Bei nicht durchführbarer Koloskopie (z.B. Verlegung des Darmlumens durch den Tumor) wird zunächst der zugängliche Darmabschnitt endoskopiert und eine virtuelle Koloskopie (CT-Kolonographie) durchgeführt. Innerhalb von 3 bis 6 Monaten nach der Operation sollte die Koloskopie nachgeholt werden.
Nebenbefundlich kann sich im Labor eine Tumoranämie zeigen, die zusätzlich durch einen Eisenmangel aufgrund von latenten Blutverlusten verstärkt werden kann.
Staging
Neben der Koloskopie sind zur Bestimmung des Tumorstadiums (Staging) und zur Therapieplanung folgende Untersuchungen erforderlich:
- Abdomen-Sonographie zur Suche nach Lebermetastasen (25 % der Patienten zum Diagnosezeitpunkt)
- Röntgen-Thorax in 2 Ebenen zur Suche nach Lungenmetastasen
- Bestimmung des Tumormarkers CEA als Ausgangswert zur Verlaufskontrolle und zur Erkennung von Rezidiven
- evtl. Computertomographie (CT) von Thorax, Abdomen und Becken
- evtl. Angio-CT der Leber
- immunhistochemische Diagnostik
Beim Rektumkarzinom sind weitere diagnostische Maßnahmen notwendig:
- starre Rektoskopie
- MRT-Becken (incl. DWI-Sequenz), siehe auch: Rektumkarzinom (MRT)
- rektale Endosonographie
Die Bestimmung von CA 19-9 wird derzeit (2025) nicht empfohlen.
Stadieneinteilung
Die Stadieneinteilung des kolorektalen Karzinoms erfolgt anhand der TNM-Klassifikation und der UICC-Einteilung. Die Dukes-Klassifikationen wird derzeit (2025) nicht mehr empfohlen.
| TNM | Beschreibung |
|---|---|
| Tis | Carcinoma in situ (Submukosa nicht betroffen) |
| T1 | Infiltration der Submukosa |
| T2 | Infiltration der Tunica muscularis |
| T3 | Infiltration der Subserosa (intraperitoneale Anteile) oder des perikolischen bzw. perirektalen Fettgewebes (sekundär retroperitoneale Anteile) |
| T4 | Infiltration des viszeralen Peritoneums (T4a) oder anderer Strukturen (T4b) |
| N1 | 1 - 3 regionäre Lymphknoten |
| N2 | 4 - 6 (N2a) bzw. über 7 regionäre Lymphknoten (N2b) |
| M1 | Fernmetastasen: ein Organ (M1a) bzw. mehrere Organe oder Peritonealkarzinose (M1b) |
| UICC-Stadium | TNM | |
|---|---|---|
| 0 | Tis | |
| I | bis T2, N0, M0 | |
| II | IIa | T3, N0, M0 |
| IIb | T4a, N0, M0 | |
| IIc | T4b, N0, M0 | |
| III | IIIa | bis T2, N1, M0 oder T1, N2a, M0 |
| IIIb | T3/T4, N1, M0 oder T2/T3, N2a, M0 oder T1/T2, N2b, M0 | |
| IIIc | T4a, N2a, M0 oder T3/T4a, N2b, M0 oder T4b, N1/N2, M0 | |
| IV | IVa | M1a |
| IVb | M1b | |
Histopathologie
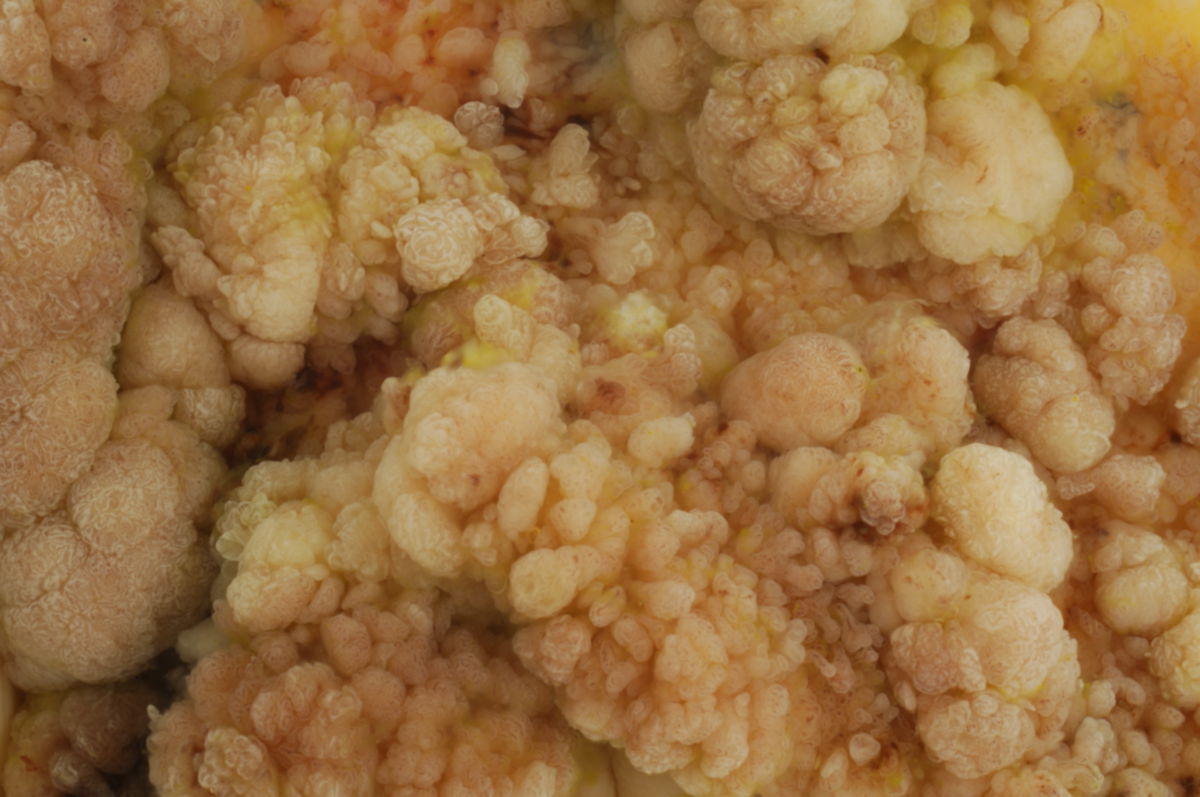
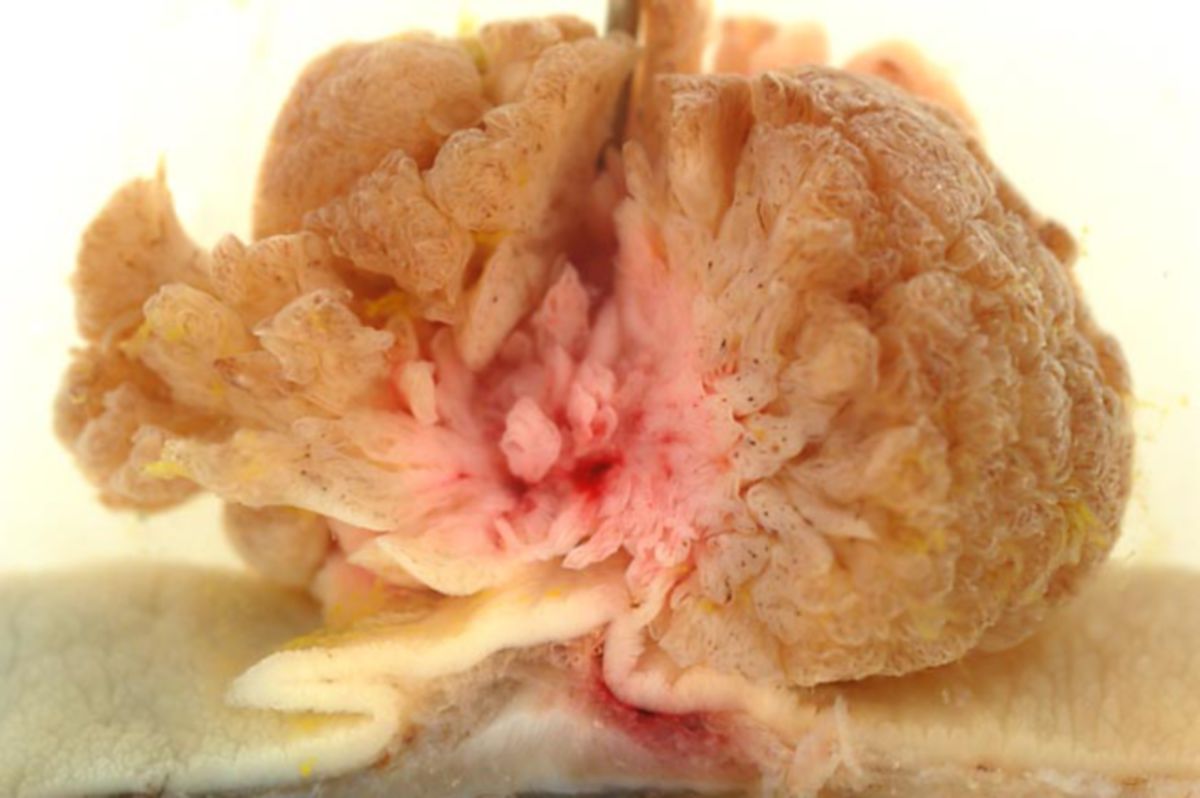
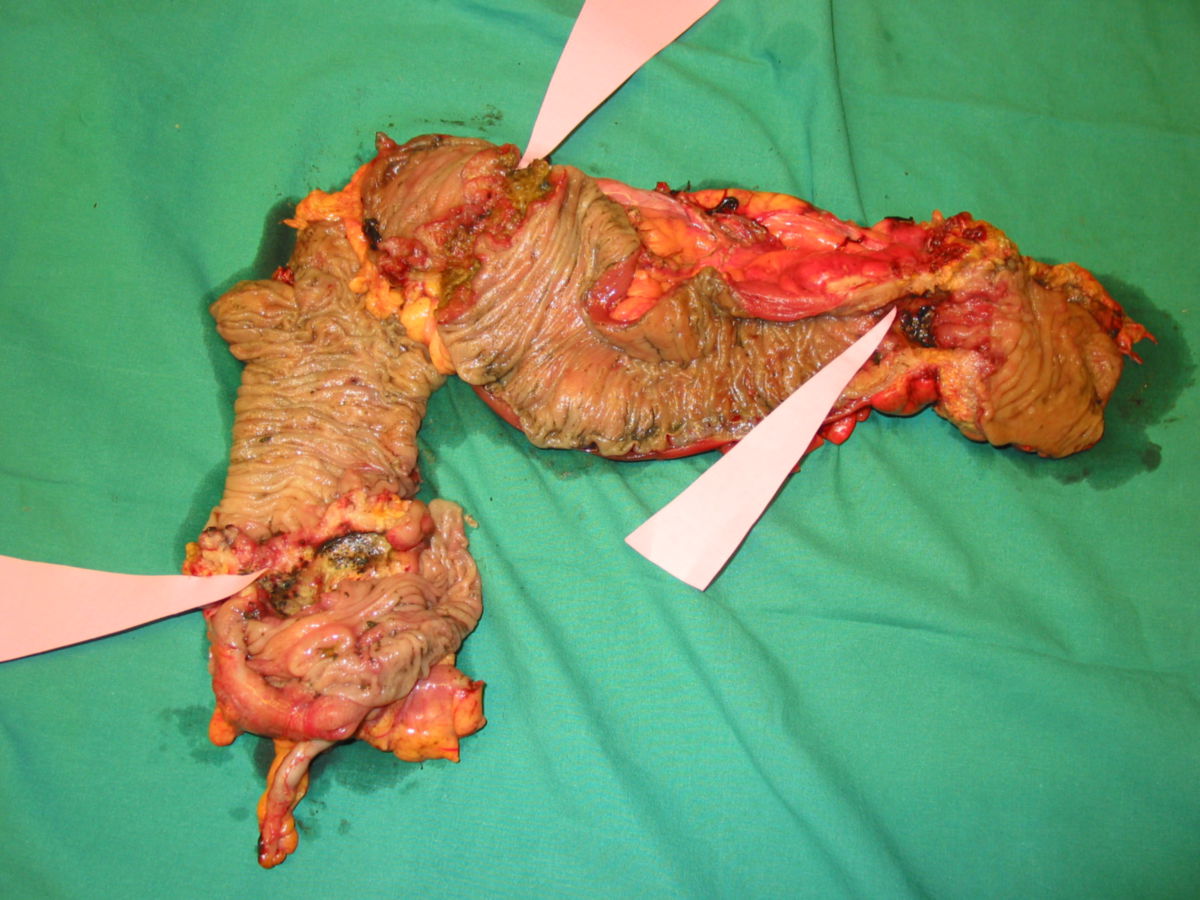
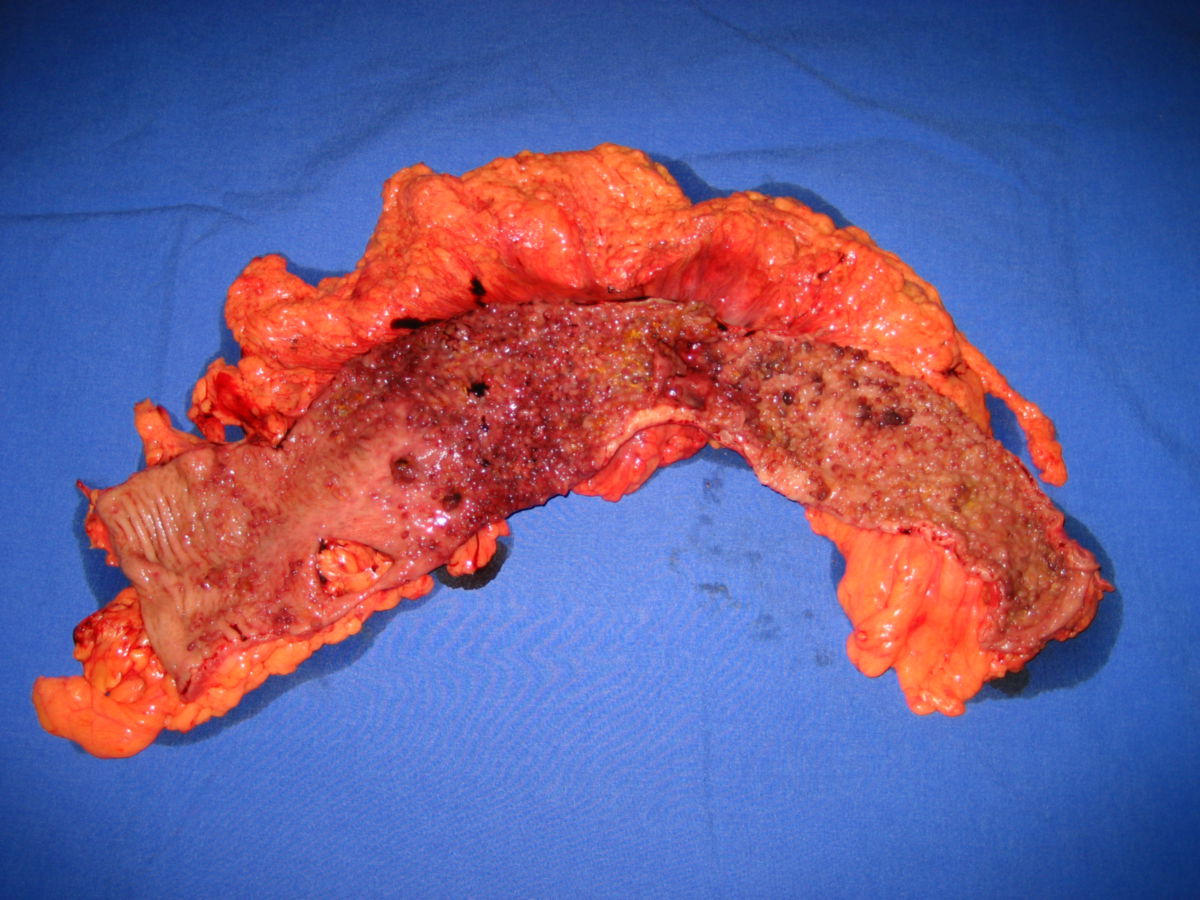
Makroskopisch unterscheidet man zwischen polypösen, ulzerösen, diffus wachsenden, infiltrierenden und szirrhösen KRK.
Histologisch sind 95 % der kolorektalen Karzinome Adenokarzinome (Adenom-Karzinom-Sequenz). Sehr seltene Sonderformen des kolorektalen Karzinoms sind:
- muzinöses Adenokarzinom ("Gallertkarzinom")
- Siegelringzellkarzinom
- kleinzelliges Karzinom
- adenosquamöses Karzinom
Andere kolorektale Tumore sind z.B. Karzinoide oder Lymphome.
Im Rahmen der Erstdiagnostik wird zudem untersucht, ob eine Mismatch-Reparatur-Defizienz bzw. eine Mikrosatelliten-Instabilität (MSI) vorliegt.[2] Dafür wird eine qualitätsgesicherte MSI/dMMR-Testung durchgeführt. Bei metastasierter Erkrankung kann die Bestimmung sowohl durch eine Biopsie des Primärtumors, als auch der Metastasen erfolgen.
Therapie
Je nach Stadium beinhaltet die Therapie initial eine primäre lokale chirurgische Sanierung, adjuvante und neoadjuvante Therapien sowie radioonkologische Verfahren.
Die Operation kann offen oder laparoskopisch durchgeführt werden. Art und Ausmaß der Resektion werden durch die Lokalisation, die versorgenden Gefäße und das entsprechende Lymphabflussgebiet vorgegeben. Die Operationstechnik ist abhängig von der Lokalisation des Primärtumors.[3] Onkologische Grundsätze für die Operation sind:
- Lymphadenektomie mit histologischer Beurteilung von mindestens 12 Lymphknoten im Abflussgebiet des Tumors
- angemessener Sicherheitsabstand zum gesunden Gewebe
- En-bloc-Resektion von tumoradhärenten Organen
- No-Touch-Technik zur Vermeidung einer intraoperativen Tumorzellverbreitung
Kolonkarzinom
Operative Therapie
Alle Patienten mit einem Kolonkarzinom, die keine oder operable Lungen- und/oder Lebermetastasen besitzen, werden durch eine offene Operation behandelt; vorausgesetzt es liegen keine allgemeinen Kontraindikationen für eine Operation vor. Essentieller Bestandteil der operativen Therapie ist die komplette mesokolische Exzision (CME).
| Lokalisation | Operation |
|---|---|
| Zäkum; Colon ascendens | Hemikolektomie rechts |
| rechte Flexur; Colon transversum (proximal) | erweiterte Hemikolektomie rechts |
| Colon transversum (mittleres Drittel) | Transversumresektion, ggf. erweiterte Hemikolektomie rechts |
| Colon transversum (distal); linke Flexur | erweiterte Hemikolektomie links |
| Colon descendens; Sigma (proximal) | Hemikolektomie links |
| Sigma (mittleres Drittel und distal) | onkologische Sigmaresektion |
Adjuvante Chemotherapie
Nach einer R0-Resektion des Primärtumors kann sich eine adjuvante Chemotherapie anschließen. Indikationen sind:[2]
- Stadium II: Monotherapie mit 5-Fluoruracil (5-FU)
- sollte bei Risikofaktoren (z.B. Notfall-OP, Tumorperforation, zu wenigen Lymphknoten im Resektat, T4-Stadium oder Nachweis zirkulierender Tumor-DNA)
- nicht bei Mikrosatellitenstabilität oder Mismatch-Reparatur-Defizienz
- Stadium III:
- FOLFOX (5-FU, Folinsäure, Oxaliplatin)
- XELOX (Capecitabin, Oxaliplatin)
Kontraindikationen sind beispielsweise eine schwere Herzinsuffizienz, eine Leberzirrhose (Child B oder C) oder eine terminale Niereninsuffizienz. Eine obere Altersbegrenzung existiert nicht, wobei nur wenige Daten für Patienten im Alter über 75 Jahre vorliegen. Für eine Objektivierung von Komorbiditäten wird der Einsatz von Instrumenten des Geriatrischen Assessment empfohlen.
Rektumkarzinom
Neoadjuvante Therapie
Eine neoadjuvante Therapie beim Rektumkarzinom in Form einer Radiatio oder einer Radiochemotherapie (mit 5-Fluoruracil oder Capecitabin) kann die Lokalrezidivrate um bis zu 50 % reduzieren, führt jedoch nicht zu einem signifikanten Überlebensvorteil.[4] Sie ist indiziert bei UICC-Stadium II und III bei Rektumkarzinomen im mittleren und unteren Drittel. Weiterhin kommt sie in Frage bei Tumoren des oberen Drittels, wenn zusätzliche Risikofaktoren vorliegen (z.B. ausgedehnter Lymphknotenbefall).
Eine präoperative Therapie ist nicht indiziert im UICC-Stadium I sowie in weiteren Ausnahmefällen.
Als totale neoadjuvante Therapie (TNT) wird derzeit ein neuer Behandlungsansatz bezeichnet, bei dem eine neoadjuvante Chemotherapie vor oder nach Radiochemotherapie erfolgt. Erst anschließend wird der Tumor reseziert. Diese Methode soll die Verträglichkeit und Compliance verbessern.[5] Sie ist bei Vorliegen bestimmter Risikokonstellationen empfohlen (z.B. T4-Tumoren, N2-Status, Tumoren mit bedrohtem oder befallenem mesorektalem Resektionsrand oder vergrößerten lateralen Lymphknoten).[2]
Operative Therapie
Standardtherapie des Rektumkarzinoms im unteren bzw. mittleren Rektumdrittel ist die tiefe anteriore Rektumresektion (TAR) und die totale mesorektale Exzision (TME).[6]
Bei Tumoren des oberen Rektumdrittels erfolgt eine anteriore Rektumresektion (AR) mit partieller mesorektaler Exzision (PME).[7]
Bei tiefem Sitz im distalen Rektumdrittel kann eine intersphinktäre Rektumresektion durchgeführt werden, solange der Sphinkter nicht infiltriert ist. Es handelt sich um eine Sphinkter-erhaltende Operationstechnik.[8]
Bei einer Infiltration des Sphinkters und/oder einem nicht gewährleistbarem Sicherheitsabstand erfolgt eine abdominoperineale Rektumexstirpation.[9]
Die laparoskopische Resektion kann bei geeigneten Tumoren ebenso wie offene Verfahren empfohlen werden. Bei einem Carcinoma in situ und ggf. im Stadium I ist weiterhin eine transanale Lokalexzision möglich.
Adjuvante Therapie
Nach einer Operation kann eine adjuvante Therapie erfolgen. Eine Radiochemotherapie ist indiziert bei Rektumkarzinomen ab Stadium II bei Vorliegen von Risikofaktoren für ein Lokalrezidiv (z.B. R1-Resektion) ansonsten ab Stadium III. Alternativ kann nach R0-Resektion im Stadium II oder III eine adjuvante Chemotherapie analog zum Kolonkarzinom erfolgen.
Therapie bei Metastasen
Operative Therapie
Bei R0-resektablen Metastasen der Leber oder Lunge ist eine kurative Behandlung möglich. Kriterien der Operabilität sind z.B.:[2]
- Befall von < 3 Lebervenen und < 7 Lebersegmente
- Ausschluss nicht resektabler, extrahepatischer / extrapulmonaler Metastasen
- > 30 % funktionsfähiges, residuales Lebergewebe postoperativ
- ausreichendes pulmonales Residualvolumen postoperativ
- R0-Resektion möglich
- ausreichender Sicherheitsabstand zu kritischen Lebergefäßen
- keine Leberinsuffizienz oder Leberzirrhose Child B oder C
- keine schwere Komorbidität
Lokalablative Therapie
Weiterhin kommen lokalablative Verfahren in Frage:
- Radiofrequenzablation: bei nicht resektablen Lebermetastasen oder Inoperabilität aufgrund eines schlechten Allgemeinzustandes
- Radioembolisation (SIRT): bei disseminierten Lebermetastasen, für die keine andere Therapieoption besteht
- Laserinduzierte interstitielle Thermotherapie (LITT): bei nicht resektablen Lebermetastasen
Systemische Therapie
Nach individueller Risikoabschätzung kann bei primär nicht resektablen Metastasen auch eine medikamentöse Behandlung erfolgen. Für die Erstlinientherapie kommen folgende Schemata in Frage:
- FOLFOX
- FOLFIRI (5-FU, Folinsäure, Irinotecan)
- FOLFOXIRI (5-FU, Folinsäure, Oxaliplatin, Irinotecan)
- XELOX
- ggf. Zugabe von Bevacizumab
Vor Therapieeinleitung sollte jedoch eine molekularbiologische Diagnostik erfolgen:
- Mutationsstatus für RAS und BRAF
- Mangel an Dihydropyrimidin-Dehydrogenase (DPYD*2A-Polymorphismus)
- Mikrosatellitenstatus
- HER2/neu-Status
Bei RAS-Mutation werden FOLFOX, FOLFIRI oder XELOX empfohlen. Bei RAS-Wildtyp und linksseitigem Primärtumor kann zusätzlich ein Anti-EGFR-Antikörper (Cetuximab, Panitumumab) verabreicht werden. Bei einer BRAF-Mutation wird i.d.R. FOLFOXIRI appliziert. Liegt eine Mikrosatellitenstabilität vor, kann die Erstlinienbehandlung je nach RAS-Status erfolgen, wobei später die Anwendung von Immuncheckpoint-Inhibitoren möglich ist.
Als Zweitlinientherapeutika werden z.B. Aflibercept, Ramucirumab, Trifluridin/Tipiracil und Regorafenib angewendet.
Palliative Therapie
Bei reduziertem Allgemeinzustand, der keine intensive Chemotherapie erlaubt, sowie im Stadium IVb liegt eine palliative Situation vor. Dabei kommen je nach Situation z.B. folgende Behandlungen in Frage:
- 5-Fluoruracil oder Capecitabin + Bevacizumab
- dosisreduzierte Chemotherapie (FOLFOX, FOLFIRI, XELOX), ggf. mit Bevacizumab
- Anti-EGFR-Monotherapie bei RAS-Wildtyp und Tumor im linksseitigen Kolon oder im Rektum
- transanale Lokalexzision zur Erleichterung der Defäkation
Experimentelle Therapien
Einen relativ neuen Therapieansatz zur Behandlung von kolorektalen Karzinomen mit Mismatch-Reparatur-Defizienz stellen PD-1-Hemmer dar. In einer kleinen klinischen Studie mit zunächst 12 therapienaiven Patienten konnte mit Dostarlimab bei allen Patienten eine vollständige Remission erreicht werden.[10] Die Phase-2-Studie schließt aktuell (Stand 09/2025) 41 Patienten ein. Bisher kam es nach 29 Monaten Nachbeobachtungszeit zu keiner Fernmetastasierung oder Lokalrezidiven.
Nachsorge
80 % der Rezidive treten in den ersten beiden Jahren nach Behandlung auf. Aus diesem Grund kommt der Nachsorge eine große Bedeutung zu. Je nach Stadium erfolgt eine regelmäßige Kontrolluntersuchung mit CEA-Bestimmung sowie die Durchführung einer Abdomensonographie und einer Koloskopie. Bei Rektumkarzinomen sind weiterhin regelmäßige Sigmoidoskopien und die Anfertigung eines Röntgen-Thorax obligat.
Sekundärprävention
Die wichtigste Vorsorgeuntersuchung ist die Koloskopie. Im Rahmen dieser Untersuchung können Vorstufen des kolorektalen Karzinoms (wie z.B. Darmpolypen) entfernt werden. Zur Früherkennung kolorektaler Karzinome wird ab dem 50. Lebensjahr alle zehn Jahre eine Koloskopie empfohlen. Ab April 2025 wird diese ab dem 50. Lebensjahr im Abstand von 10 Jahren von den gesetzlichen Krankenkassen (GKV) übernommen.
Bei vollständiger und unauffälliger Koloskopie sind im Intervall keine weiteren Maßnahmen notwendig. Personen, die eine Koloskopie ablehnen, kann alle 5 Jahre eine Sigmoidoskopie und zusätzlich ein jährlicher fäkaler okkulter Bluttest (FOBT) angeboten werden. Ein positives FOBT-Ergebnis macht eine endoskopische Untersuchung des gesamten Kolons erforderlich. Die Sigmoidoskopie wird derzeit (2025) nicht von der GKV erstattet.
Der immunologische FOBT (iFOBT) besitzt eine hohe Spezifität (> 90 %) und eine höhere Sensitivität im Vergleich zum früher verwendeten Guajak-Test (Hämoccult-Test, gFOBT). Da nicht alle kolorektalen Karzinome bluten, ist der FOBT zur Früherkennung eines Karzinoms grundsätzlich weniger geeignet als die Koloskopie.
Derzeit (2026) nicht zur Früherkennung empfohlene Verfahren sind:
- Kapselendoskopie
- genetische Stuhltests
- M2-PK-Stuhltest
- CT-Kolonographie, MR-Kolonographie
Inzwischen existiert ein weiterer Bluttest, der sog. Septin-9-Test. Er weist methylierte Septin-9-Gene (SEPT9) im Blutplasma mit Hilfe der Polymerasekettenreaktion (PCR) nach. Im Darmkrebsgewebe sind - in Gegensatz zur gesunden Dickdarmschleimhaut - die Cytosinreste des Septin-9-Gens methyliert. Anhand dieses tumorspezifischen Methylierungsmusters kann man zellfreie DNA erkennen, die von den Tumorzellen ins Blut abgegeben wird. Eine Bewertung dieser diagnostischen Methode seitens der deutschen Fachgesellschaften steht noch aus.
Bei Risikopersonen gelten besondere Richtlinien zur Vorsorge:
- Verwandte I° von Patienten mit KRK: komplette Koloskopie 10 Jahre vor dem Manifestationsalter beim Indexpatienten, spätestens im Alter von 40 bis 45 Jahren
- bei unauffälligem Befund: Wiederholung mindestens alle 10 Jahre
- Verwandte I° von Patienten mit Adenom, das vor dem 50. Lebensjahr entdeckt wurde: komplette Koloskopie 10 Jahre vor dem Zeitpunkt des Nachweises beim Indexpatienten
- bei unauffälligem Befund: Wiederholung mindestens alle 10 Jahre
- Verwandte I° von Patienten mit KRK mit Mikrosatellitenstabilität und nicht erfüllten Amsterdam-II-Kriterien für das Vorliegen eines HNPCC: Koloskopie alle 3 bis 5 Jahre
- genetische Vorbelastung (z.B. HNPCC, familiäre adenomatöse Polyposis): individuell
Werden in der Koloskopie Polypen sichtbar und diese abgetragen (Polypektomie), gelten spezielle Richtlinien zur Nachsorge. Beispielsweise beträgt das empfohlene Intervall bis zur Kontroll-Koloskopie < 3 Jahre, wenn über 5 Adenome nachgewiesen wurden.
Primärprävention
Maßnahmen zur Primärprävention sind:
- regelmäßige körperliche Aktivität
- Gewichtsnormalisierung
- Verzicht auf Nikotinkonsum
Aufgrund mangelhafter Datenlage kann keine spezifische Diätempfehlung zur Reduktion des KRK-Risikos gegeben werden. Jedoch sollten grundsätzlich folgende Aspekte beachtet werden:
- Ballaststoffaufnahme möglichst 30 g/d
- Alkoholkonsum limitieren
- rotes bzw. verarbeitetes Fleisch nur in geringen Mengen konsumieren
- obst- und gemüsereiche Kost (5 Portionen pro Tag; trotz uneindeutiger Datenlage)
Ein Zusammenhang zwischen Nahrungszubereitung oder Nahrungsfettkomponenten (z.B. Transfettsäuren) und KRK-Risiko besteht nicht. Auch eine Assoziation zur Aufnahme von Acrylamid konnte widerlegt werden. Die Einnahme von Supplementen von Vitaminen (incl. Ascorbinsäure und Folsäure), Kalzium, Magnesium und Selen sollte nicht erfolgen.
Zwar konnten Coxibe, Statine, Acetylsalicylsäure und eine Hormontherapie in einigen Studien einen protektiven Effekt zeigen, jedoch sind sie aufgrund der widersprüchlicher Datenlage und der potenziellen Nebenwirkungen nicht zur Prophylaxe des KRK geeignet.
Prognose
Die Prognose des kolorektalen Karzinoms ist abhängig von dem Tumorstadium, der Qualität der operativen Therapie und von weiteren Risikofaktoren. Beispielsweise beträgt beim Rektumkarzinom die 5-Jahres-Überlebensrate > 90 % im Stadium 0, 40 bis 50 % im Stadium III und < 5 % im Stadium IVb.
In den letzten Jahrzehnten konnte die Prognose aufgrund der Optimierung des chirurgischen Vorgehens sowie des Einsatzes einer Radiotherapie deutlich verbessert werden, sodass man aktuell beim Rektumkarzinom von einer stadienübergreifenden 5-Jahres-Gesamtüberlebensrate von über 70 % ausgeht.[11] Eine adjuvante Chemotherapie verbessert die Prognose im Stadium III und in ausgewählten Fällen im Stadium II.[12] Ausdauertraining nach der Chemotherapie verringert das Risiko eines Rezidivs um 50 bis 60 % und verbessert das Gesamtüberleben.
Podcast


tl;dr
Quiz
Literatur
- AWMF S3-Leitlinie Kolorektales Karzinom, 01.2019, abgerufen am 02.12.2019
- DGHO-Leitlinie Kolonkarzinom, Stand: 02.2022
- Ghadimi et al. Multimodale Therapie des Rektumkarzinoms, Deutsches Ärzteblatt, 2022
Quellen
- ↑ Brenner H, Schrotz-King P, Holleczek B, Katalinic A, Hoffmeister M. Declining Bowel Cancer Incidence and Mortality in Germany. Dtsch Arztebl Int. 2016 Feb 19;113(7):101-6. doi: 10.3238/arztebl.2016.0101. PMID: 26940777; PMCID: PMC4791563.
- ↑ 2,0 2,1 2,2 2,3 Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Kolorektales Karzinom, Langversion 3.0, 2025, AWMF-Registernummer: 021- 007OL. Zuletzt abgerufen am 30.09.2025
- ↑ Onkopedia-Leitlinie Kolonkarzinom, 10.2018, abgerufen am 03.12.2019
- ↑ Ulrich A. Chirurgie des Rektumkarzinoms: Update 2019, Dtsch Arztebl 2019; 116(23-24): [4], abgerufen am 03.12.2019
- ↑ Fokas E et al. Randomized Phase II Trial of Chemoradiotherapy Plus Induction or Consolidation Chemotherapy as Total Neoadjuvant Therapy for Locally Advanced Rectal Cancer: CAO/ARO/AIO-12, J Clin Oncol. 2019 Dec 1;37(34):3212-3222, abgerufen am 03.12.2019
- ↑ Dickdarmkrebs - Israelitisches Krankenhaus, abgerufen am 19.10.2021
- ↑ Rektumkarzinom — Onkopedia, abgerufen am 19.10.2021
- ↑ Klose et al. Onkologische und funktionelle Langzeitergebnisse nach intersphinktärer Rektumresektion bei Patienten mit tief sitzendem Rektumkarzinom, Zeitschrift für Gastroenterologie, 2015
- ↑ Barras et al. Welcher Patient braucht eine abdominoperineale Resektion?, Chirurgische Gastroenterologie, 1995
- ↑ Andrea Cercek et al.: PD-1 Blockade in Mismatch Repair–Deficient, Locally Advanced Rectal Cancer. New England Journal of Medicine June 5, 2022 DOI: 10.1056/NEJMoa2201445
- ↑ Neumann PA et al. Therapie des Rektumkarzinoms — ein Update, Gastro-News (2019) 6, pp.28-40
- ↑ Piringger, G.: Was ist "State of Art" in der adjuvanten Chemotherapie des Kolonkarzinoms? Können wir noch mehr tun? Skriptum 2020; 2: 16-18.
Bildquelle
- Bildquelle für Häufigkeitsverteilung kolorektaler Karzinome: Schumpelick V. et al., Kurzlehrbuch Chirurgie, 8. Auflage, Thieme-Verlag, 2010
- Bildquelle für Podcast: © Amelia Speight / Unsplash, © Jacob Rice / Unsplash
- Illustration: colon cancer by www.sciepro.com; CC BY-ND 4.0 DE
- Bildquelle für Flexikon-Quiz: © Los Muertos Crew / Pexels