Colitis ulcerosa
Englisch: ulcerative colitis
Definition
Die Colitis ulcerosa ist eine chronisch-entzündliche Darmerkrankung (CED). Sie ist durch den kontinuierlichen und systematischen Befall der Kolonschleimhaut von distal nach proximal gekennzeichnet.
Im Gegensatz zum Morbus Crohn, bei dem die gesamte Darmwand betroffen ist, handelt es sich bei der Colitis ulcerosa um eine Erkrankung, die in erster Linie den Dickdarm betrifft und hier nur von den oberen Wandschichten (Mukosa und Submukosa) ausgeht.
Epidemiologie
In Europa variiert die Inzidenz der Colitis ulcerosa zwischen 1 bis 58 Neuerkrankungen pro 100.000 Einwohner. Am häufigsten sind hellhäutige Menschen mit europäischer Abstammung betroffen. Es besteht ein Nord-Süd-Gefälle mit einer Häufung von Erkrankungen in Skandinavien.
In Deutschland und Frankreich beträgt die Inzidenz ungefähr 3 bis 5 pro 100.000 Einwohner pro Jahr.[1] Die Prävalenz beträgt 40 bis 80 pro 100.000 Einwohner.
Der Altersgipfel für die Erkrankung an Colitis ulcerosa liegt zwischen dem 2. und 4. Lebensjahrzehnt.
Ätiologie
Die Ätiologie der Colitis ulcerosa ist bislang (2026) nicht vollständig aufgeklärt. Am ehesten handelt es sich um eine multifaktoriell bedingte Erkrankung.
Genetische Einflüsse spielen eine Rolle, sind aber geringer ausgeprägt als beim Morbus Crohn. Genvarianten, die für eine Colitis prädisponieren bzw. ihren Verlauf beeinflussen, betreffen u.a. HLA-DRB1*1502[2], ECM1[3] und MUC2[4].
Im Vordergrund steht wahrscheinlich eine fehlgeleitete Immunantwort gegen körpereigene Komponenten (gestörte Autoimmunität) und/oder Teile des Darmmikrobioms. Treibend sind Barrierefunktionsstörungen der Mukosa mit verminderter Muzinproduktion und erhöhter Permeabilität der Schleimhaut. Dadurch kommt es zu einer Verlagerung mikrobieller Antigene in die Darmwand, die dort chronische Entzündungsprozesse triggern.
Weitere Einflussfaktoren sind die Ernährung, Störungen der Darmflora (Dysbiose), Medikamente, Infektionen und psychosomatische Faktoren. Eine Appendektomie hat einen protektiven Einfluss.
Zur Bedeutung des Nikotinkonsums gibt es widersprüchliche Ergebnisse. Während vor allem ältere Studien aus der niedrigeren Inzidenz bei Rauchern einen protektiven Effekt ableiten, zeigt ein neuere Studien mit großer Patientenkohorte, dass Raucher und Nichtraucher einen ähnlichen Krankheitsverlauf aufweisen und die negativen Effekte beim Rauchen überwiegen.[5]
Pathogenese
Pathologische Untersuchungen erlauben eine grobe Bestimmung der pathogenetischen Abläufe im Rahmen der Colitis ulcerosa. Diese läuft in drei Schritten ab:
- Aktivierung von T-Lymphozyten (TH2-Zellen) der Darmwand durch unbekannte Faktoren
- Bildung und Freisetzung von Entzündungsmediatoren
- lokale Gewebeschädigung mit Ulzerationen
Klassifikation
Die Colitis ulcerosa kann nach der Ausdehnung der Schleimhautläsionen nach der Montreal-Klassifikation in 3 Gruppen eingeteilt werden:
- E1: Proktitis
- E2: Linksseitenkolitis
- E3: Kolitis über die linke Kolonflexur hinaus ausgedehnt
Pathologie
Neuere Läsionen zeigen im Vergleich zu chronisch-fortgeschrittenen Läsionen unterschiedliche makroskopische und mikroskopische Veränderungen:
Akute Läsionen
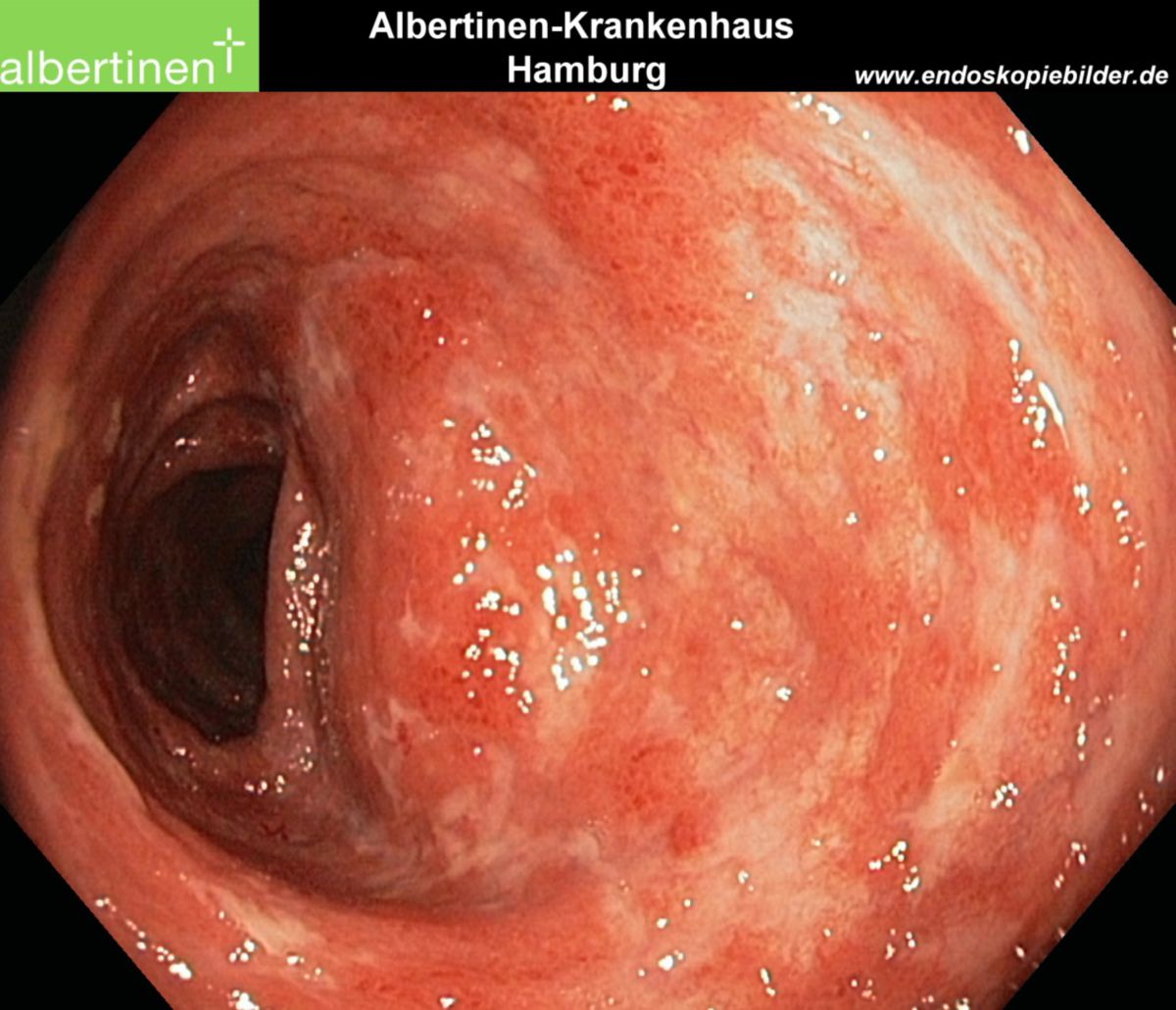
- Makroskopie: Entzündlich gerötete Schleimhaut, Kontaktblutungen, keine Ulzerationen, keine Fibrinbeläge
- Histologie: Begrenzung auf Mukosa und Submukosa, entzündliche Infiltration, Granulozytenanhäufung in den Krypten (Kryptenabszess), Rarefizierung der Becherzellen
Chronisch-fortgeschrittene Läsionen
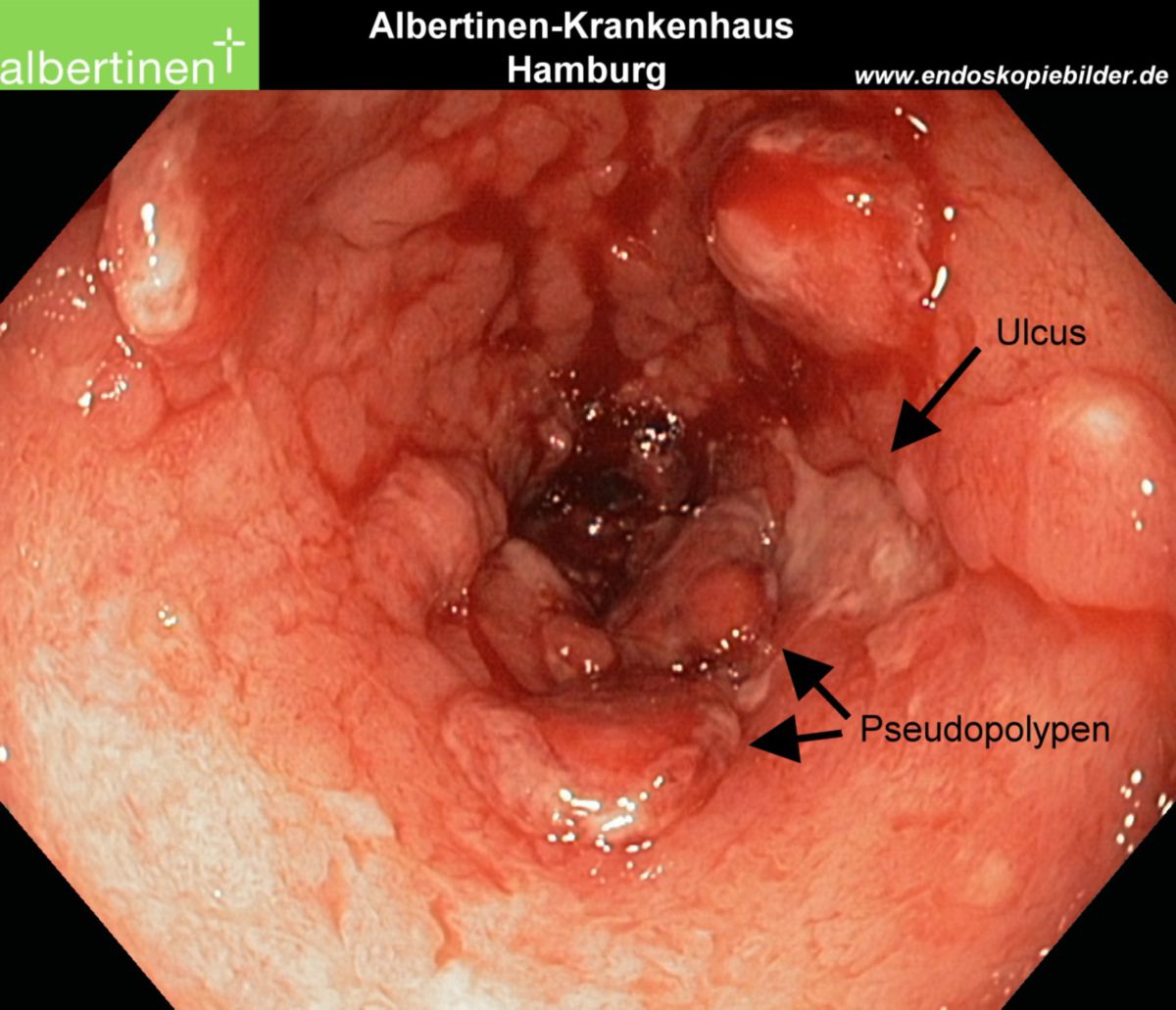
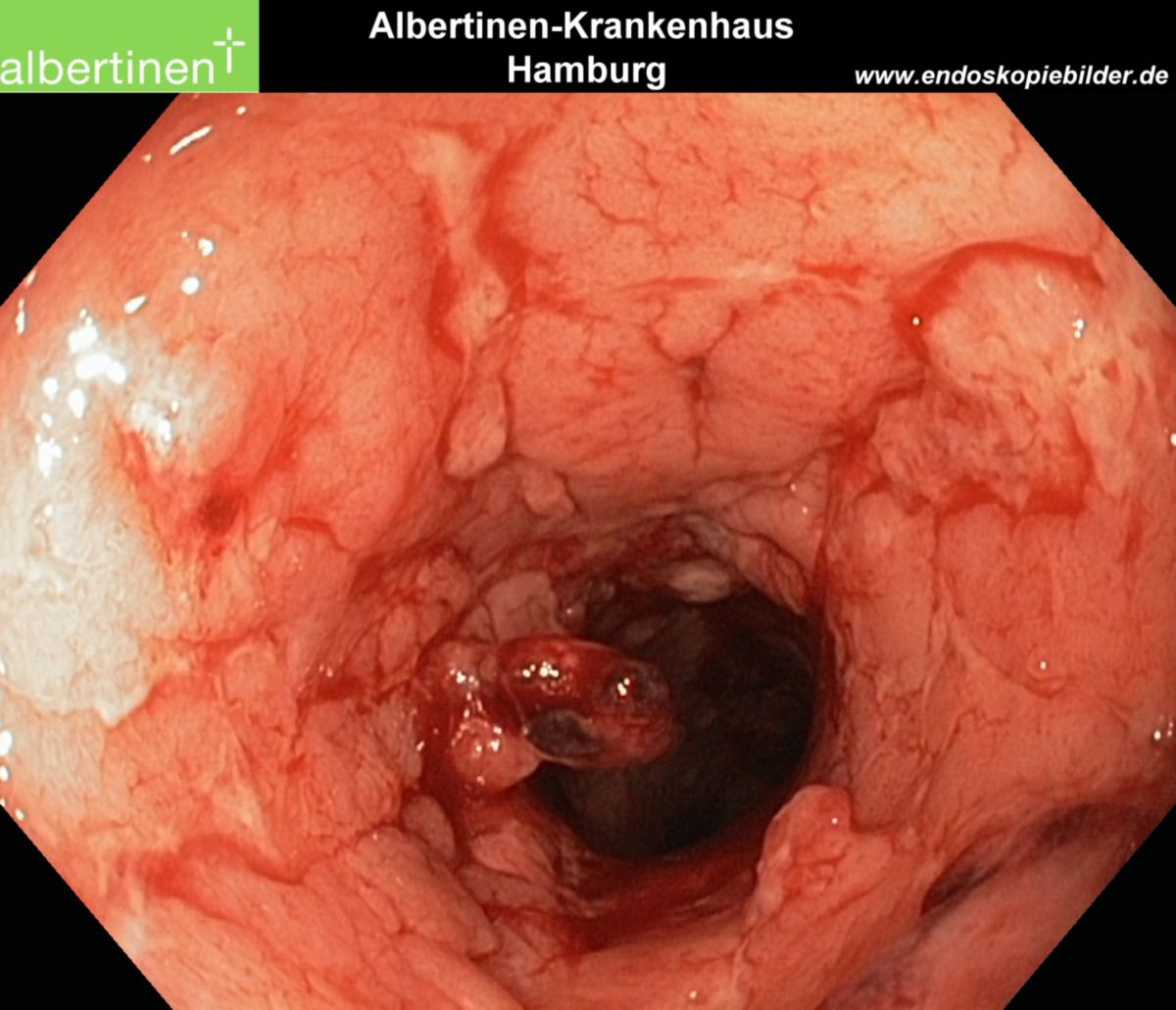
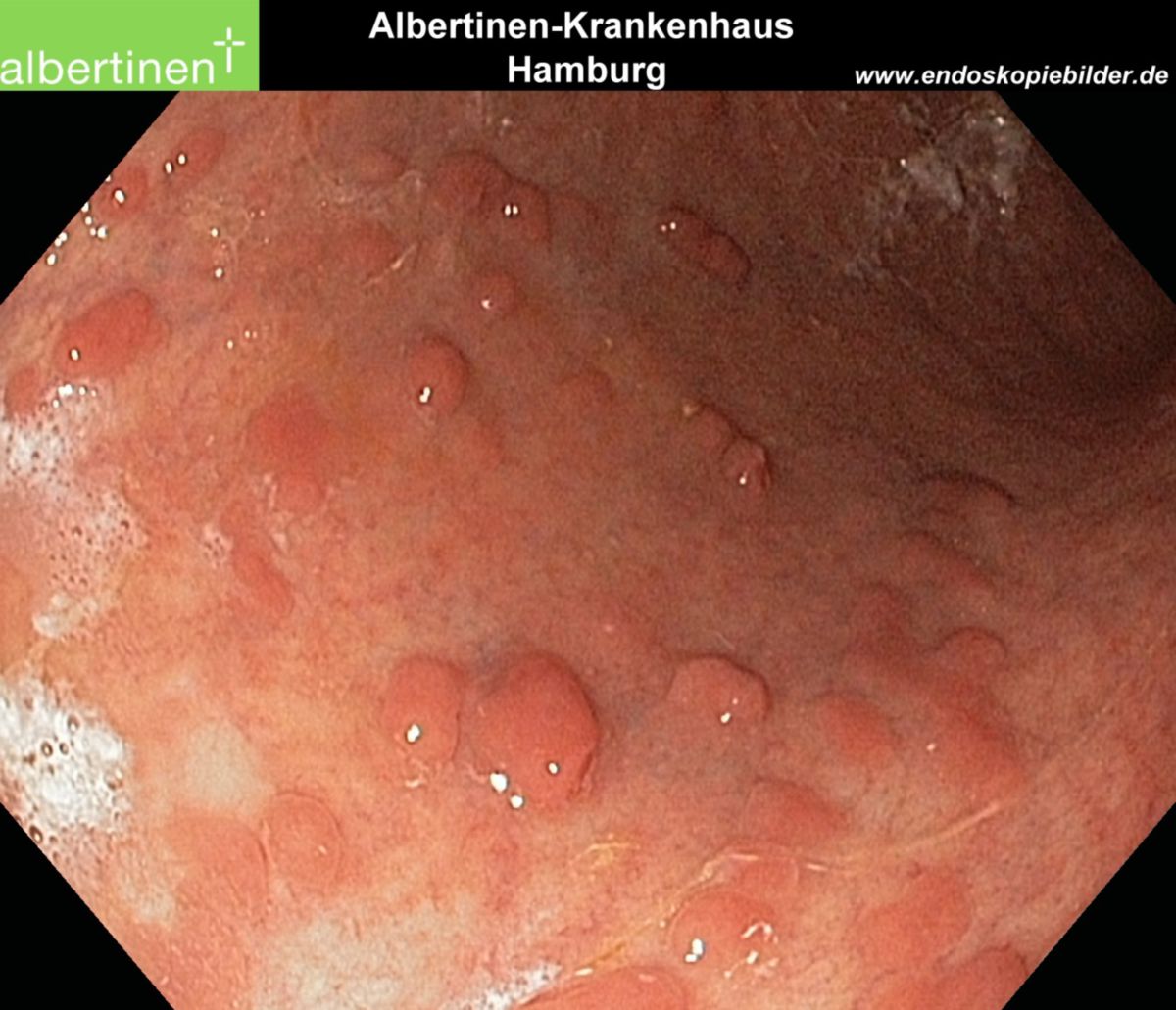
- Makroskopie: Ulzerationen, Schleimhautzerstörung, stehengebliebene Schleimhautareale erzeugen so genannte Pseudopolypen
- Histologie: Atrophie der Schleimhaut, Lymphozyten- und Histiozyteninfiltration, Krypten- und Becherzellverlust. Später Epitheldysplasien als Vorläufer einer malignen Entartung (Dysplasie des Epithels, Kolonkarzinom)
Lokalisation
Die Colitis ulcerosa ist zu Beginn der Erkrankung meistens im Rektum lokalisiert. Im Verlauf erfolgt eine Ausdehnung nach oral bis hin zur Pankolitis, der Entzündung des gesamten Colons.
Die Lokalisationshäufigkeit ist folgend verteilt:
- Proktitis: 15 %
- Zusätzlich bis zur linken Flexur: 40 %
- Zusätzlich Colon transversum: 25 %
- Pankolitis: 20 %
Symptomatik
Leitsymptom der Colitis ulcerosa sind blutig-schleimige Durchfälle, die ernährungsunabhängig und auch nachts auftreten. Sie sind häufig sehr quälend. Die Durchfälle gehen mit Tenesmen einher.
Je nach Schweregrad der Erkrankung sind Fieber und erhöhte Entzündungsparameter festzustellen. Manchmal geht eine Colitis ulcerosa mit kolikartigen Bauchschmerzen einher. Häufig ist bei der Colitis ulcerosa eine Gewichtsabnahme festzustellen.
Einteilung nach Schweregrad
Leichter Schub
- bis zu 5 blutig-schleimige Stuhlentleerungen/Tag
- kein Fieber
- kein herabgesetzter Allgemeinzustand (AZ)
Mittelschwerer Schub
- bis zu 8 blutig-schleimige Stuhlentleerungen/Tag
- Tenesmen
- Leichtes Fieber
Schwerer Schub
- über 8 blutig-schleimige Stuhlentleerungen/Tag
- hohes Fieber (>38°C)
- Tachykardie
- Druckschmerzhaftes Abdomen
- Schlechter AZ
Kriterien von Truelove und Witts
Indikatoren für einen schweren Schub sind nach Truelove und Witts:[6]
- schwere Diarrhö mit mindestens sechs makroskopisch blutigen Stühlen pro Tag
- Fieber (mittlere Abendtemperatur von über 37,5 °C oder Temperatur > 37,8 °C an mindestens zwei von vier Tagen)
- Tachykardie (Herzfrequenz über 90/min)
- Anämie mit Hämoglobinwert unter 75 % der Norm
- BSG über 30 mm/h
PUCAI-Score
Bei Kindern wird der PUCAI-Score angewendet, bei dem Bauchschmerzen, rektaler Blutabgang, Stuhlkonsistenz, Stuhlfrequenz, nächtlicher Stuhlgang und Aktivitätsbeeinträchtigung einfließen. Ein Wert von über 65 Punkten zeigt einen schweren Schub an.[7]
Mayo-Score
Der Mayo-Score setzt sich aus vier Parametern zusammen, die jeweils mit 0-3 Punkten bewertet werden. Er beurteilt die Stuhlfrequenz, Blutbeimengung im Stuhl, den endoskopischen Befund der Schleimhaut und die subjektive ärztliche Gesamteinschätzung der Krankheitsschwere.
Extraintestinale Manifestationen
- Haut: Aphthen, Erythema nodosum, Pyoderma gangraenosum
- Augen: Uveitis, Iritis, Episkleritis
- Gelenke: Arthritis, Morbus Bechterew (HLA-B27 positiv)
- Leber: primär sklerosierende Cholangitis (PSC)
- Herz: Perikarditis
- Lunge: z.B. Bronchiektasen
- Mundschleimhaut: Stomatitis aphthosa
siehe auch: Pulmonale Manifestationen bei CED
Verlaufsformen
Zu unterscheiden sind:
- chronisch-rezidivierender Verlauf: 80–85 %
- Exazerbationen durch physische und psychische Stresssituationen im Wechsel mit kompletter Remission
- 5-10% der Patienten bleiben nach einem einzigen Schub jahrelang beschwerdefrei
- chronisch-kontinuierlicher Verlauf: 10 %
- Beschwerden nehmen an Intensität zu oder ab, aber es kommt nicht zur Remission
- akuter fulminanter Verlauf: 5 %
- plötzlicher Krankheitsbeginn mit wässrigen Durchfällen, Tenesmen, hohem Fieber, Schocksymptomatik
| CAVE: Bei einem akuten fulminanten Verlauf kann bereits ein toxisches Megakolon vorliegen. Eine Koloskopie und der Kolonkontrasteinlauf sind daher wegen Perforationsgefahr kontraindiziert. Die Letalität liegt bei etwa 30 %. |
Komplikationen
Die Colitis ulcerosa kann zu Komplikationen führen und sich auch an anderen Organsystemen manifestieren:
- Toxisches Megakolon: Entzündung aller Darmwandschichten mit Dilatation des Kolons auf einen Durchmesser von > 10 cm (Gefahr der Perforation)
- CMV-Kolitis: Reaktivierung einer latenten Cytomegalievirus-Infektion in der entzündeten Kolonschleimhaut unter immunsuppressiver Therapie
- Wachstumsstörungen im Kindesalter
- Blutungen
- Gewichtsverlust
- Cholelithiasis: Bei bis zu 30 % der Colitis-Patienten treten durch die gestörte Rückresorption von Gallensäuren Gallensteine auf.
- Karzinom (> 10 % bei ausgedehnter Colitis und einer Erkrankungsdauer ab 20 Jahren)
Histologie
Diagnostik
- Anamnese und Klinik
- Digital-rektale Untersuchung
Labor
- Blutbild, CRP, BSG, γ-GT (Hinweis auf eine PSC)
- Autoantikörper: Häufig sind p-ANCA und Becherzell-Antikörper (BAK) nachweisbar, ferner ASCA
- Stuhl auf pathogene Keime (Mikrobiologie)
- Fäkale Neutrophilenmarker: Calprotectin oder Lactoferrin im Stuhl korrelieren mit dem Grad der Entzündung. Die Untersuchung dient der Abgrenzung zu nicht-entzündlichen Ursachen (z.B. Reizdarmsyndrom)
Endoskopie
Die wichtigste Untersuchung ist die Koloskopie mit Stufenbiopsie in mindestens 5 verschiedenen Kolonabschnitten einschließlich Rektum.
Da die Colitis-assoziierte Kolonkarzinommortalität durch eine endoskopische Überwachung gesenkt werden kann, sollten regelmäßige Überwachungskoloskopien erfolgen. Zur Festlegung der Überwachungsstrategie sollte 6-8 Jahre nach Diagnosestellung, unabhängig von der Krankheitsaktivität, eine Kontrollkoloskopie erfolgen. Dabei werden zur Erfassung des Befallmusters zumindest zwei Biopsien aus jedem Kolonsegment entnommen – zusätzlich zu gezielten Biopsien suspekter Bereiche. Die weitere Überwachungsstrategie wird individuell abgestimmt, wobei sich das Zeitintervall nach folgender Risikostratifizierung richtet:
| Untersuchungsintervall | Kriterien |
|---|---|
| jedes Jahr
(hohes Risiko) |
|
| alle 2–3 Jahre
(intermediäres Risiko) |
|
| alle 4 Jahre
(geringes Risiko) |
|
| alle 5 Jahre bei Proktitis |
|
Bei Dysplasie muss eine Bestätigung eines zweiten Pathologen, dann nach 6 Monaten eine erneute Kontroll-Koloskopie erfolgen. Ist dann immer noch eine Dysplasie vorhanden, ist dies eine Indikation zur prophylaktischen Kolektomie.
Sonographie
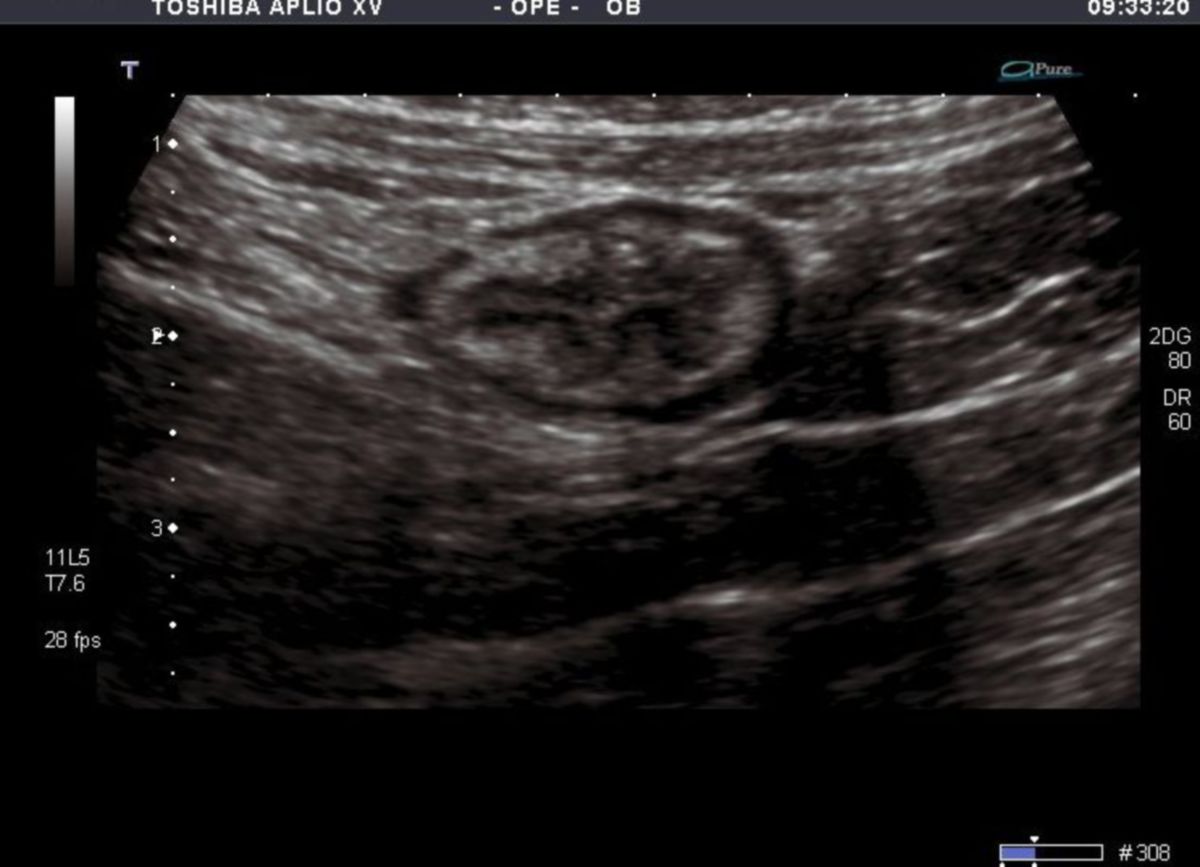
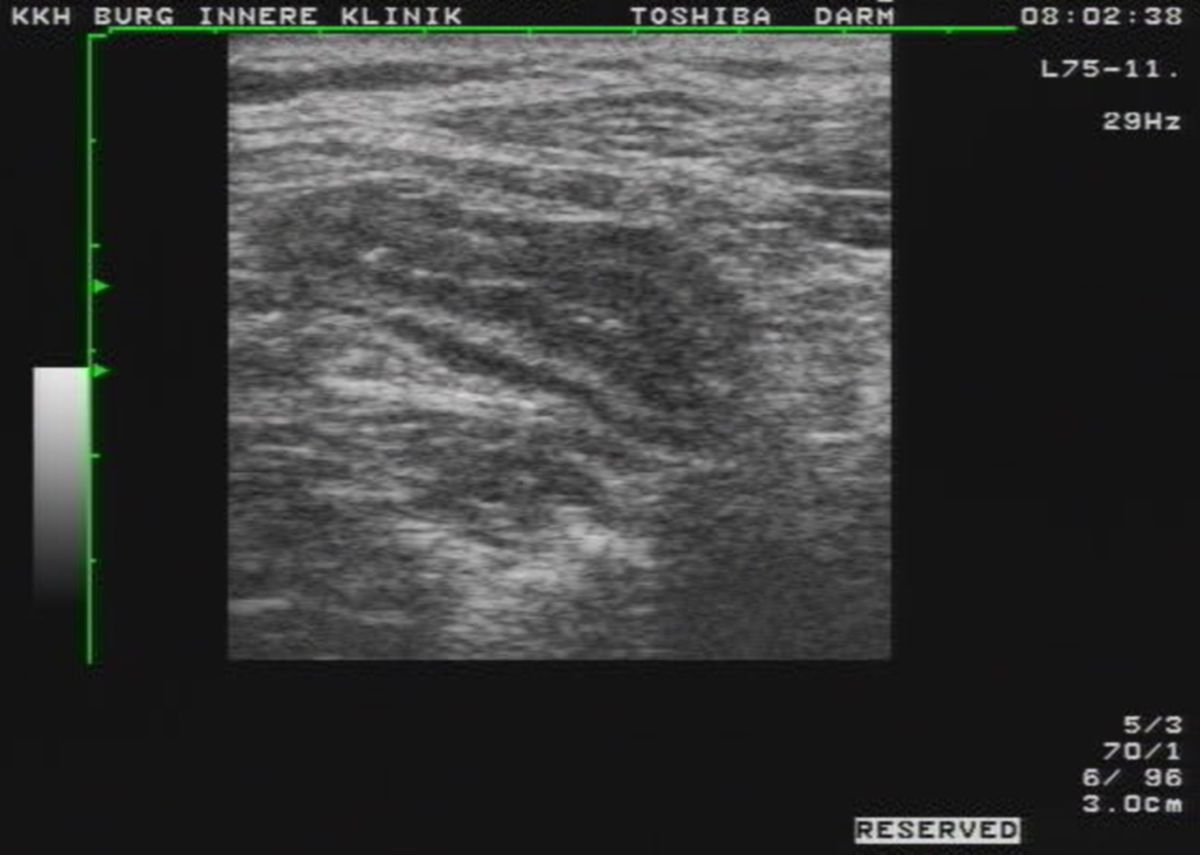
Die Darmsonographie ist ein zentrales, nicht-invasives und kostengünstiges Verfahren zur Beurteilung der Krankheitsaktivität und -ausdehnung. Sie eignet sich sowohl zur Erstdiagnose als auch zum Monitoring, insbesondere bei mittelschwerem bis schwerem Schub. Zudem können Komplikationen detektiert werden.
Entzündliche Veränderungen können mit einer Sensitivität von bis zu 90 % erfasst werden. Darmsonographische Parameter korrelieren gut mit der endoskopischen Aktivität und besitzen prognostische Aussagekraft. Frühe Veränderungen der Darmwanddicke – insbesondere der Submukosa – lassen sich bereits Stunden bis wenige Tage nach Therapieinduktion nachweisen und erlauben eine Vorhersage des klinischen Ansprechens.
Gemäß der Leitlinienempfehlungen (2025) sollte die Darmsonographie Bestandteil der Diagnostik bei Erstidagnose und zur Beurteilung des Therapieansprechens bei mittelschwerem und schwerem Schub sein.[8]
Differentialdiagnosen
- Infektiöse Kolitis:
- bakteriell: Campylobacter jejuni, Salmonellen, Shigellen, Staphylococcus aureus, enteropathogene Escherichia coli, pseudomembranöse Kolitis durch Clostridioides difficile (Antibiotikaanamnese)
- viral: Rotavirus, Norwalk-Virus, Adenovirus, Cytomegalievirus (CMV), Herpes simplex etc.
- parasitär: Lamblien, Kryptosporidien, Schistosomiasis, Malaria, Würmer, Pilze
- HIV-Infektion: opportunistische Infektionen (Kryptosporidien, Mikrosporidien, CMV ...),
- Vaskulär bedingte ischämische Kolitis:
- Strahlenkolitis (Bestrahlungsanamnese!)
- Andere Darmerkrankungen:
- beispielsweise Morbus Crohn, Divertikulitis, Kolonkarzinom, Reizdarmsyndrom, Nahrungsmittelunverträglichkeit, Morbus Whipple.
Differentialdiagnose Colitis ulcerosa vs. Morbus Crohn
Bei 10% der Betroffenen ist eine sichere Differenzierung vom Morbus Crohn nicht möglich ("indeterminierte Colitis") oder die anfängliche Diagnose muss später revidiert werden ("Konversionsfälle").
| Colitis ulcerosa | Morbus Crohn | |
|---|---|---|
| Lokalisation | Kolon | Gesamter Verdauungstrakt |
| Rektumbeteiligung | Immer | 20 % |
| Ileumbeteiligung | Selten ("backwash ileitis") | bis 80 % |
| Ausbreitung | Retikulär-kontinuierlich, von distal (Rektum) nach proximal | Diskontinuierlich von proximal (terminales Ileum) nach distal (Kolon) |
| Niveau | Schleimhaut | transmural |
| Klinik | Blutig-schleimige Durchfälle | Abdominalschmerzen und Durchfälle meist ohne Blut, evtl. tastbare Resistenz im rechten Unterbauch |
| Extraintestinale Symptome | Selten | Häufig |
| Typische Komplikationen | Toxisches Megakolon, Blutungen | Fisteln, Fissuren, Abszesse, Stenosen, Konglomerattumoren |
| Röntgen | Zähnelung, Pseudopolyposis, Haustren-Schwund → langes glattes Rohr ("Fahrradschlauch") | Fissuren, Pflastersteinrelief, segmentäre kurze Darmstenosen |
| Endoskopie | Diffuse Rötung, Vulnerabilität, Kontaktblutung, unscharf begrenzte Ulzerationen, Pseudopolypen | Aphthöse Läsionen, scharf begrenzte landkartenartige Ulzerationen mit "snail tracks", Stenosen, Fisteln, Pflastersteinrelief |
| Histologie | Mukosa, Submukosa: Kryptenabszesse, Becherzellverlust Spätstadium: Schleimhautatrophie, Epitheldysplasien |
Gesamte Darmwand und mesenteriale Lymphknoten: Epitheloidzellgranulome (40 %) Spätstadium: Fibrose |
Therapie
Die medikamentöse Therapie ist abhängig vom Schweregrad des Schubs und sollte nur durchgeführt werden, wenn eine Entzündung nachgewiesen wurde. Ziel ist eine möglichst schnelle und langanhaltende Remission der Beschwerden. Unterschieden werden eine remissionsinduzierende und eine remissionserhaltende Therapie. Die Remissionsinduktion wird angewandt bei neu diagnostizierter Colitis ulcerosa bzw. einem akuten Schub. Die Remissionserhaltung dient der dauerhaften Reduzierung der Schubfrequenz.
Den Patienten sollte zudem eine psychosomatische Begleitung sowie die Teilnahme an einer Selbsthilfegruppe angeboten werden.
Ein weiterer wichtiger Bestandteil der Behandlung einer Colitis ulcerosa ist die chirurgische Therapie. Diese hat insbesondere bei der kurativen Behandlung einen Stellenwert.
Remissionsinduktion
...der unkomplizierten Colitis ulcerosa
Bei einem Schub mit leichter bis mäßiger Aktivität ist Mesalazin (5-ASA) die Therapie der Wahl. Eingesetzt werden Suppositorien in einer Dosis von mindestens 1 g/d. Ein Vorteil für höhere Dosen ist nicht belegt. Äquivalente Alternativen sind Mesalazinschaum und Mesalazineinläufe. Bei Versagen der Monotherapie kann die rektale Mesalazinanwendung mit topischen Glukokortikoiden oder mit oraler Gabe von Mesalazin kombiniert werden.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
...der Linksseitencolitis
Bei einer leichten bis mäßig schweren linksseitigen Colitis ulcerosa wird Mesalazin rektal in einer Dosis von mindestens 1 g/d in Kombination mit oralem Mesalazin (mindestens 3 g/d, vorzugsweise als Einmaldosis) eingesetzt. Wenn die Symptome nicht auf diese Kombinationstherapie ansprechen, kann eine systemische Steroidgabe (0,5 bis 1 mg/kg Körpergewicht pro Tag Prednisolonäquivalent) begonnen werden. Bei unzureichendem Ansprechen oder Unverträglichkeit gegenüber Mesalazin kann Budesonid 9 mg/d eingesetzt werden.
...bei ausgedehntem Befall
Bei einem ausgedehnten Befall mit leichter bis mäßiger Aktivität wird orales Mesalazin (mindestens 3 g/d) mit Mesalazineinläufen bzw. Mesalazinschäumen kombiniert. Wenn die Symptome hierauf nicht ansprechen oder bereits bei Diagnosestellung eine schwere Colitis ulcerosa vorliegt, wird eine systemische Steroidtherapie begonnen (0,5 bis 1 mg/kg Körpergewicht pro Tag Prednisolonäquivalent).
...der komplizierten Colitis ulcerosa
Bei einem schweren akuten Schub einer Colitis ulcerosa sollte der Patient stationär aufgenommen und zur weiteren Therapieplanung ein Abdominalchirurg konsultiert werden. Eine Behandlung mit systemischen Steroiden (zum Beispiel 1 mg/kg Körpergewicht Prednisolonäquivalent pro Tag) ist in der Regel indiziert.
Bei Kontraindikationen zur Steroidtherapie oder bei einem fehlenden Ansprechen (steroidrefraktärer Verlauf) kommen folgende Alternativen infrage:
| Krankheitsaktivität | Therapie |
|---|---|
| mittelschwer bis schwer |
|
| fulminant |
|
Weiterhin sollten bei steroidrefraktärem Verlauf oder unzureichendem Ansprechen auf eine andere medikamentöse Therapie Infektionen mit Clostridioides difficile oder Cytomegalievirus ausgeschlossen werden.
Bei Kindern und Jugendlichen wird Methylprednisolon einmal täglich (1 bis 2 mg/kg Körpergewicht pro Tag) intravenös gegeben. Bis zu 40 % der Kinder sprechen jedoch nicht auf die initiale Therapie an und benötigen eine Eskalation mit Infliximab oder Ciclosporin. Alternativ ist ebenfalls eine Kolektomie zu diskutieren.
Adjuvant sind engmaschige Laborkontrollen, Physiotherapie, psychotherapeutische Betreuung, parenteraler Flüssigkeits- und Elektrolytausgleich, Ernährungstherapie sowie eine Thromboseprophylaxe mit niedermolekularem Heparin notwendig. Alle motilitätshemmenden oder potenziell die Mukosa schädigenden Medikamente müssen abgesetzt werden.
...bei steroidabhängigem Verlauf
Bei einer steroidabhängigen Colitis ulcerosa kann eine Therapie mit einem Thiopurin, TNF-Hemmer, (bzw. Infliximab plus Thiopurin), Vedolizumab, Tofacitinib oder Ustekinumab eingesetzt werden. Kommt es darunter nicht zu einem Ansprechen, ist eine Gabe von Calcineurininhibitoren oder eine Proktokolektomie zu erwägen.
Remissionserhaltung
...bei primär unkomplizierter Colitis ulcerosa
Wenn ein Ansprechen auf Aminosalizylate oder Steroide besteht, sollen 5-Aminosalizylate auch als remissionserhaltende Therapie eingesetzt werden. Die Applikationsform richtet sich nach dem Befallsmuster. Proktitis und die linksseitige Colitis werden dabei primär rektal therapiert. Eine Kombination von oralen und rektalen 5-Aminosalizylaten kann als Zweitlinientherapie verwendet werden. Bevorzugt wird eine tägliche Einmalgabe. Aufgrund des Nebenwirkungsprofils sollte Mesalazin gegenüber Sulfasalazin bevorzugt werden. Die Remissionserhaltung wird mindestens zwei Jahre durchgeführt. Eine Langzeittherapie kann im Hinblick auf eine Karzinomprävention angeboten werden. Eine mögliche Alternative zu Aminosalizylaten ist der Einsatz des apathogenen Escherichia coli-Stamm Nissle 1917.
Bei erneuten Schüben muss die remissionserhaltende Therapie eskaliert werden:
- Dosiseskalation einer oralen/rektalen Kombinationstherapie mit Aminosalizylaten
- TNF-Hemmer: Infliximab, Adalimumab, Golimumab
- Vedolizumab
- Thiopurine: Azathioprin, 6-Mercaptopurin
Kortikosteroide sollen zur Remissionserhaltung nicht eingesetzt werden.[8]
...bei kompliziertem Verlauf
Nach Remissionsinduktion werden bei Patienten mit milder bis moderater Aktivität Thiopurine eingesetzt, wenn unter 5-Aminosalizylaten gehäuft und früh erneute Schübe auftreten oder eine Unverträglichkeit besteht. Auch ein steroidabhängiger Verlauf oder ein Ansprechen auf eine remissionsinduzierende Therapie mit Ciclosporin oder Tacrolimus sind Indikationen für einen Remissionserhalt mit Thiopurinen.
Bei Patienten, die auf eine Therapie mit TNF-Antikörpern ansprechen, wird diese Therapie fortgesetzt und gegebenenfalls mit einem Thiopurin kombiniert. Auch bei Patienten, die auf Vedolizumab, Tofacitinib oder Ustekinumab ansprechen, wird die Remissionserhaltung mit dem gleichen Präparat fortgesetzt.
Methotrexat, Ciclosporin und Tacrolimus sollten zur Remissionserhaltung nur in Ausnahmesituationen eingesetzt werden. Bei Einsatz von Calcineurininhibitoren sind regelmäßig Spiegelbestimmungen durchzuführen.
Zur genauen Dauer der Remissionserhaltung kann aufgrund fehlender Evidenz aktuell (2025) keine Empfehlung ausgesprochen werden, es kommt jedoch häufig zu einer langfristigen Therapie.
Optimierung der Anti-TNF-Antikörper-Therapie
- Nicht nachweisbarer Spiegel oder erniedrigter Talspiegel, aber keine Anti-Drug-Antikörper (ADA): Dosierungserhöhung oder Intervallverkürzung der Therapie
- Nicht nachweisbarer Talspiegel und hohe ADA-Spiegel: Therapiewechsel innerhalb der Antikörper-Klasse im Falle eines vorangegangen primären Ansprechens auf die Therapie
- Ausreichend hoher Spiegel bei fehlender Wirkung: Therapiewechsel, idealerweise in eine andere Therapieklasse
- Primäres Wirkversagen der Anti-TNF-Therapie: Wechsel der Therapieklasse
Chirurgische Therapie
Die Standardoperation bei therapierefraktärer Colitis ulcerosa oder maligner Entartung ist eine restaurative Proktokolektomie mit ileoanalem Pouch und protektivem Ileostoma. Der Pouch ermöglicht den Erhalt der Kontinenz bei über 90 % der Patienten mit durchschnittlich fünf bis sechs Stuhlgängen pro Tag. Die Operation kann damit zu einer Verbesserung der Lebensqualität führen. Die zweizeitige Anlage des protektiven Stomas ist der Regelfall, eine einzeitige Operation erfolgt nur in Ausnahmefällen.
Beim zweizeitigen Vorgehen wird während der Proktokolektomie ein Rektumstumpf zum Erhalt des Sphinkterapparates belassen. Als Rektumersatz bzw. Stuhldepot wird ein Dünndarmbeutel (ileoanaler Pouch) eingesetzt. Das freie proximale Darmende wird in ein protektives Ileostoma ausgeleitet. In einer zweiten Operation (meist nach etwa 3 Monaten) wird der Anus praeter dann zurückverlagert. Ein J-Pouch ist dabei die Konstruktion der Wahl.
Bei erhöhtem perioperativem Risiko kann die Proktokolektomie auch dreizeitig durchgeführt werden. Dabei erfolgt die Kolektomie bis zum rektosigmoidalen Übergang.
Notfallindikationen für eine Operation sind eine freie oder gedeckte Perforation. Aufgrund der immunsuppressiven Therapie werden die Symptome oft maskiert, sodass eine Operation vor Eintreten septischer Komplikationen durchgeführt werden sollte. Trotz operativer Therapie beträgt die Mortalität bis zu 27 %. Standardeingriff ist eine Kolektomie mit Blindverschluss des Rektums und endständiger Ileostomie.
Eine schwere Blutung bei Colitis ulcerosa ist für bis zu 5 % der Notfalleingriffe verantwortlich. Operationsindikationen sind eine massive intiale Blutung mit Kreislaufinstabilität und Katecholaminpflichtigkeit oder eine fortgesetzte Transfusionspflichtigkeit von mehr als vier Erythrozytenkonzentraten pro 24 Stunden. Bei Kindern gelten andere Kriterien. Standardeingriff ist eine subtotale Kolektomie mit Absetzung im oberen Rektum.
Bei medikamentös therapierefraktärem fulminantem Schub sollte nach maximal fünf bis sieben Tagen eine Operation durchgeführt werden. Bei einer Verschlechterung unter der Therapie besteht eine dringliche Operationsindikation innerhalb von 24 Stunden. Liegt ein toxisches Megakolon vor, beträgt das Zeitfenster einer konservativen Therapie 48 bis maximal 72 Stunden.
Weitere Indikationen für eine operative Therapie sind Kinder und Jugendliche mit aktiver Colitis und Wachstumsstörungen trotz adäquater Therapie nach Ausschluss anderer Ursachen.
Management der infektiologischen Komplikationen
Bei der Therapie mit immunsuppressiven Medikamenten steigt das Risiko für Infektionen, insbesondere bei älteren Patienten, Komorbiditäten sowie Mangelernährung. Daher muss bei Erstdiagnose und spätestens vor Beginn einer Therapie bei allen Patienten ein Screening auf Hepatitis B, EBV und Tuberkulose inklusive ausführlicher Anamnese, Röntgenaufnahme der Lunge und Interferon-gamma-Release-Assay durchgeführt werden.
Des Weiteren muss der Impfstatus überprüft und aktualisiert werden. Impfungen sollten analog zu den Empfehlung des RKI für Patienten mit Immunsuppression durchgeführt werden. Lebendimpfungen sind kontraindiziert. Dies gilt auch für eine Rotavirus-Impfung bei Neugeborenen deren Mütter in der Schwangerschaft TNF-Hemmer eingenommen haben.
Bei Patienten mit dreifacher immunsuppressiver Therapie, kann eine Pneumocystis jiroveci-Prophylaxe sinnvoll sein. Auf eventuelle Infektionen mit CMV und VZV sollte geachtet werden. Im Falle eines schweren akuten Schubs, atypischer Symptomatik und therapierefraktärem Verlauf ist zudem vor der Therapieeskalation möglichst zeitnah eine mikrobiologische Diagnostik bzw. ein Ausschluss von Clostridioides difficile notwendig. EBV-seronegative Patienten sollten nicht mit Thiopurinen behandelt werden.
Wurmtherapie
In klinischen Studien hat die bewusste Infektion mit bestimmten Peitschenwürmern (Trichuris trichiura) bzw. Schweinepeitschenwürmern (Trichuris suis) eine Remission bewirkt. Der Effekt wird auf eine erhöhte Produktion von Interleukin-22 zurückgeführt. Die Wurmtherapie ist zurzeit (2025) in Deutschland kein überprüftes, klinisches Standardverfahren.
Phytotherapie
Zur Remissionserhaltung können folgende Phytotherapeutika komplementär eingesetzt werden. Die Evidenz für diese Therapiemaßnahmen ist jedoch gering.
- Flohsamen[9]
- Curcumin[10][11]
- Kombination aus Myrrhe, Kamillenblütenextrakt und Kaffeekohle[12]
Prognose
- Ausschließlicher Rektumbefall: keine Einschränkung der Lebenserwartung
- Pankolitis: 5-Jahres-Überlebensrate > 80 %
Das Sterblichkeitsrisiko ist insgesamt um den Faktor 1,7 höher als bei Gesunden. Ein Kolonkarzinom tritt nur bei totalem oder subtotalem Befall auf, das Risiko liegt etwa bei 6 %.
| MERKE: Die Colitis ulcerosa ist durch Kolektomie heilbar! Bei Versagen der konservativen Therapie sollte daher eine Operation in Erwägung gezogen werden! |
Podcast

Quiz
Leitlinie
Literatur
- Turner D et al. Management einer akuten schweren Colitis ulcerosa bei Kindern, Consensus for Managing Acute Severe Ulcerative
- Colitis in Children: A Systematic Review and Joint Statement From ECCO, ESPGHAN, and the Porto IBD Working Group of ESPGHAN, Am J Gastroenterol 2011; 106:574–588, abgerufen am 08.07.2019
Weblinks
Quellen
- ↑ Zeissig, S., Bokemeyer, B.: Colitis ulerosa - aktuelles klinische Management. MedLearning. München 2018. VNR 2760909008133330011|Gültigkeitsdauer: 01.10.2018-01.10.2019.
- ↑ Futami S, Aoyama N, Honsako Y, Tamura T, Morimoto S, Nakashima T, Ohmoto A, Okano H, Miyamoto M, Inaba H, et al. HLA-DRB1*1502 allele, subtype of DR15, is associated with susceptibility to ulcerative colitis and its progression. Dig Dis Sci. 1995 Apr;40(4):814-8. doi: 10.1007/BF02064985. PMID: 7720475.
- ↑ Fisher SA et al: Wellcome Trust Case Control Consortium; Lobo A, Forbes A, Sanderson J, Jewell DP, Mansfield JC, Deloukas P, Mathew CG, Parkes M, Satsangi J. Genetic determinants of ulcerative colitis include the ECM1 locus and five loci implicated in Crohn's disease. Nat Genet. 2008 Jun;40(6):710-2. doi: 10.1038/ng.145. Epub 2008 Apr 27. PMID: 18438406; PMCID: PMC2719289.
- ↑ Van der Sluis M, De Koning BA, De Bruijn AC, Velcich A, Meijerink JP, Van Goudoever JB, Büller HA, Dekker J, Van Seuningen I, Renes IB, Einerhand AW. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology. 2006 Jul;131(1):117-29. doi: 10.1053/j.gastro.2006.04.020. PMID: 16831596.
- ↑ Blackwell et al., The impact of smoking and smoking cessation on disease outcomes in ulcerative colitis: a nationwide population-based study, Aliment Pharmacol Ther, 2019
- ↑ Truelove SC, Witts LJ, Cortisone in ulcerative colitis; final report on a therapeutic trial, Br Med J. 1955 Oct 29;2(4947):1041-8, abgerufen am 08.07.2019
- ↑ Turner D et al. Development, validation, and evaluation of a pediatric ulcerative colitis activity index: a prospective multicenter study, Gastroenterology. 2007 Aug;133(2):423-32. Epub 2007 May 21, abgerufen am 08.07.2019
- ↑ 8,0 8,1 Blumenstein et al.: Aktualisierte S3-Leitlinie Colitis ulcerosa (Version 7.0), AWMF-Registriernummer 021-009, Stand November 2025. Zuletzt abgerufen am 25.11.2025
- ↑ Fernández-Bañares F et al. Randomized clinical trial of Plantago ovata seeds (dietary fiber) as compared with mesalamine in maintaining remission in ulcerative colitis. Spanish Group for the Study of Crohn's Disease and Ulcerative Colitis (GETECCU), Am J Gastroenterol. 1999;94(2):427‐433, abgerufen am 20.05.2020
- ↑ Hanai H et al. Curcumin Maintenance Therapy for Ulcerative Colitis: Randomized, Multicenter, Double-Blind, Placebo-Controlled Trial, Clin Gastroenterol Hepatol. 2006;4(12):1502‐1506, abgerufen am 20.05.2020
- ↑ Lang A et al. Curcumin in Combination With Mesalamine Induces Remission in Patients With Mild-to-Moderate Ulcerative Colitis in a Randomized Controlled Trial, Clin Gastroenterol Hepatol. 2015;13(8):1444‐9.e1, abgerufen am 20.05.2020
- ↑ Langhorst J et al. Randomised Clinical Trial: A Herbal Preparation of Myrrh, Chamomile and Coffee Charcoal Compared With Mesalazine in Maintaining Remission in Ulcerative Colitis--A Double-Blind, Double-Dummy Study, Aliment Pharmacol Ther. 2013;38(5):490‐500, abgerufen am 20.05.2020