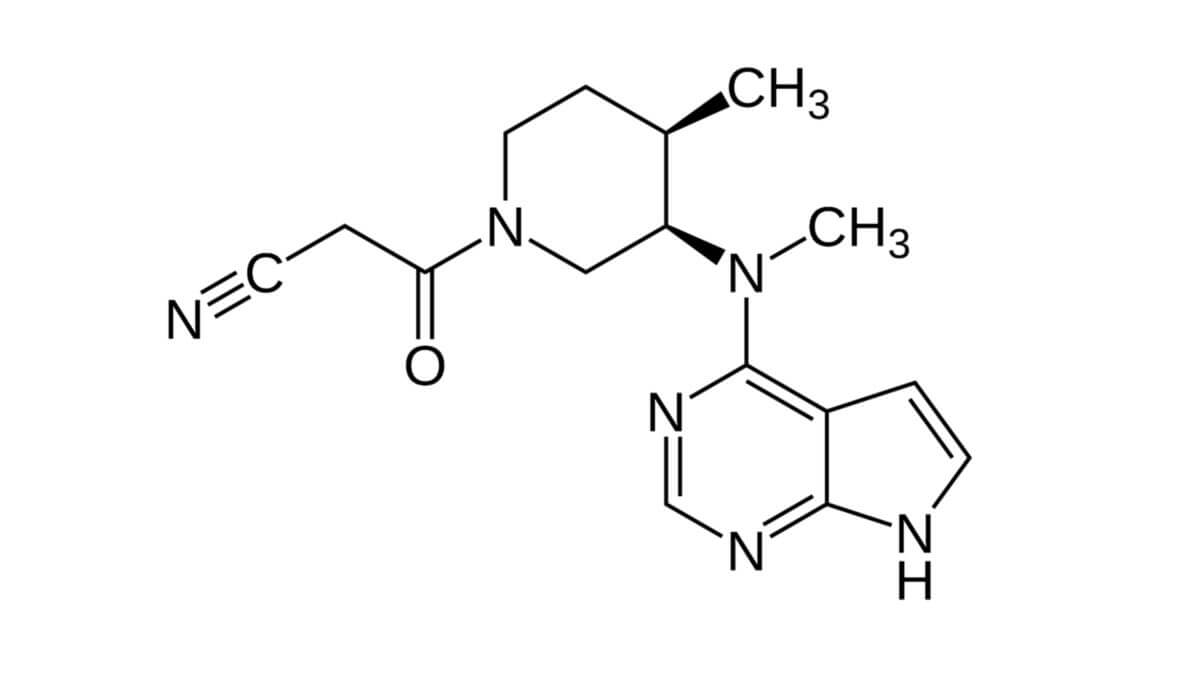
Tofacitinib
Handelsname: Xeljanz®
Definition
Tofacitinib ist ein Arzneistoff aus der Gruppe der JAK-Inhibitoren, der unter anderem zur Therapie der rheumatoiden Arthritis eingesetzt wird.[1]
Chemie
Tofacitinib hat die Summenformel C16H20N6O und ein Molekulargewicht von 312,17 g/mol. Pharmazeutisch wird das Citratsalz eingesetzt.
Wirkmechanismus
Januskinasen (JAKs) sind eine Gruppe von zytoplasmatischen Tyrosinkinasen, die von Zytokinen vermittelte Entzündungssignale über den JAK-STAT-Signalweg weiterleiten. Es gibt vier JAK-Subtypen mit sich überschneidenden Funktionen.
Die Hemmung der JAKs ist ein Therapieansatz bei der Behandlung von chronisch-entzündlichen Erkrankungen bzw. Autoimmunerkrankungen. Tofacitinib zählt wie Ruxolitinib zu den JAK-Inhibitoren der ersten Generation. Der Wirkstoff hemmt selektiv die Aktivierung von JAK1/JAK2 bzw. JAK1/JAK3 und blockiert so die intrazelluläre Signalkaskade des JAK-STAT-Signalweges. Dadurch dämpft es die Signalübertragung von Interleukin-2, -4, -6, -7, -9, -15 und -21 sowie von Typ-I- und Typ-II-Interferonen, was eine Drosselung der Entzündungsreaktion zur Folge hat.[1][2]
Pharmakokinetik
Die orale Bioverfügbarkeit beträgt rund 74 %. Maximale Plasmakonzentrationen werden nach etwa einer Stunde erreicht. Die Eliminationshalbwertszeit beträgt etwa 3 Stunden.[1]
Indikationen
- Zweitlinientherapie von Erwachsenen mit mittelschwerer bis schwerer rheumatoider Arthritis als Monotherapie oder in Kombination mit Methotrexat
- Zweitlinientherapie der aktiven Psoriasisarthritis bei erwachsenen Patienten
- Zweitlinientherapie erwachsener Patienten mit mittelschwerer bis schwerer aktiver Colitis ulcerosa[1]
Off-Label wird Tofacitinib im experimentellen Setting zur Behandlung der toxischen epidermalen Nekrolyse (TEN) eingesetzt.[3]
Dosierung
Die empfohlene Dosis beträgt zweimal täglich 5 mg. Der Arzneistoff wird in Tablettenform verabreicht.[1]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Folgende Nebenwirkungen treten unter Tofacitinib häufig (≥1:100) auf:[1]
- Infektionen: Pneumonie, Influenza, Herpes Zoster, Harnwegsinfekte, Sinusitis, Bronchitis, Nasopharyngitis, Pharyngitis
- Nervensystem: Kopfschmerzen
- Blut: Anämie
- Haut: Exanthem
- Gefäßsystem: Hypertonie
- Gastrointestinaltrakt: Diarrhö, Gastritis, Erbrechen, Übelkeit, Dyspepsie, Bauchschmerzen
- Allgemein: Fatigue, Pyrexie, Ödeme
- Skelettmuskulatur: Arthralgie
Im März 2019 veröffentlichte das BfArM eine Sicherheitswarnung für Tofacitinib, da es bei Patienten mit rheumatoider Arthritis unter dem Wirkstoff zu einer erhöhten Rate an Lungenembolien und Todesfällen gekommen war.[4]
Wechselwirkungen
Tofacitinib wird hauptsächlich über CYP3A4 und CYP2C19 metabolisiert. Bei gleichzeitiger Anwendung von starken CYP3A4-Inhibitoren wird die tägliche Tofacitinib-Dosis auf einmal 5 mg reduziert. Das Arzneimittel soll nicht zusammen mit starken CYP3A4-Induktoren angewendet werden.[1]
Kontraindikationen
- Überempfindlichkeit gegenüber dem Wirkstoff
- Schwangerschaft[5] und Stillzeit
- schwere Leberfunktionsstörungen
- aktive Tuberkulose und andere schwere Infektionen[1]
Kosten
Die Jahrestherapiekosten betragen pro Patient etwa 18.000 €.[6]
Nutzenbewertung
Der Zusatznutzen von Tofacitinib bei der Therapie einer rheumatoiden Arthritis wird vom G-BA auf der Basis der vom IQWiG ausgewerteten Studienergebnisse wie folgt bewertet:
- Hinweis auf einen geringeren Zusatznutzen
Bewertet wurde die Kombinationstherapie Tofacitinib mit Methotrexat bei Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis, die bisher nicht mit einem bDMARD behandelt wurden und für die eine erstmalige Therapie mit einem bDMARD angezeigt war. Als zweckmäßige Vergleichstherapie wurde u.a. Adalimumab in Kombination mit Methotrexat angesetzt. Kein Zusatznutzen ergab sich im Hinblick auf das Gesamtüberleben und die gesundheitsbezogene Lebensqualität sowie für die Endpunkte Remission, niedrige Krankheitsaktivität und weitere Morbiditätsendpunkte (z.B. druckschmerzhafte Gelenke, Schmerzen).[6][7]
Ein Zusatznutzen bei Psoriasis-Arthritis sowie Colitis ulcerosa ist nicht belegt[8][9]
Quellen
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Fachinfo Tofacitinib abgerufen am 04.10.2018
- ↑ Pharmazeutische Zeitung Arzneistoffe Tofacitinib abgerufen am 04.10.2018
- ↑ Nordmann, T.M., Anderton, H., Hasegawa, A. et al. Spatial proteomics identifies JAKi as treatment for a lethal skin disease. Nature 635, 1001–1009 (2024). https://doi.org/10.1038/s41586-024-08061-0
- ↑ Xeljanz® (Tofacitinib): Erhöhtes Risiko von Blutgerinnseln in der Lunge und Tod durch höhere Dosis bei rheumatoider Arthritis, BfArM, 20.03.2019, abgerufen am 16.8.2019
- ↑ Arzivian A et al. First-trimester exposure to tofacitinib in ulcerative colitis: A case report of a healthy newborn and literature review. Clin Case Rep. 2024
- ↑ 6,0 6,1 Tofacitinib Nutzenbewertung A18-28 rheumatoide Arthritis, abgerufen am 16.07.2019
- ↑ Tafocitinib Nutzenbewertung A17-18 rheumatoide Arthritis, abgerufen am 16.07.2019
- ↑ Tofacitinib Nutzenbewertung A18-51 Psoriasis Arthritis, abgerufen am 16.07.2019
- ↑ Tofacitinib Nutzenbewertung A18-52 Colitis, abgerufen am 16.07.2019