Lepra
Synonyme: Hansen’sche Krankheit, Morbus Hansen, Miselsucht, Aussatz (umgangsspr.)
Englisch: leprosy
Definition
Die Lepra ist eine Infektionskrankheit, die durch den Erreger Mycobacterium leprae ausgelöst wird.
ICD10-Codes
- A30: Lepra (Aussatz)
- A30.0: Indeterminierte Lepra
- A30.1: Tuberkuloide Lepra
- A30.2: Borderline-tuberkuloide Lepra
- A30.3: Borderline-Lepra
- A30.4: Borderline-lepromatöse Lepra
- A30.5: Lepromatöse Lepra
Geschichte
Die Entdeckung des Lepraerregers erfolgte 1873 durch Gerhard Armauer Hansen (1841-1912), der damit die Hypothese entkräftete, dass es sich bei der Lepra um eine erblich bedingte Erkrankung handelt. Die Anfärbung des Erregers gelang erst 1879. Auf Hansen geht ein Konzept der intensiven medizinischen Betreuung der Leprakranken zurück, das 1877/85 in Norwegen in einem Gesetz verankert wurde, das weltweit Vorbildcharakter hatte. Weil es Hansen nicht gelungen war, die Infektiosität des Erregers im Tierversuch nachzuweisen, führte er einen Versuch an einer Patientin gegen deren Willen durch. Es wurde ein Prozess gegen ihn angestrengt und er verlor seine Stelle als Arzt im Leprahospital in Bergen.[1]
Einteilung
...nach Ridley und Jopling
Lepra kommt in verschiedenen klinischen Erscheinungsformen mit jeweils charakteristischen bakteriologischen, pathologischen und immunologischen Veränderungen vor. Nach Ridley und Jopling unterscheidet man:
- Indeterminierte Lepra (I, mögliches Erststadium): Instabile Form, die zunächst keinem bestimmten Typ zugeordnet werden kann.
- Tuberkuloide Lepra ("Nervenlepra")
- polar tuberkuloid (TT)
- Borderline-tuberkuloid (BT)
- Borderline-Lepra
- Borderline (BB)
- Borderline-lepromatös (BL)
- Lepromatöse Lepra ("Knotenlepra")
- polar lepromatös (LL)
Das Spektrum von der polaren tuberkuloiden Form über die Borderline-Formen bis zur polaren lepromatösen Lepra entspricht der Entwicklung von lokal begrenzten Hautveränderungen bis hin zu generalisierten Manifestationen, einer zunehmenden Erregerdichte und einem zunehmenden Verlust der spezifischen zellulären Immunität. Die Unterscheidung zwischen den klinischen Formen ist entscheidend für die Therapie und Prognose.
...nach WHO
Die WHO unterscheidet anhand der Erregerzahl in der Dermis zwischen zwei Formen:
- Paucibazilläre Lepra: Bakteriologischer Index < 2. Entspricht i.d.R. der tuberkuloiden Lepra.
- Mulitbazilläre Lepra: Bakteriologischer Index > 2. Entspricht meist der Borderline- oder der lepromatösen Lepra.
Epidemiologie
Früher kam die Lepra weltweit vor, heutzutage fast nur noch in Entwicklungsländern (v.a. Südostasien, Indien, Afrika und Brasilien). In Europa und Nordamerika finden sich nur vereinzelt importierte Fälle. Das Forschungszentrum Borstel fungiert in Deutschland als Nationales Referenzzentrum für Mykobakterien.
1991 erklärte die WHO das Ziel, die Lepra als ein Weltgesundheitsproblem bis 2000 zu beseitigen, d.h. die Prävalenz in allen Staaten auf unter 1:10.000 zu senken. Dies ist für die Weltbevölkerung gesehen mit den Therapiemöglichkeiten und der Unterstützung einer verbreiteten Anwendung auch gelungen, wobei weitere Anstrengungen in einzelnen Ländern noch nötig sind. Eine komplette Eradikation scheint unmöglich zu sein. Die Globale Leprastrategie 2016-2020 der WHO hat u.a. folgende Ziele definiert:
- Bei neudiagnostizierter Lepra im Kindesalter sollen keine Grad-2-Behinderungen (sichtbare Schäden) mehr auftreten.
- Bei weniger als 1/1 Millionen Einwohnern soll eine Lepra mit Grad-2-Behinderung auftreten.
- Weltweit sollen keine Gesetze mehr in Kraft sein, die Leprapatienten diskriminieren.
Die weltweite Prävalenz der Lepra ist unklar und wird auf 600.000 bis 8 Millionen Erkrankungsfälle geschätzt. Sie ist in vielen Gebieten in den letzten Jahren gesunken, was auf die Erfolge der antibiotischen Dreifachkombinationstherapie Anfang der 80er Jahre zurückzuführen ist. Die Zahl der Neuerkrankungen (Inzidenz) wird auf 500.000 pro Jahr geschätzt und stagniert in den letzten Jahren. Betroffen sind hauptsächlich Menschen, die in schwerer Armut und in ländlicher Umgebung leben. Die meisten Menschen scheinen eine natürliche Immunität gegen Lepra zu besitzen. Eine Assoziation mit einer HIV-Infektion besteht nicht.
Der Häufigkeitsgipfel liegt im 2. und 3. Lebensjahrzehnt. Die lepromatöse Lepra kommt bei Männern doppelt so häufig vor, bei Kindern nur selten. In Indien und Afrika macht die tuberkuloide Form 90 % aller Erkrankungen aus, in Südostasien sind je 50 % tuberkuloid und lepromatös, in Mexiko 90 % lepromatös.
Erreger
Das Mycobacterium leprae ist wie die Tuberkuloseerreger ein obligat intrazellulär wachsendes, säurefestes, grampositives Stäbchenbakterium. Es kommt beim Menschen, Neunbinden-Gürteltier und im Erdreich vor. Das Bakterium dringt in Makrophagen ein und persistiert dort. Außerhalb des Körpers kann es auch monatelang überleben. Mittels PGL-1 bindet es an die Basalmembran von Schwann-Zellen. Mycobacterium leprae vermehrt sich am besten in kühlem Gewebe (Haut, periphere Nerven, vordere Augenkammer, obere Atemwege, Hoden).
Bei einigen Lepra-Patienten in Mexiko, Singapur und Kanada wurde nur oder zusätzlich eine weitere eigenständige Mykobakterien-Art, Mycobacterium lepromatosis, identifiziert.
Übertragung
Der Erreger ist im Gegensatz zum weit verbreiteten Glauben wenig virulent. Der genaue Infektionsweg der Lepra ist bis heute (2021) nicht vollständig geklärt. Die Tröpfcheninfektion erscheint am wahrscheinlichsten. Dafür sprechen folgende Aspekte:
- Immunsupprimierte Mäuse können durch kontaminiertes Aerosol infiziert werden.
- Beim Niesen eines unbehandelten Leprakranken können über 1010 Bakterien freigesetzt werden.
- Spezifische IgA-Antikörper und Gene von Mycobacterium leprae können in der Nase klinisch gesunder Personen in Endemiegebieten und bei ca. 20 % der Personen mit berufsbedingten Kontakten zu Leprakranken nachgewiesen werden.
Indizien, die für eine Übertragung durch Kontakt mit infizierter Erde sprechen, sind:
- In Endemiegebieten ist Lepra v.a. eine Erkrankung der Landbevölkerung.
- In Endemiegebieten können Stoffwechselprodukte von Mycobacterium leprae im Erdreich nachgewiesen werden.
- Mycobacterium leprae kann durch direkte dermale Inokulation (z.B. beim Tätowieren) übertragen werden.
Auch eine Übertragung durch Insekten ist nicht ausgeschlossen, da Mycobacterium leprae in Bettwanzen und Stechmücken in der Nähe von Leprosorien isoliert werden konnte. Experimentell infizierte Stechmücken können Lepra auf Mäuse übertragen.
Gelegentlich führt der Kontakt mit einem infizierten Neunbinden-Gürteltier zur Erkrankung beim Menschen. Weiterhin konnte ein Stamm von Mycobacterium leprae in einer Eichhörnchen-Art in Großbritannen festgestellt werden, der im Mittelalter bei englischen Leprakranken zirkulierte. Es ist unklar, welche Rolle diese Zoonosen bei der Ausbreitung der Lepra spielen.
In Endemiegebieten besteht bei ca. 50 % der Leprakranken ein vorangegangener enger Kontakt mit einem Infizierten, in Nichtendemiegebieten jedoch nur in 10 % der Fälle. Die lepromatöse Form der Lepra ist dabei wesentlich ansteckender als die tuberkuloide Form, da der Mykobakteriengehalt in Haut- und Schleimhaut viel höher ist.
Klinik
Die Inkubationszeit der Lepra beträgt zwischen 1 und 40 Jahren (meist zwischen 5-7 Jahren). Ursächlich ist zumindest teilweise die extrem lange Verdopplungszeit von Mycobacterium leprae.
| Tuberkuloide Lepra (TT, BT) | Borderline-Lepra (BB, BL) | Lepromatöse Lepra (LL) | |
| Haut |
|
| |
| Nerven |
|
|
Tuberkuloide Lepra
Die tuberkuloide Lepra stellt die weniger schwere Form des klinischen Spektrums dar und umfasst die polare tuberkuloide Lepra (TT) und die Borderline-tuberkuloide Lepra (BT). Diese Manifestationsformen sind wenig ansteckend und bleiben meist auf Haut und periphere Nerven beschränkt. TT- und BT-Lepra sind die häufigsten Formen in Indien und TT-Lepra in Afrika. In Südostasien findet sich meist die BT-Lepra.
Bei der tuberkuloiden Lepra befindet sich der Körper in einer guten Abwehrlage. Eine Hyperergie führt zu folgenden charakteristischen Symptomen:
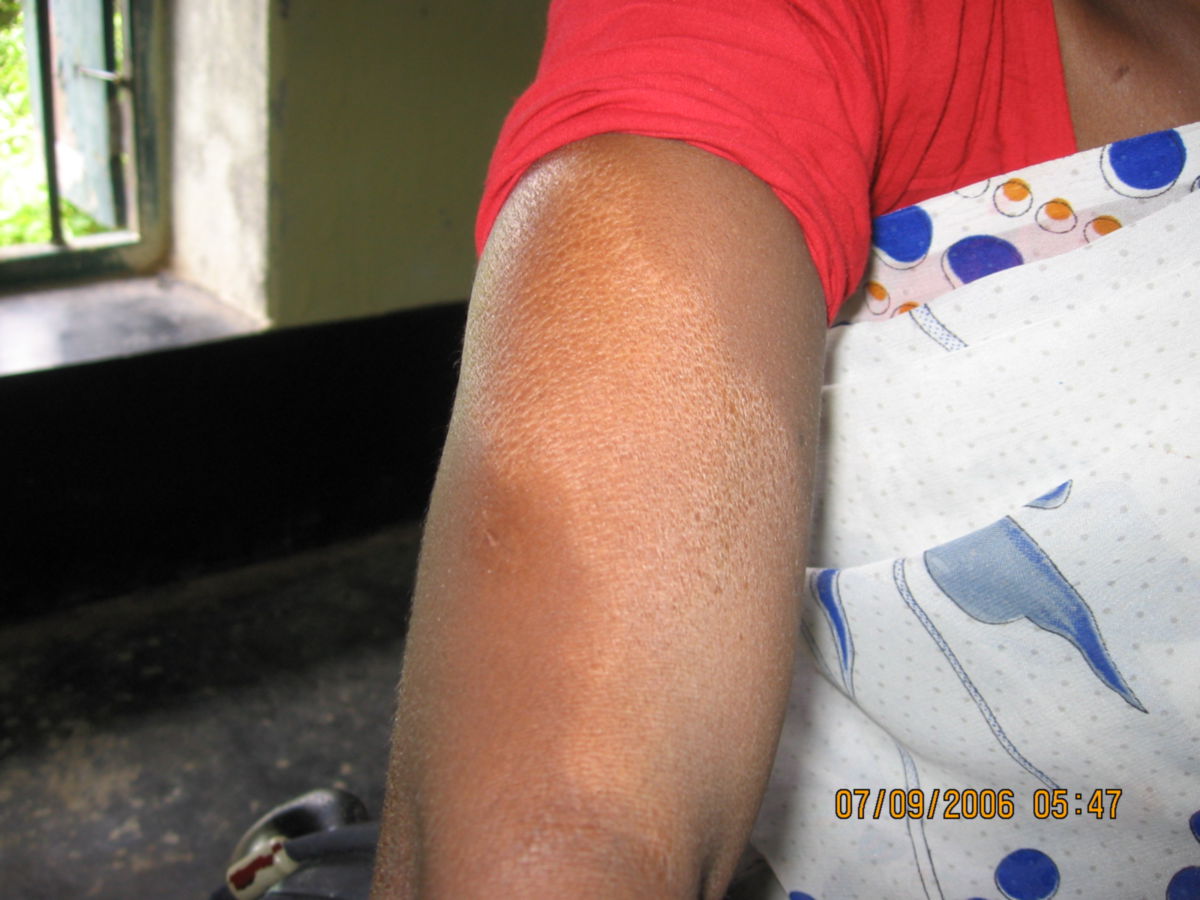
- Hautläsionen: eine bzw. wenige, hypopigmentierte Maculae oder Plaques, die scharf begrenzt und hypästhestisch sind. Oft mit zentraler Aufhellung und erythematösem oder erhabenem Rand. Die Haut erscheint trocken, schuppig und anhidrotisch. Die Hautfalten können von den Läsionen ausgespart sein (Deck-chair-sign).[2]
- asymmetrische, tastbare Verdickungen von einem oder mehreren peripheren Nerven. Betroffen sind insbesondere der Nervus ulnaris, der Nervus auricularis posterior, der Nervus fibularis und der Nervus tibialis posterior. Die Auftreibungen sind mit Hypästhesie und Myopathie assoziiert.
- Lähmungen können ebenfalls vorkommen
Bei der tuberkuloiden Lepra infiltrieren T-Zellen das Perineurium. Es kommt zur Zerstörung von Schwann-Zellen und Axonen mit Fibrosierung des Epineuriums und Ersatz des Endoneuriums durch epitheloide Granulome. Gelegentlich findet man verkäsende Nekrosen. Durch ein Typ-I-Zytokin-Muster mit starker Aktivierung von T-Zellen und Makrophagen bleibt die Infektion lokal begrenzt. Die Keimzahl ist gering und der Verlauf langsam. In ca. 90 % der Fälle kommt es zur Regression.
Borderline-Lepra
Die Borderline-Lepra ist eine Mischung von Symptomen der tuberkuloiden und der lepromatösen Form. Der Verlauf ist abhängig vom Immunstatus.
Lepromatöse Lepra
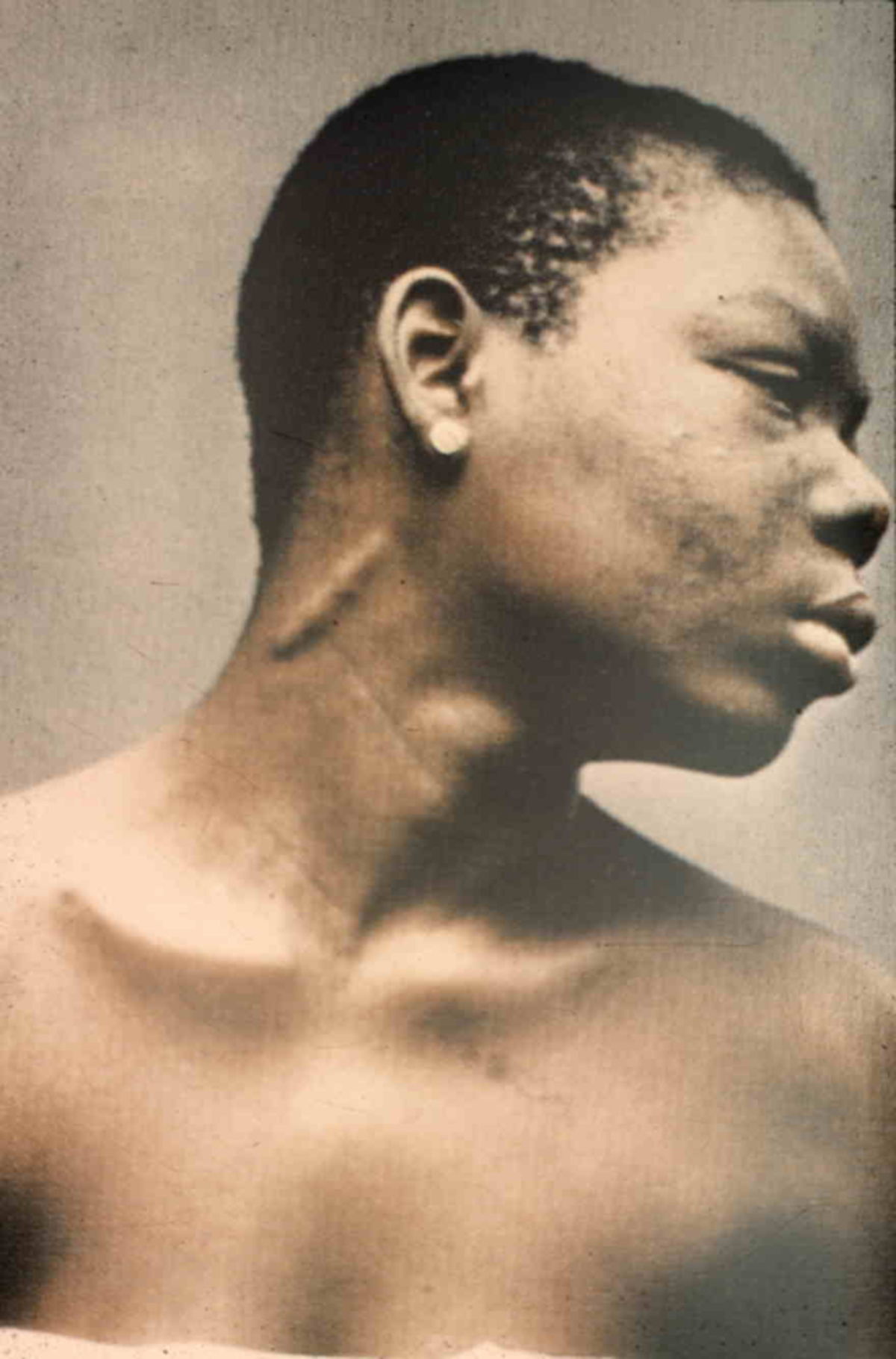
Die lepromatöse Lepra ist die schwerste Verlaufsform und findet sich insbesondere in Mexiko sowie in Südostasien. Sie kommt bei schwacher Erregerresistenz vor (spezifische Anergie) und ist infektiöser als die tuberkuloide Form. Folgende Symptome sind charakteristisch:
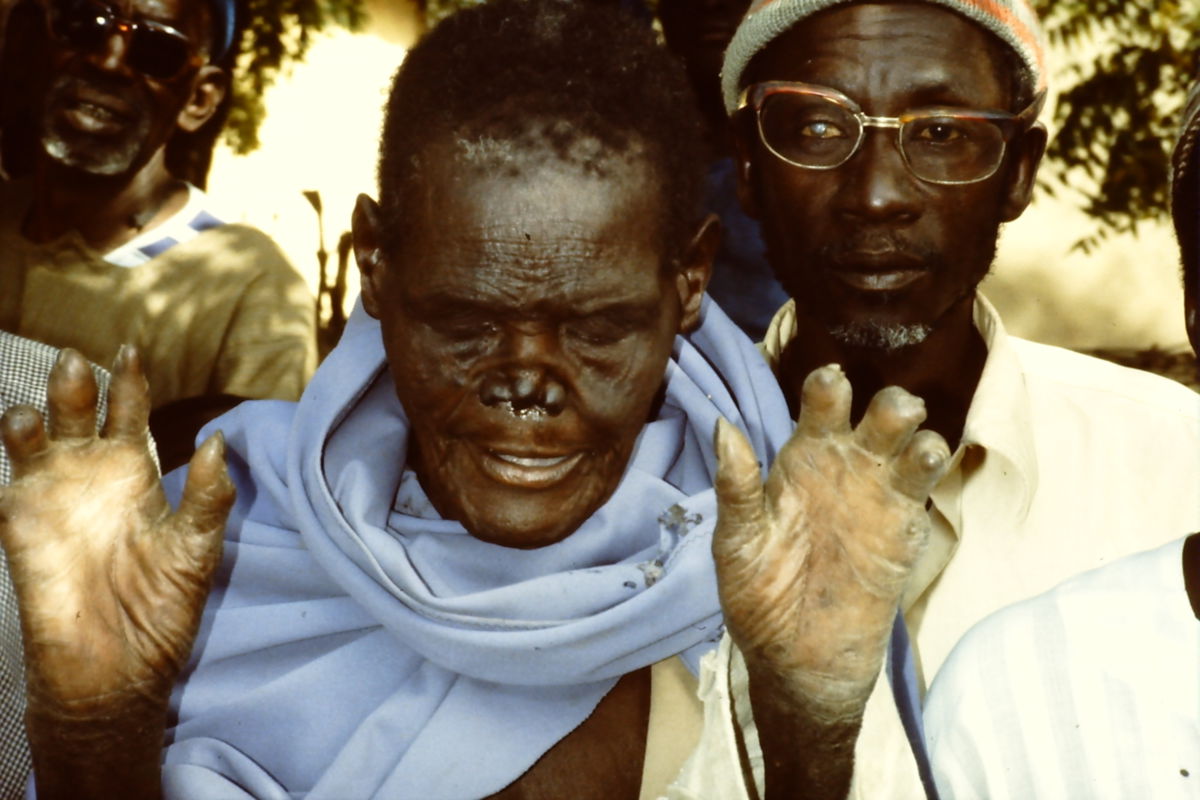
- symmetrisch verteilte, knotige Hautveränderungen (Leprome), erhabene Plaques oder diffuse Infiltration der Haut. Im Verlauf Vergrößerung und Ulzeration möglich.
- Facies leonina: Durch die Knoten sieht das Gesicht löwenhaft aus.
- tief herabhängende knotige Ohrläppchen
- Madarosis: chronische Lidrandentzündung mit Verlust der Wimpern
- Verlust der Augenbrauen (anfangs nur laterale Anteile)
- Trockene, schuppige Haut (v.a. im Bereich der Füße)
- Nervenverdickung und -schädigung: entwickelt sich schleichend, aber ausgedehnter als bei der tuberkuloiden Lepra. Akral und distal betonte symmetrische periphere Neuropathie.
Die Hautläsionen und die peripheren Nerven enthalten viele Mykobakterien. In peripheren Nerven werden Schwann-Zellen befallen, was zu einer Waller-Degeneration führt. Außerdem finden sich zahlreiche Erreger im Blut und in anderen Organsystemen, außer in der Lunge und dem Zentralnervensystem. Jedoch sind die Patienten afebril und es bestehen i.d.R. keine Hinweise für eine Dysfunktion der betroffenen Organsysteme.
Fast nur im westlichen Mexiko und in der Karibik kommt eine Sonderform der lepromatösen Lepra vor, die ohne erkennbare Hautläsionen, aber mit diffuser dermaler Infiltration und Verdickung der Dermis einhergeht. Diese Form wird als diffuse Lepromatose bezeichnet.
Leprareaktionen
Als Leprareaktionen werden verschiedene immunologische Reaktionen bezeichnet, die teilweise erst unter Antibiotikatherapie auftreten können. Entsprechend ist eine vorherige Aufklärung entscheidend für die Therapieadhärenz. Man unterscheidet zwischen:
- Typ-1-Reaktionen: Downgrading-Reaktion, Umkehrreaktion
- Typ-2-Reaktionen: Erythema nodosum leprosum
- Lucio-Phänomen
Typ-1-Reaktionen
Leprareaktionen vom Typ 1 kommen bei ca. 50 % aller Leprapatienten mit Borderline-Formen vor, jedoch nicht bei der LL-Form. Wenn Typ-1-Reaktionen vor Beginn einer Therapie auftreten, werden sie als Downgrading-Reaktion bezeichnet. Treten sie nach Therapiebeginn auf, spricht man von einer Umkehrreaktion.
Sie zeigt sich als klassische Entzündungsreaktion im Bereich der bestehenden Hautläsionen. Gelegentlich finden sich neue Hautveränderungen, eine Neuritis oder Fieber. Eine sofortige Therapie mit Glukokortikoiden ist notwendig, da andernfalls innerhalb von 24 Stunden irreversible Nervenschädigungen entstehen können.
Typ-1-Reaktionen werden klinisch diagnostiziert. Mikroskopisch findet sich ein Ödem.
Typ-2-Reaktionen
Ein Erythema nodosum leprosum tritt bei ca. 50 % der Patienten mit LL- oder BL-Lepra auf, bei anderen Lepraformen hingegen kaum. In den meisten Fällen entsteht es nach Therapiebeginn, häufig in den ersten 2 Jahren. Es ist gekennzeichnet durch multipel vorkommende, schmerzhafte erythematöse Papeln, die spontan nach einigen Tagen abheilen und zu Rezidiven neigen. Begleitende Symptome sind:
- Fieber
- Neuritis
- Lymphadenitis
- Uveitis
- Orchitis
- Glomerulonephritis
Im Labor fallen eine Anämie, eine Leukozytose und erhöhte Transaminasen auf. Histologisch zeigt sich eine Vaskulitis oder eine Pannikulitis mit vielen neutrophilen Granulozyten. Es stellt vermutlich eine Immunkomplex-vermittelte Reaktion dar.
Lucio-Phänomen
Das Lucio-Phänomen ist eine seltene immunologische Reaktion, die meist bei unbehandelten Patienten mit diffuser Lepromatose beobachtet wird. Dabei entstehen schubweise Haufen von rezidivierenden, großen, scharf begrenzten Ulzerationen, insbesondere an den unteren Extremitäten.
Histologisch finden sich ischämische Nekrosen der Epidermis und oberen Dermis, ein Befall der Endothelzellen mit Mykobakterien sowie eine endotheliale Proliferation und Thrombusbildung in den Gefäßen der tieferen Dermis. Das Lucio-Phänomen stellt vermutlich eine durch Immunkomplexe vermittelte Reaktion dar.
Komplikationen
Extremitäten
Als Folge der Neuropathie und der resultierenden Hypästhesie und Myopathie entstehen häufig Komplikationen an den Extremitäten. Betroffen sind v.a. der Tastsinn sowie das Schmerz- und Temperaturempfinden. Die Propriozeption und das Vibrationsempfinden bleiben meist erhalten. Am häufigsten ist der Nervus ulnaris am Ellenbogen betroffen, sodass z.B. eine Krallenhand entstehen kann. Bei Beteiligung des Nervus medianus ist eine Schwurhand möglich.
Weiterhin entstehen Ulzerationen an den Fußsohlen (Mal perforant du pied), insbesondere im Bereich der Metatarsalköpfchen. Bei Peroneusparese kann eine Fußheberschwäche vorliegen. Selten kommt es zur Ausbildung einer neurogenen Osteoarthropathie (Charcot-Fuß). Durch wiederholte Traumata und Sekundärinfektionen kann eine Amputation der distalen Gliedmaßen notwendig sein.
Nase
Bei der lepromatösen Lepra können Mykobakterien in die Nasenschleimhaut einwandern und zu chronischer Obstruktion und Nasenbluten führen. Aufgrund der heutigen Therapiemaßnahmen wird der Nasenknorpel nur selten zerstört (Sattelnase).
Augen
Hirnnervenparesen können zu Lagophthalmus und kornealer Hypästhesie führen. Dadurch steigt das Risiko für das Auftreten von Sekundärinfektionen, Hornhautulzerationen und -trübungen. Weiterhin können Mykobakterien in die vordere Augenkammer einwandern. Im Rahmen eines Erythema nodosum leprosum können sich eine Uveitis sowie eine Katarakt und ein Glaukom entwickeln.
Hoden
Mycobacterium leprae kann in die Hoden einwandern. Im Rahmen eines Erythema nodosum leprosum kann sich dann eine Orchitis entwickeln. Bei 85 % der LL- und 25 % der BL-Patienten findet sich eine testikuläre Dysfunktion mit erhöhten LH- und FSH-Spiegeln, erniedrigten Testosteronwerten und Hypo- oder Aspermie. Impotenz und Infertilität sind möglich.
Amyloidose
Als Komplikation einer LL-Lepra oder eines Erythema nodosum leprosum kann sich selten eine sekundäre Amyloidose entwickeln, die zu Funktionsstörungen der Leber und der Niere führt.
Nervenabszesse
Insbesondere BT-Patienten können Nervenabszesse entwickeln. Am häufigsten ist der Nervus ulnaris betroffen. Eine schnelle chirurgische Dekompression ist indiziert.
Weitere Komplikationen
- Facies antonina: Maskengesicht durch Fazialisparese, v.a. bei tuberkuloider Lepra
- Möller-Christensen-Phänomen: Lockerung der vorderen Schneidezähne und daraus folgende Fehlstellung
- Vox rauca: rauhe Stimme durch Larynxbefall
Diagnostik
Bei Patienten aus Endemiegebieten mit hyp- bis anästhetischen Hautveränderungen oder peripherer Neuropathie kann die Verdachtsdiagnose einer Lepra histologisch gesichert werden. Laut WHO wird für die Diagnose der Lepra eines von drei Kriterien gefordert:
- Hyp- bis Anästhesie in hypopigmentierten, ggf. in rötlichen Hautflecken
- Nervenverdickung mit Ausfallserscheinungen
- Nachweis von säurefesten Stäbchen in Nasenschleimhaut, Haut und/oder Nerven.
Pathohistologie
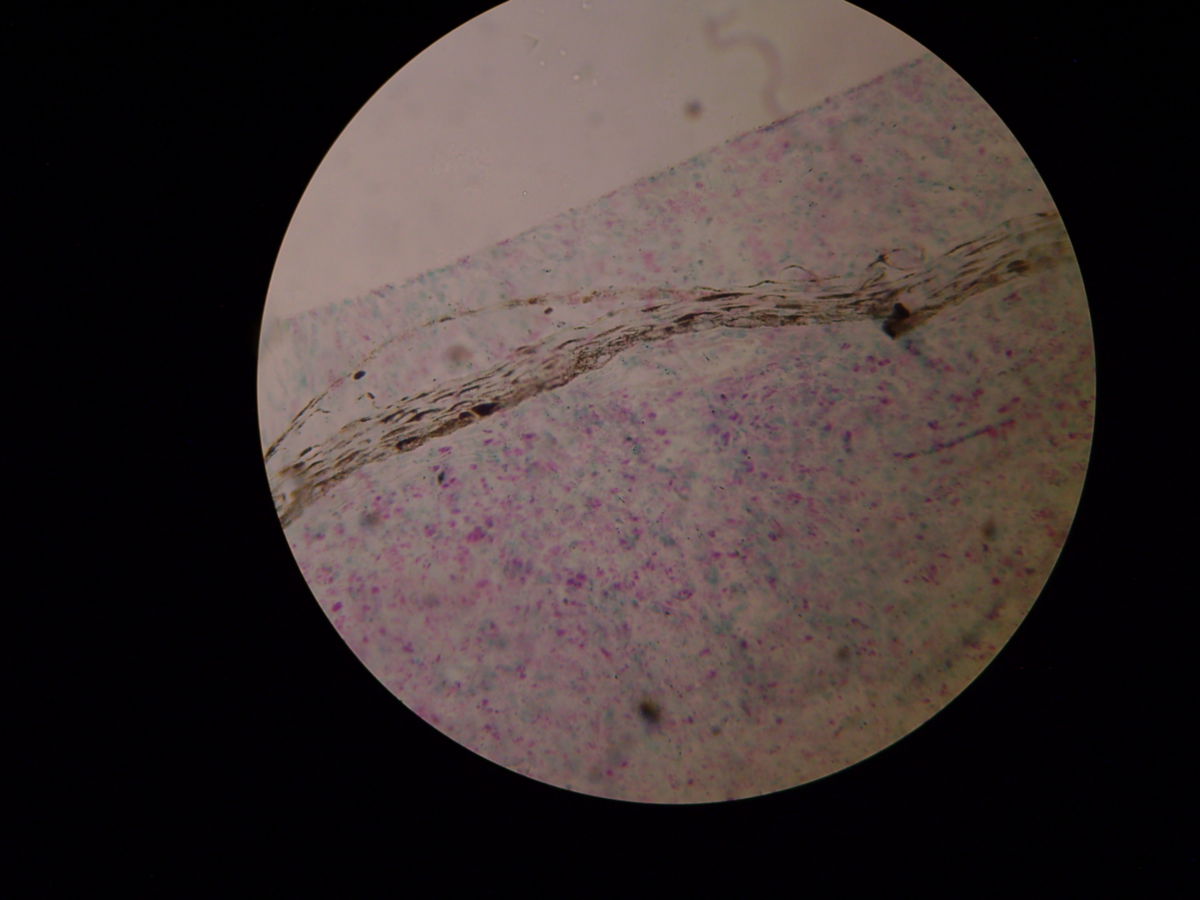
Mittels Probeentnahme und anschließender Ziehl-Neelsen-Färbung oder Fite-Faraco-Färbung lassen sich säurefeste Stäbchen nachweisen. Die Lepraerreger lösen eine für sie typische granulomatöse Entzündung aus. Sie befallen bevorzugt Makrophagen und Schwann-Zellen.
Bei tuberkuloider Lepra erfolgt die Biopsie direkt vom Rand der Hautläsion. Hier finden finden sich wenige Bakterien, viele T-Lymphozyten und epitheloidzellige Granulome. In gesunder Haut sind keine histologischen Veränderungen zu erwarten.
Bei lepromatöser Lepra erfolgt die Biopsie idealerweise aus Knötchen, Plaques und indurierter Haut, wobei die Diagnose meist auch durch eine Untersuchung von normal erscheinender Haut gestellt werden kann. Häufig wird das Ohrläppchen als Entnahmeort gewählt. Bei der lepromatösen Lepra treten massenhaft Mykobakterien auf. Die Granulome bestehen aus schaumartig veränderten Makrophagen (Virchow- bzw. Leprazellen).
Lepromin-Hauttest
Der Lepromin-Hauttest dient zur Differenzierung zwischen der tuberkuloiden und der lepromatösen Lepra. Es werden hitzeattenuierte Leprabakterien intrakutan injiziert. Eine positive Hautreaktion findet sich bei einigen Gesunden und den meisten Patienten mit tuberkuloider Lepra. Bei LL-Patienten bleibt der Test meist negativ.
PCR
Mit dieser Methode kann man die mykobakterielle DNA im Körper nachweisen, was vor allem bei der paucibacillären Form von Vorteil ist. Allerdings wird die PCR selten durchgeführt, da die Mittel dazu in den Ländern, wo die Lepra noch vorkommt, oft fehlen und in der Regel die Klinik schon eindeutig genug ist. Weiterhin ist die PCR bei 50 % der tuberkuloiden Formen negativ.
Serologie
Mithilfe der ELISA können Antikörper gegen Erregerbestandteile nachgewiesen werden, insbesondere IgM-Antikörper gegen das PGL-1, ein Zellwandantigen von Mycobacterium leprae. Die Sensitivität liegt dabei zwischen 70 und 90 %, je nach betrachteter Studie. Bei 95 % der unbehandelten LL-Patienten finden sich Anti-PGL-1-Antikörper, bei der tuberkuloiden Form nur bei 60 %. In Endemiegebieten können auch gesunde Menschen Antikörper aufweisen.
Bei lepromatöser Lepra liegt eine unselektive Hypergammaglobulinämie vor, die zu falsch-positiven serologischen Befunden (z.B. VDRL, RF, ANA) führen kann.
Erregeranzucht
Der Erreger lässt sich weder in Nährmedien noch in Zellkulturen vermehren. Die Vermehrung in den Fußsohlen immungeschwächter Mäuse, Ratten oder im Gürteltier ist möglich, wird jedoch eher im Rahmen von klinischen Studien eingesetzt.
| Tuberkuloide Lepra (TT, BT) | Borderline-Lepra (BB, BL) | Lepromatöse Lepra (LL) | |
| Bakteriologischer Index |
|
|
|
| Lymphozyten |
|
|
|
| Makrophagendifferenzierung |
|
| |
| Langhans-Riesenzellen |
|
|
|
| Lepromin-Hauttest |
|
|
|
| Lymphozytentransformationstest |
|
|
|
| CD4/CD8-Quotient in Läsionen |
|
|
|
| Anti-PGL-1-Antikörper |
|
|
|
Differenzialdiagnosen
Bei den Hautveränderungen sind z.B. folgende Differenzialdiagnosen zu erwägen:
- Sarkoidose
- Leishmaniose
- Tuberkulose (Lupus vulgaris)
- Dermatofibrome
- Histiozytome
- Lymphome
- Syphilis
- Frambösie
- Granuloma anulare
- Hypo- oder Hyperpigmentierungen bei Pityriasis alba, Tinea oder Vitiligo
Hinweisend für Lepra sind die Sensibilitätsstörung im Bereich der Hautveränderungen. Bei Nachweis von säurefesten Stäbchen im Sputum ist an eine Tuberkulose zu denken.
Therapie
Bei der Lepra kommen folgende Medikamente zum Einsatz, meist in Form einer Kombinationstherapie (MDT), da der Einsatz der Wirkstoffe als Monotherapie zu Resistenzen führt:
- Dapson: bakteriostatisch. Hemmt die Synthese der bakteriellen Dihydrofolsäure.
- Clofazimin: bakteriostatisch. Führt bei hellhäutigen Patienten zu einer reversiblen orange bis rotschwarzen Hautverfärbung, v.a. im Bereich der Hautläsionen. In Deutschland nur ggf. über die internationale Apotheke erhältlich.
- Rifampicin: bakterizid. Hohe Rezidivraten bei multibazillärer Lepra, insbesondere nach über 10 Jahren nach Therapieende.
Weitere in Tiermodellen und klinischen Studien wirksame Medikamente sind:
- Ethionamid, Prothionamid
- Aminoglykoside: Streptomycin, Kanamycin, Amikacin (nicht Gentamicin und Tobramycin)
- Minocyclin
- Clarithromycin
- Fluorchinolone: Ofloxacin, Moxifloxacin
Therapieschemata
Bei der Wahl eines geeigneten Therapieschemas ergeben sich folgende Probleme:
- Oft fehlt der Nachweis von säurefesten Stäbchen bei tuberkuloider Lepra. Daher liegt kein objektives Kriterium zur Beurteilung des Behandlungserfolgs vor. Außerdem heilen TT- und BT-Läsionen oft schlecht oder unvollständig. Rückfälle sind schwer von späten Typ-1-Reaktionen zu unterscheiden.
- Bei LL-Lepra persistieren lebensfähige Mykobakterien oft auch nach langer intensivierter Therapie und können zu Rezidiven führen. Entsprechend ist eine lange Nachbeoachtung notwendig. Verwirrenderweise können auch abgetötete Erreger Jahre nach Therapie mikroskopisch gefunden werden.
- Es fehlen Daten aus Tierexperimenten und klinischen Studien über optimale Medikamentenkombinationen, Dosierungsschemata und optimale Behandlungsdauer.
1982 hat die WHO Empfehlungen zur Therapie der Lepra im Rahmen von Kontrollprogrammen veröffentlich. Diese Schemata berücksichtigten die geringen Ressourcen für eine adäquate Behandlung in den Endemiegebieten sowie eine häufig geringe Adhärenz bei lebenslanger Therapie. Daher empfahl die WHO ohne zugrundeliegenden Daten aus klinischen Studien eine zeitlich begrenzte Therapie bei allen Lepraformen. Die aktuellen WHO-Empfehlungen für erwachsene Patienten lauten:
- Dapson 100 mg/d
- Clofazimin 1 x 300 mg pro Monat, an restlichen Tagen 50 mg/d
- Rifampicin 1 x 600 mg pro Monat
- Therapiedauer: 6 Monate bei paucibazillärer, 12 Monate bei multibazillärer Lepra
Die Medikamentenblister werden von der WHO weltweit kostenlos zur Verfügung gestellt.
Verschiedene Experten empfehlen eine intensivierte Therapie:
- paucibazilläre bzw. tuberkuloide Lepra: Dapson 100 mg/d über 5 Jahre
- multibazilläre bzw. lepromatöse Lepra: Rifampicin 600 mg/d über 3 Jahre + Dapson 100 mg/d lebenslang
Therapieschemata mit Moxifloxacin, Minocyclin oder Clarithromycin erscheinen ebenfalls vielversprechend. Derzeit (2021) fehlen jedoch weitere Studien hierzu.
...der Leprareaktionen
- Typ-1-Reaktion: Glukokortikoide über mindestens 3-6 Monate unter strenger Indikationsstellung (z.B. bei Ulzerationsgefahr aufgrund starker Entzündung, im Falle einer Neuritis oder bei Reaktionen an kosmetisch relevanten Körperregionen)
- Typ-2-Reaktion: bei leichter Ausprägung lediglich Antipyretika. Bei vielen Hautläsionen, Fieber, Krankheitsgefühl und anderen Organmanifestationen Glukokortikoide für 1-2 Wochen. Bei persistierenden Symptomen Einsatz von Thalidomid.
- Lucio-Phänomen: Wundpflege und adäquate Therapie von Bakteriämien. Glukokortikoide und Thalidomid sind unwirksam.
Prognose
Eine tuberkuloide Lepra kann spontan ausheilen. Unter einer effektiven antibiotischen Therapie sollten keine neuen Hauterscheinungen und Symptome einer Neuropathie auftreten, abgesehen von den Beschwerden im Rahmen einer Leprareaktion. Die Knoten und Plaques bei lepromatöser Lepra bilden sich innerhalb weniger Jahre zurück. Tuberkuloide Hautläsionen können abheilen oder unverändert persistieren. Eine bestehende Neuropathie wird insgesamt durch die Behandlung kaum beeinflusst.
Prophylaxe
Isolierung
Eine Isolierung der Erkrankten ist auf Grund der niedrigen Ansteckungswahrscheinlichkeit heute nicht mehr gefordert. Grundregeln der Hygiene sind jedoch einzuhalten.
Chemoprophylaxe
Eine medikamentöse Prophylaxe mit Dapson kann die Fallzahlen von tuberkuloider Lepra vermindern. Sie hat jedoch keinen Einfluss auf das Auftreten einer lepromatösen Lepra besteht, sodass eine Chemoprophylaxe nicht empfohlen wird. Durch eine einmalige Gabe von Rifampicin (Single Dose Rifampicin, SDR) bei Kontaktpersonen konnte in einer Studie das Risiko einer Lepra-Erkrankung in den folgenden zwei Jahren um 57 % gesenkt werden. Die SDR-Postexpositionsprophylaxe wird daher in den neuen WHO-Richtlinien empfohlen.
Impfung
Umstritten ist, ob eine BCG-Impfung zum Zeitpunkt der Geburt einen Schutz verleiht. Je nach Studie reicht die Effektivität von 0 bis 80 %. Weiterhin wird der Subunit-Impfstoff LepVax derzeit (2021) im Rahmen von klinischen Studien untersucht.
Meldepflicht
Laut dem Infektionsschutzgesetz besteht bei Erregernachweis eine namentliche Labormeldepflicht an das Gesundheitsamt sowie in Sachsen auch eine namentliche Arztmeldepflicht bei Erkrankung und Tod.
Quellen
- ↑ Gerhard Armauer Hansen. dt. Wikipedia, abgerufen am 08.03.2023
- ↑ Shenoy et al. Diffuse leprosy with "deck-chair" sign, Indian dermatology online journal, 2015
Literatur
- Steiner F, Suttorp N. 174 Lepra. In: Suttorp N, Möckel M, Siegmund B et al., Hrsg. Harrisons Innere Medizin. 20. Auflage. Berlin: ABW Wissenschaftsverlag; 2020.
- WHO. Guidelines for the diagnosis, treatment and prevention of leprosy