Leishmaniose
Eine neue Leitlinie ist verfügbar.
Klick auf "Bearbeiten" und aktualisiere diesen Artikel!
Eine neue Leitlinie ist verfügbar.
Klick auf "Bearbeiten" und aktualisiere diesen Artikel!
Synonyme: Leishmaniase, Leishmaniasis
Englisch: leishmaniasis
Definition
Leishmaniosen sind eine Gruppe von subtropischen und tropischen Infektionskrankheiten, die durch Erreger der Gattung Leishmania ausgelöst werden. Die Übertragung der Erreger erfolgt durch Vektoren.
ICD10-Codes
- B55: Leishmaniose
- B55.0: Viszerale Leishmaniose - Hautbefall nach Kala-Azar
- B55.1: Kutane Leishmaniose - Orientbeule
- B55.2: Mukokutane Leishmaniose - Espundia
- B55.9: Leishmaniose, nicht näher bezeichnet
Vorkommen
Die Erreger der Leishmaniose kommen mit Ausnahme von Australien in allen warmen Ländern vor. In Spanien und in vielen Gegenden Südamerikas ist z.B. mehr als die Hälfte der Stadthunde mit Leishmanien infiziert. Wenn auch bisweilen von Leishmaniose-Epidemien unter Menschen berichtet (Kabul, 2004, Südsudan, 2001) wird, ist die Leishmaniose primär eine endemische Infektionskrankheit.
In Mitteleuropa hat die Leishmaniose Bedeutung als Import-Krankheit durch mitgebrachte Hunde, die Leishmanien tragen, Reisende aus Endemiegebieten oder HIV-Erkrankte.
Erreger
Leishmanien bilden eine Gattung in der Ordnung der Trypanosomatida. In veralteten Systematiken werden sie den Protozoen zugerechnet. Die Erreger werden durch Vektoren übertragen - entweder von Tier zu Mensch oder von Mensch zu Mensch. Als Reservoirwirte dienen vektorabhängig u.a. Hunde und Nagetiere. Die übertragenen Leishmanien verursachen beim Menschen je nach Immunstatus und Leishmanien-Spezies unterschiedliche klinische Verläufe. Die Inkubationszeit beträgt Wochen bis Monate.
Leishmanien und ihre Vektoren werden zunächst nach ihrem Auftreten in der "Alten Welt" (Europa, Afrika, Asien) und der "Neuen Welt" (Amerika) unterschieden. Weiter erfolgt eine taxonomische Aufteilung der humanpathogenen Leishmanien-Spezies in zwei Subgenera: Leishmania (Subgenus) und Viannia. Der Subgenus Viannia tritt nur in der Neuen Welt auf, der Subgenus Leishmania ist in der Alten und Neuen Welt vertreten. Die Erreger werden in der Alten Welt durch Sandmücken der Gattung Phlebotomus, in der Neuen Welt durch Sandmücken der Gattung Lutzomyia übertragen.
Es gibt ca. 15 humanpathogene Arten, die morphologisch nicht zu unterscheiden sind, sich jedoch genetisch differenzieren lassen. Beim Menschen werden die begeißelten Leishmanien (Promastigoten) durch den Stich einer weiblichen Sandmücke bei ihrer Blutmahlzeit in das subepidermale Gewebe der Haut übertragen. Sie weisen eine Zuggeißel auf, mit der sie sich fortbewegen können, und haben eine schlanke 15-25 μm lange, bewegliche Form.
Nach dem Stich durch die Sandmücke werden die Leishmanien von kutanen Makrophagen aufgenommen und in Phagolysosomen intrazellular eingeschlossen, wo sie vor der Wirkung lysosomaler Enzyme sicher sind.
In den Phagolysosomen wandeln sich die promastigoten Formen in die unbegeißelte Amastigoten um. Diese Amastigoten vermehren sich, werden aus den Makrophagen freigesetzt und breiten sich je nach Krankheitstyp eventuell hämatogen oder lymphogen in andere Körperbereiche oder Organe aus.
siehe Hauptartikel: Leishmanien
Pathophysiologie
Je nach Immunkompetenz des Wirtes kommt es zur Entwicklung verschiedener Formen der Leishmaniose mit unterschiedlicher Organmanifestation. Bei vorzugsweiser Aktivierung der zellulären Abwehr (T-Helfer-Zellen Typ 1) durch Leishmanien kommt es zur Sekretion von Interferon-gamma und Makrophagen-Migrations-Hemmfaktor (MMIF), der Makrophagen zur Abwehr stimuliert, so dass die Leishmaniose in der Regel lokal begrenzt durch eine Entzündungsreaktion mit Nekrose und Narbe ausheilen kann.
Wird die zelluläre Abwehr der Makrophagen übergangen und werden vorzugsweise die humorale Abwehr (T-Helfer-Zellen Typ 2) stimuliert, kommt es zur Sekretion von Interleukin 4 (IL-4) und Interleukin 10 (IL-10), die hemmend auf die zelluläre Abwehr wirken. Damit können die Makrophagen die Leishmanien nicht eliminieren, die sich dann in den Körperorganen ausbreiten können.
Zusätzlich kommt es durch Stimulierung der humoralen Abwehr zur vermehrten Bildung von polyklonalen B-Zellen mit Antikörperproduktion, die allerdings für die Bekämpfung der Leishmaniose unerheblich ist. Es werden keine Antikörper induziert, die spezifisch gegen Leishmanien gerichtet sind.
Für die spezifisch gegen Leishmanien gerichtete Antikörperproduktion des Wirtes ist es notwendig, dass die Makrophagen die Leishmanien nicht nur phagozytieren, sondern auch lysieren können. Erst dann werden Teile der Leishmanien zusammen mit dem MHC-II-Rezeptor auf der Zellmembran präsentiert, und können von immunkompetenten T-Helfer-Zellen über den CD-4-Rezeptor erkannt werden.
Die Präsentation des Leishmanien-Antigene/MHC-II-Komplexes durch die Makrophagen induziert über die T-Helfer-Zellen die Bildung spezifischer Antikörper in den B-Zellen. Bei Immundefizienz (z.B. bei AIDS) kann eine latente kutane Leishmaniose exazerbieren und in eine viszerale Form übergehen.
Symptomatik
Übersicht
Man unterscheidet klinisch drei Verlaufsformen der Leismaniose: die kutane, die mukokutane und die viszerale Form. Bei der kutanen Leishmaniose zeigt die Haut mehrheitlich eine oder mehrere typische Läsionen mit erhöhtem oder anders ausgezeichnetem Rand. Bei der mukokutanen Variante ist die Schleimhaut der Nase von einer chronischen Rhinitis und anderen eventuell schwerwiegenden Schädigungen betroffen. Bei der viszeralen Erkrankung ist das retikulohistiozytäre System in Organen wie Leber, Milz, Lymphknoten und Knochenmark betroffen.
Kutane Leishmaniose
Die Erreger sind, bei unterschiedlicher Ausprägung der Läsionen, auf die Haut beschränkt. Prädilektionsstellen für den Stich der Sandmücke sind sämtliche unbekleideten Hautbereiche.
Ausgehend von einer rötlichen Makel bildet sich an der Einstichstelle eine Papel als Ausgangspunkt einer fast immer schmerzlosen Läsion. Diese zeichnet sich je nach Spezies durch einen erhöhten oder verdickten Rand aus, in dem der überwiegende Teil der aktiven Leishmanien auffindbar ist. Eine Biopsie wird daher stets am Rand entnommen. Die Läsion wächst vom Rand nach außen, während das abgeflachte Innere der Läsion nekrotisch und eventuell geschwürig zerfällt. Das Ulkus heilt im Verlauf von Monaten oder Jahren von zentral nach peripher vernarbend ab. Eine Verkrustung, Hyperkeratose oder Ulzeration des Randes oder des Inneren der Läsion ist ein zusätzliches Spezies-typisches Merkmal der Läsion. Generell können auch Läsionen auftreten, die von der typischen Form abweichen.[1]
Mitunter bilden sich in der Umgebung der Einstichstelle weitere Läsionen. Eine multilokale Infektion oder sehr große Läsionen können die Abheilung bzw. eine medizinische Behandlung erschweren. Bei manchen Leishmanien-Spezies können zusätzliche Komplikationen auftreten, nämlich eine rezidivierende, eine disseminierte oder eine diffuse kutane Leishmaniose.
Die unbehandelte Abheilung von Läsionen, die durch Spezies vom Subgenus Leishmania (insbesondere solche der Alten Welt) bewirkt wurden, haben eine lebenslange klinische Immunität gegen den ursächlichen Erreger zur Folge. Die unschönen Narben einer abgeheilten Läsion sind besonders im Gesicht stigmatisierend.
In Europa war die Läsion von Leishmania major oder Leishmania tropica als sogenannte "Orientbeule" vor allem von Reisenden aus dem Vorderen Orient bekannt. Aufgrund der dort üblichen Vollkörperbekleidung trat die Läsion fast nur an Gesicht und Händen auf.
Spezies-spezifische Symptome
- Leishmania major: Kurzcharakterisierung: Ländlich, zoonotisch, nässend, entzündet/ulzeriert. Die Läsionen sind nässend, stark entzündet und ulzeriert und heilen im Normalfall nach 2-8 Monaten von allein ab.[2]
- Leishmania tropica: Kurzcharakterisierung: Urban, anthroponotisch, trocken, hyperkeratotisch. Die Läsionen sind trocken, hyperkeratotisch, weisen verdickte Ränder auf und heilen im Normalfall nach 6-15 Monaten von allein ab.[3]
- Leishmania aethiopica: Betroffen ist überwiegend das Gesicht, seltener Arme und Beine. Insbesondere die Läsionen im Gesicht sind untypisch, verkrustet und unregelmäßig verteilt, es zeigen sich lokale Ödeme und großflächige Verfärbungen der Haut. Häufig sind Schleimhäute von Mund und Nase einbezogen. An Armen und Beinen sind die (oft fast kreisrunden) Läsionen hingegen oft typisch mit einem schmalen erhöhten glatten Rand und einem nur partiell verkrustetem Inneren, Ulzerationen treten meist erst in einer Spätphase der Läsionsentwicklung auf. Die Läsionen wachsen sehr langsam an und können, falls keine weiteren Komplikationen auftreten, nach 2-5 Jahren von allein abheilen.[2]
- Leishmania mexicana: Die Läsion ist rund, mit sauberem Grund, rosafarben, aus granulösem Gewebe und hat verhärtete Ränder. Häufig ist es mit einer nicht-eitrigen, blutigen oder serösen Kruste bedeckt. Die Selbstheilungsdauer beträgt häufig nur 3-4 Monate, kann jedoch auch erheblich länger sein. Eine diffuse kutane Leishmaniose als Komplikation ist möglich.[2]
- Leishmania brasiliensis: Die charakteristischen kraterförmigen Läsionen sind durch ein niedergedrücktes flaches, zum Teil verkrustetes Kraterinneres und einen erhabenen Kraterrand gekennzeichnet. Die Läsionen heilen häufig - aber nicht immer - von allein ab. Die Selbstheilungsdauer kann bis zu 3 Jahre betragen, häufig heilen die Läsionen jedoch nach 6 Monaten oder schneller aus. Selbstheilung ist nicht mit einer lebenslangen oder langjährigen Immunität gegen den gleichen oder gegen verwandte Erreger verbunden. Als Spätfolge kann Monate oder Jahre später eine mukokutane Leishmaniose der kutanen Primärinfektion nachfolgen. Auch eine disseminierte kutane Leishmaniose und eine rezidivierende kutane Leishmaniose sind als Komplikationen ist möglich.
Differentialdiagnosen
Differentialdiagnosen für die kutanen Leishmaniose-Läsionen sind gemäß der Leitlinie für Diagnostik und Therapie der kutanen und mukokutanen Leishmaniasis in Deutschland:[3] Ekthyma oder erosiv-ulzerierte Pyodermien, verschiedene Hauttuberkulosen, Buruli-Ulkus, Schwimmbadtuberkulome durch Mycobacterium marinum, Primärherd einer Syphilis, Lepra, tiefe Trichophytie bzw. entzündlich-pustulöse Tinea sowie verschiedene Hauttumore.
Mukokutane Leishmaniose
Die mukokutane Leishmaniose (Espundia, Chicle ulcer, Uta) ist eine durch Erreger des Leishmanien-Subgenus Viannia hervorgerufene Infektionskrankheit, die durch Läsionen der Schleimhäute des Nasenrachenraums sowie zusätzlich des Kehlkopfs und der Luftröhre gekennzeichnet ist. Geschätzt mehr als 90% aller Fälle werden durch Erreger der Spezies Leishmania brasiliensis ausgelöst, die verbleibenden Erkrankungen entfallen fast vollständig auf Leishmania panamensis. Spezielles Merkmal der Erreger ist eine hämatogene oder lymphogene Disseminierung, die bei nicht systemisch behandelter kutaner Primärinfektion in ca. 5% der unbehandelten Fälle Monate oder Jahre später zum Auftreten einer mukokutanen Leishmaniose im Nasenrachenraum führt.
Gemäß WHO[2] gilt nur die durch Viannia-Leishmanien ausgelöste Schleimhautinfektion des Nasenrachenraums als mukokutane Leishmaniose im engeren Sinne. Durch andere Leishmanien-Spezies bedingte Erkrankungen können, meistens im Fall von Komplikationen, ebenfalls den Mund-, Nasen-, und Rachenraum befallen, im Allgemeinen aber gleichzeitig mit dem Auftreten der kutanen Läsionen.
Mindestens 2/3 der Symptome treten im Anfangsstadium an Schleimhäuten der Nase auf, und zwar zunächst meist am Nasenseptum. Ebenfalls betroffen sein kann die Schleimhaut von Gaumen, Rachen, Kehlkopf und Luftröhre. Milde Symptome sind Erytheme, Erosionen, weiter Knoten und Granulome mit späterer Ulzeration und Verkrustung. Zusätzlich liegt eine permanent verstopfte oder laufende Nase sowie Nasenbluten vor. Die Perforation der Nasenscheidewand oder das Auftreten milder Symptome in mehreren Geweben werden als moderate Krankheitsausprägung eingestuft, ebenso häufige Heiserkeit sowie permanente hyperämische Schwellungen der Nasenhaut. Schwerwiegende Symptome sind physische Obstruktionen im Nasen- und Rachenbereich und schließlich schwerste Entstellungen im Nasen-, Mund- und Rachenraum sowie der Lippen. Diese Symptome führen ohne systemische Behandlung besonders unter Mitwirken von Sekundärinfektionen häufig zum Tod.
siehe auch: Leishmaniasis braziliensis
Viszerale Leishmaniose
Hauptsächlicher Erreger der viszeralen Leishmaniose (Kala-Azar, Dumdum-Fieber) ist Leishmania donovani. Befallen werden die Makrophagen der inneren Organe, besonders der Milz, der Leber und des Knochenmarks. Symptome sind u.a.:
- Fieber
- Hepatosplenomegalie
- Anämie und Panzytopenie
- Diarrhoe
- Hypergammaglobulinämie
- makulöse Hyperpigmentierung der Haut
Bei fortschreitendem Krankheitsverlauf kommt es zu Auszehrung, Apathie und allgemeiner Immunschwäche. Bedingt durch die Immunschwäche können weitere Infektionskrankheiten auftreten. Vor allem durch den Einfluss dieser Sekundärinfektionen nimmt die viszerale Erkrankung ohne Behandlung in etwa 90% der Fälle einen tödlichen Verlauf.
Bei unklarem Fieber mit Hepatosplenomegalie ist als Differentialdiagnose an eine viszerale Leishmaniose zu denken. Im Allgemeinen wird man von einer Reise-Leishmaniose ausgehen. Autochthone Leishmania-Infektionen sind möglich, aber äußerst selten.
Differentialdiagnosen der viszeralen Leishmaniose sind:
- Infektion mit Salmonella Typhi - Fieber mit Exanthem
- Infektion mit Salmonella Paratyphi mit Durchfall
- Shigellose
Prävention
Leishmanien werden durch Sandmücken von infizierten Hunden, Nagetieren oder anderen Reservoirwirten durch Stich auf den Menschen übertragen, bei Leishmania donovani und Leishmania tropica durch den Vektor von Mensch zu Mensch. Hauptübertragungszeit durch die Mücken im Mittelmeerraum ist der Sommer (Juni-Oktober). In Regionen mit warmen Wintern und ausgeprägter Regenzeit können auch andere saisonale Bedingungen gelten, über die man sich vor einer Reise erkundigen sollte.
Die Sandmücken sind an ihren sehr langen Beinen und V-förmigen bzw. schmetterlingsartig stehenden Flügeln zu erkennen. Sandmücken gelten als schlechte Flieger und sind eher in Bodennähe zu finden. Insbesondere vor dem Zustechen werden hüpfende Bewegungen beobachtet.[4] Sandmücken werden von Kohlendioxid und Duftstoffen des menschlichen Körpers angezogen.
Die gängigen groben Mückennetze schützen nicht vor diesen Insekten, die deutlich kleiner als Stechmücken sind. Zum Schutz während des Schlafes sind Netze mit einer Maschengröße von nur 1,2 mm nötig. Durch engmaschige und imprägnierte Insektenschutznetze kann die Infektionsrate um 60 bis 100% reduziert werden.
Mückennetze und unbedeckte Haut sollten mit Repellents (z.B. Nobite®, Autan®) eingesprüht werden. Sandmücken stechen mit Vorliebe in die freiliegende Haut von Gesicht, Nacken, Knöcheln und Händen.
Schwangere werden wesentlich häufiger von Sandmücken attackiert als andere Personen und sollten deshalb unbedingt Präventionsmaßnahmen ergreifen.
Die Meidung von Hochendemiegebieten in der Übertragungszeit ist eine einfache Prophylaxe für Touristen. Luftströmung (Klimaanlagen) und das Übernachten in höheren Stockwerken wehren die Sandmücken ab. Regionale Bekämpfungsmaßnahmen reduzieren die Sandmückendichte um 25-72%.[5]
Diagnostik
Klinisch wegweisend sind typische Läsionen einer kutanen oder mukokutanen oder mehrere der genannten Symptome einer viszeralen Leishmaniose, insbesondere nach einem Aufenthalt in Endemiegebieten.
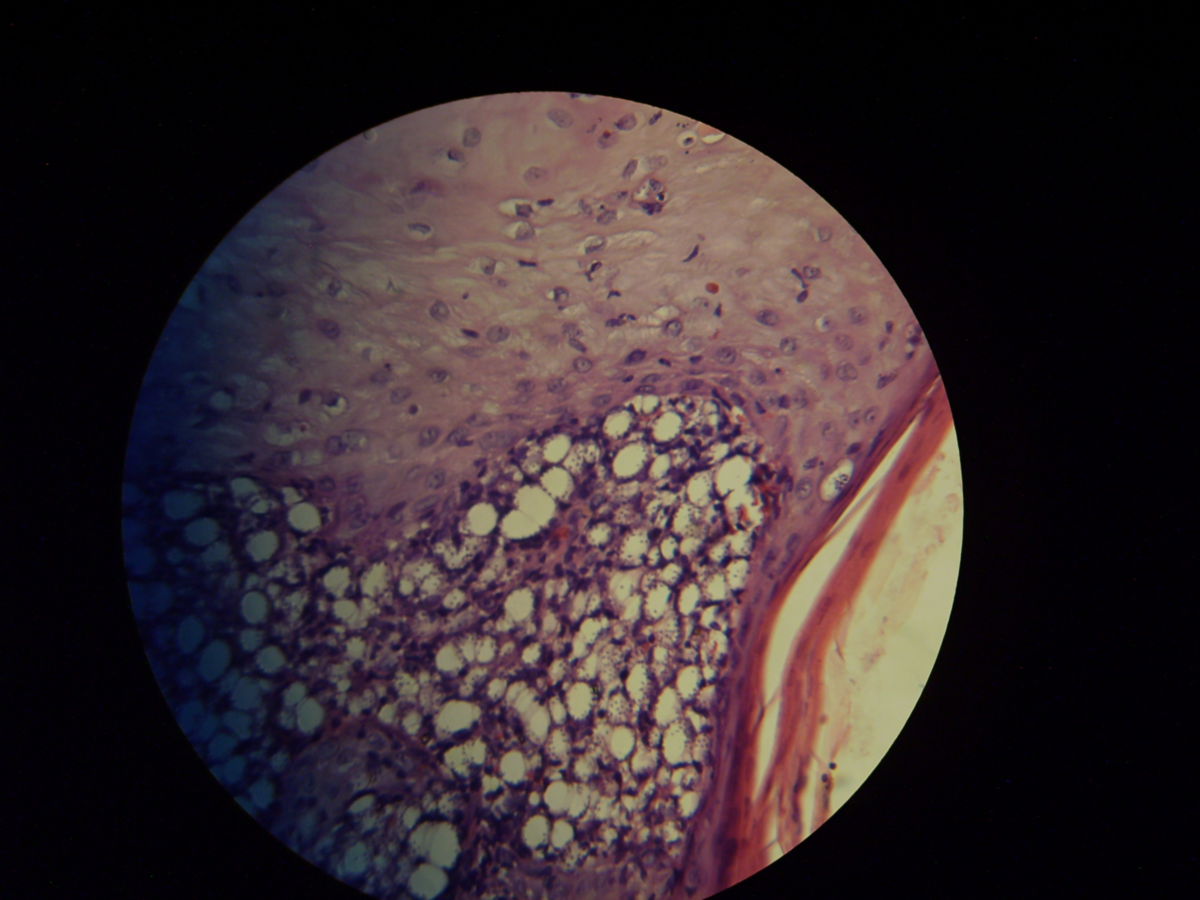
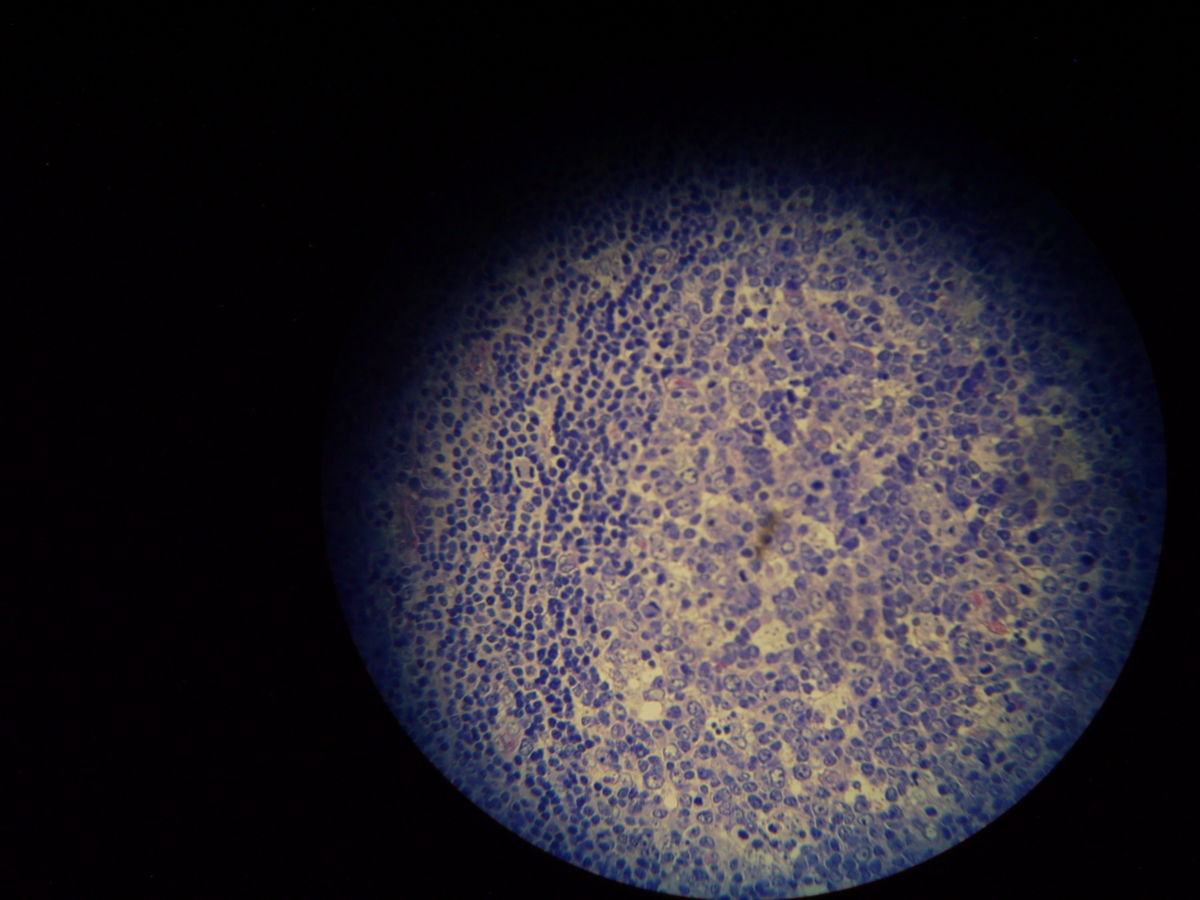
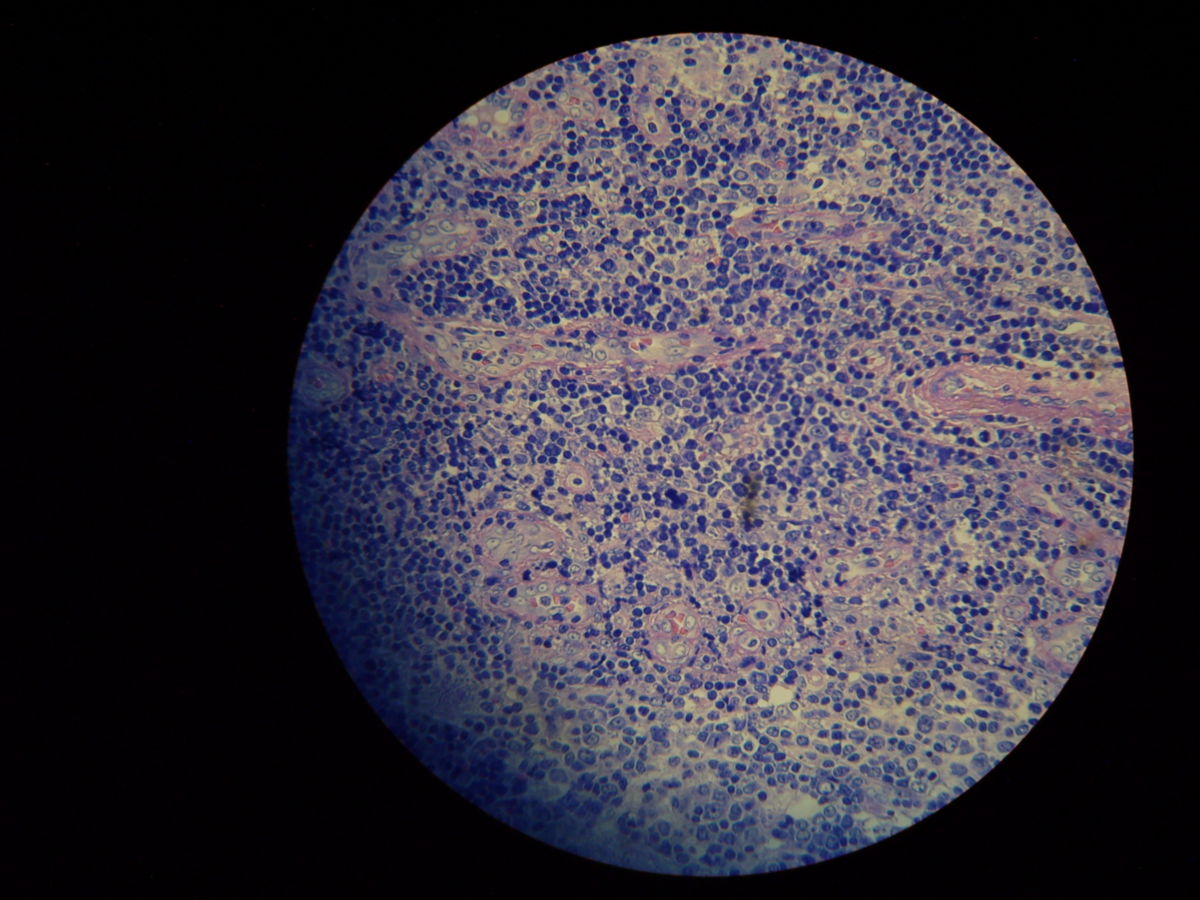
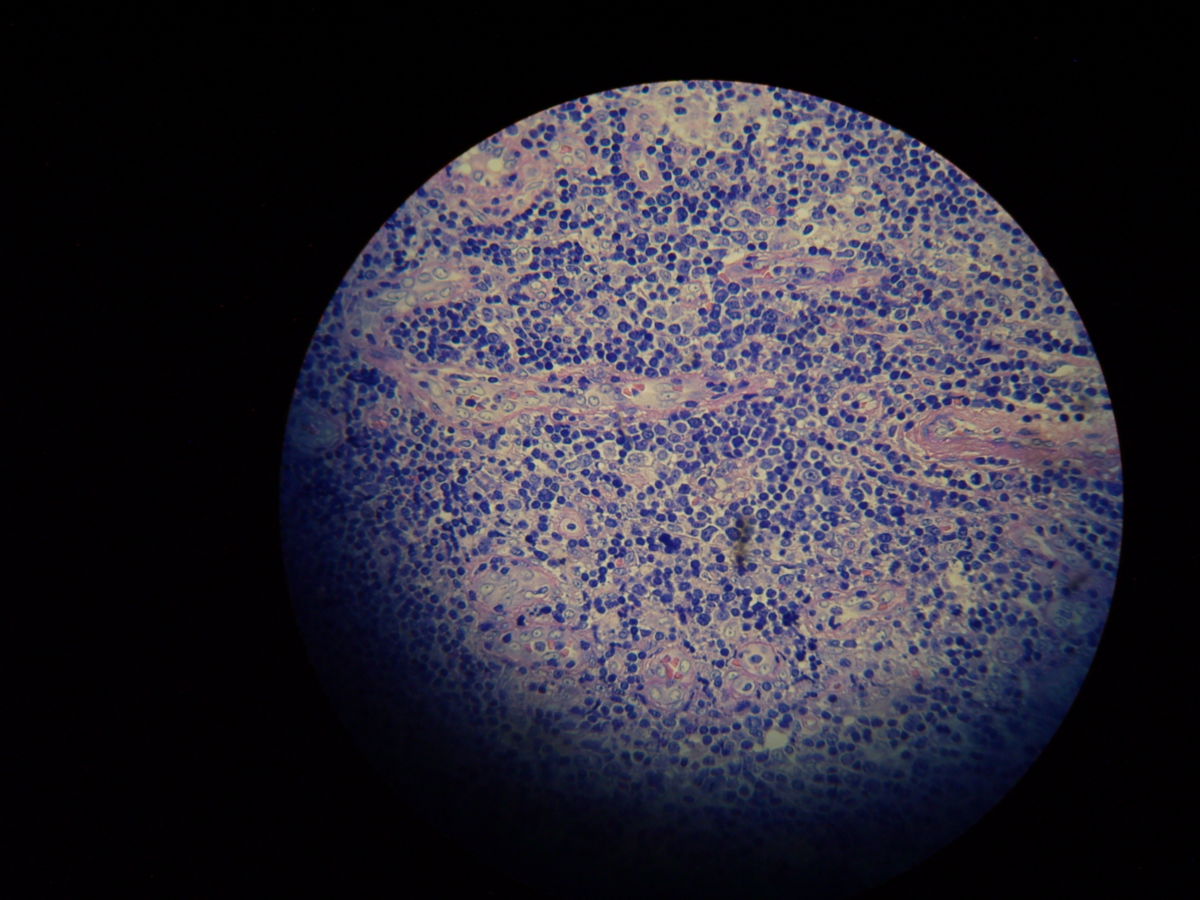
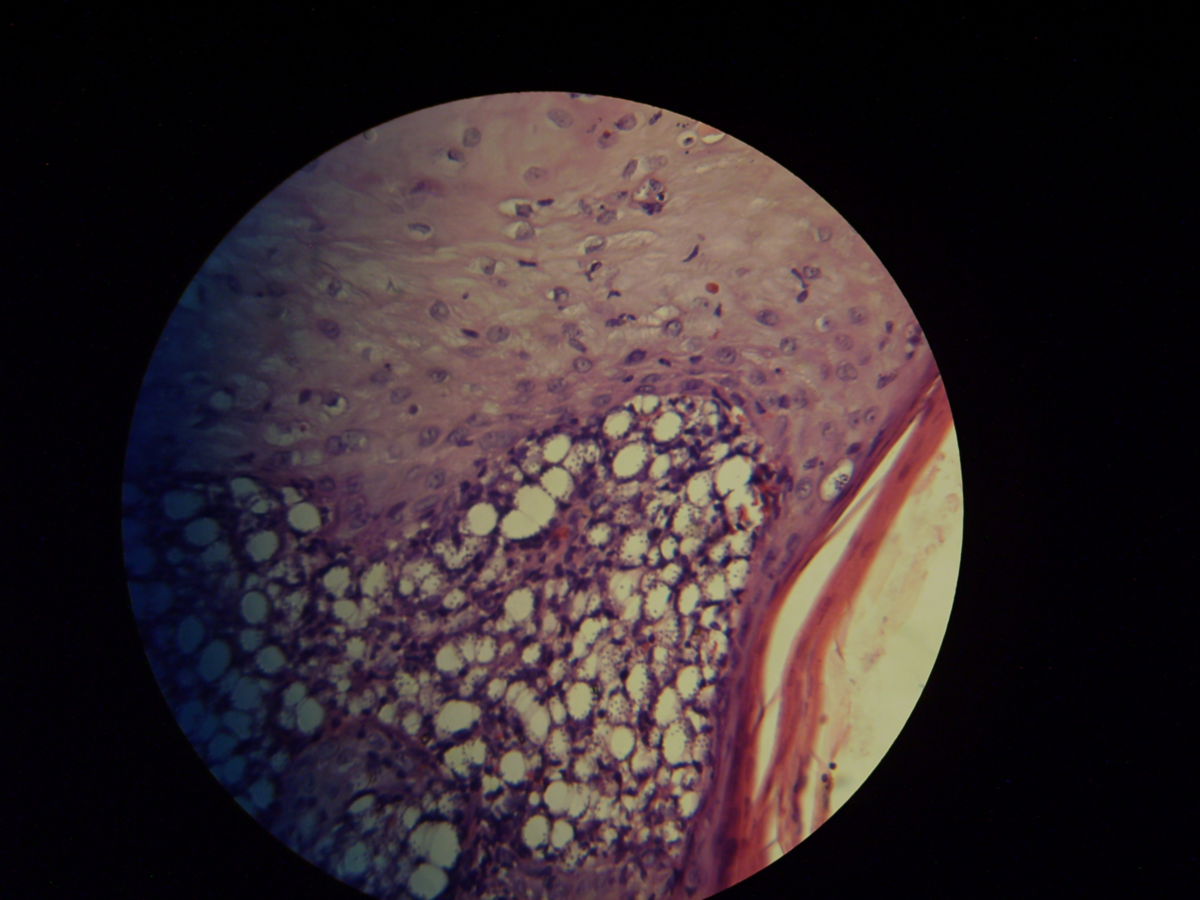
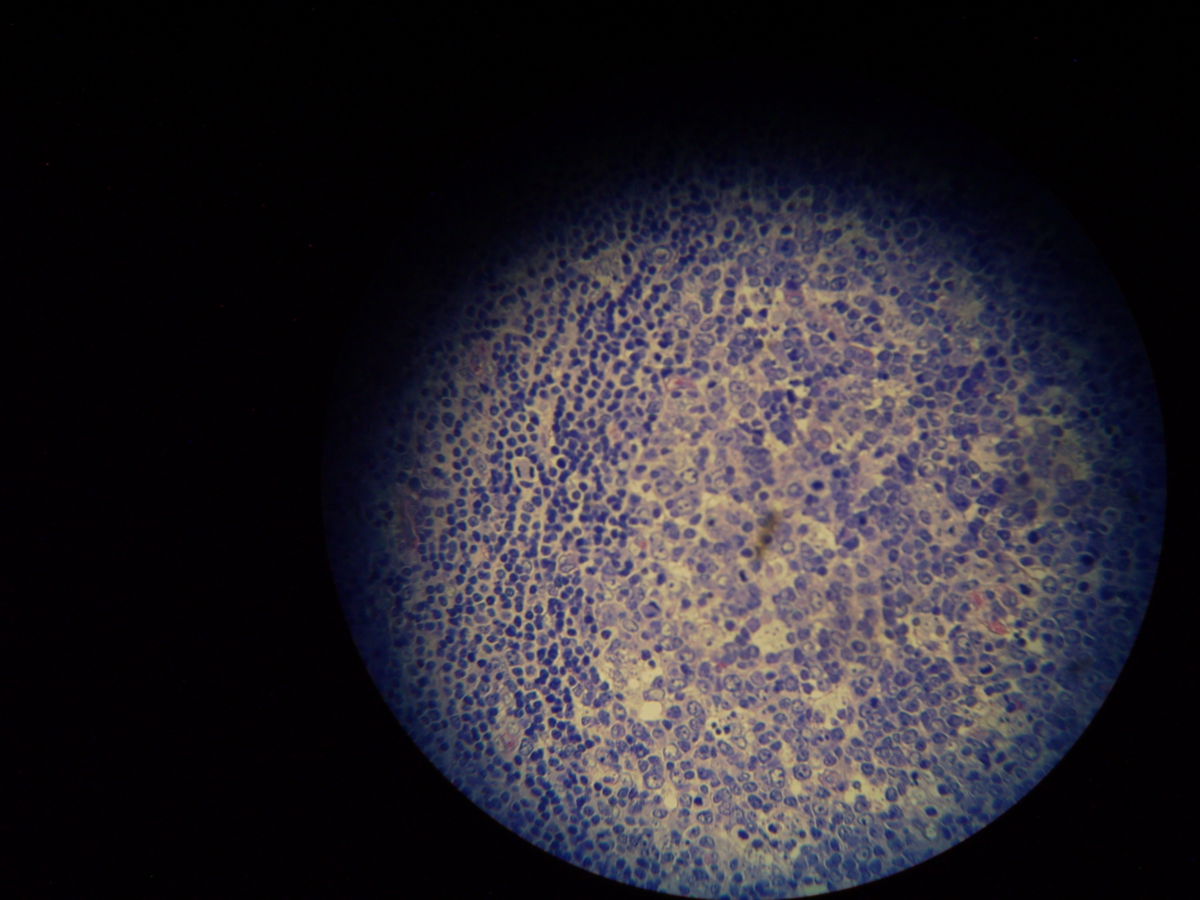
Pathohistologie
Die Mikroskopie von Stanzbiopsaten aus Ulkusrändern unter Giemsa- oder Leishman-Färbung mit Darstellung des charakteristischen Kinetoplasten ist die Methode der Wahl. Bei der viszeralen Leishmaniose ergeben Milzbiopsate die höchste Sensitivität (98%), vor Lymphknoten- und Knochenbiopsaten (60-85%).
Serologie
Serologische Verfahren erlauben keine Aussage über die Krankheitsaktivität, da auch Gesunde oder ausgeheilte Erkrankte Leishmanien-Antikörper zeigen. Mit dem Leishmanin-Skin-Test (LST, Montenegro-Test) wird durch Nutzung einer Überempfindlichkeitsreaktion vom verzögerten Typ ab dem dritten Monat der Erkrankung eine kutane Leishmaniose nachgewiesen. Der Montenegro-Test ist positiv beim Auftreten von Verhärtungen innerhalb von 72 Stunden nach intradermaler Injektion von ganzen abgetöteten Promastigoten (Leishmanin mit (0,1 bis 1) x 107 Promastigoten pro ml) oder Leishmanien-Protein (250 μg / ml) als Antigen. Er wird vor allem in Endemiegebieten eingesetzt.
In Feldstudien wird neben dem Leishmanin-Skin-Test auch kostengünstig der kommerzielle rK39-Strip-Test (In-Bios®; Sensitivität 67-100%, Spezifität 90-100%) eingesetzt. HIV-Koinfektionen heben die serologische Diagnostik häufig auf. Bei Immunsupprimierten mit viszeraler Leishmaniose kann der mit der Parasitenlast korrelierende Latexagglutinationstest (KAtex, Sensitivität 68-100%, Spezifität 100%) als Antigennachweis eingesetzt werden.
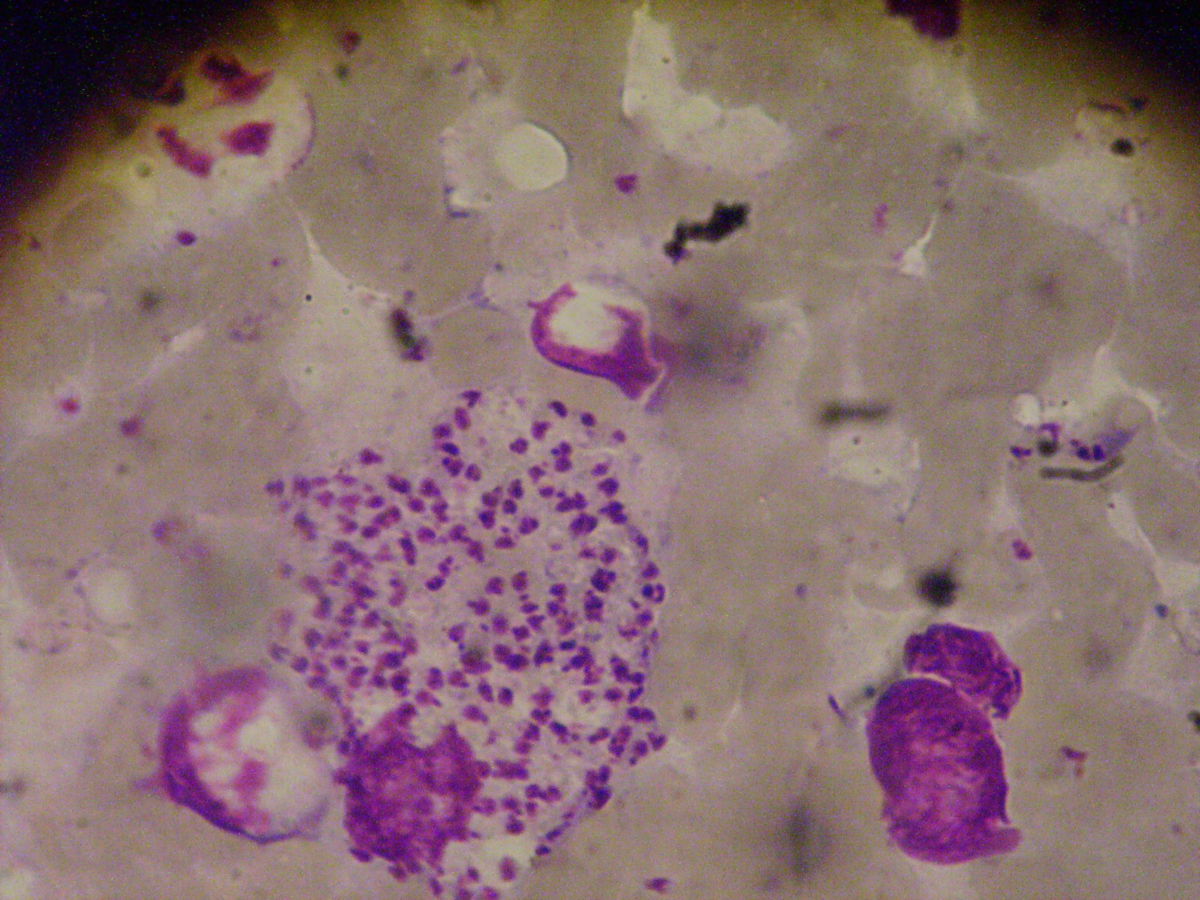
Indirekt kann der Nachweis der intrazellularen amastigoten unbegeißelten Leishmanien in Makrophagen mit Immunfluoreszenz-Antikörpern erfolgen. Eine serologische Differenzierung der einzelnen Leishmanienarten ist durch Bestimmung von Isoenzymen möglich. Sie hat Relevanz für die Beurteilung der Virulenz und der Empfindlichkeit für Therapeutika, ist aber aufgrund der Kosten in Endemiegebieten meist nicht im Einsatz.
Serologische Verfahren können Kreuzreaktionen mit Trypanosomen zeigen. Im Serum kommt es bei der viszeralen Leishmaniose unspezifisch zu einer Hypergammaglobulinämie, Anämie und Panzytopenie.
PCR
Bei der Behandlung von Leishmaniosen in entwickelten Ländern ist zunächst eine Leishmanien-Spezies-Bestimmung sinnvoll. Ein molekularbiologischer Nachweis mittels PCR plus Sequenzierung und/oder ein multipler Restriktionsverdau (RFLP) zur Identifizierung der Leishmanien-DNS gilt aufgrund seiner hohen Sensitivität derzeit als Goldstandard.[3] Aufgrund des hohen Laboraufwands und der erheblichen Kosten der Speziesbestimmung ist ein solcher Nachweis in Endemiegebieten nicht praktikabel.
Mikrobiologie
Enthalten Gewebeproben z.B. der mukokutanen Leishmaniose nur wenige Leishmanien, können Kulturen auf zweiphasigem Novy-MacNeal-Nicolle-Medium (NNN-Medium) oder Tobie-Medium zur Diagnosesicherung herangezogen werden. Die aus dem Biopsat gewonnenen Amastigoten wandeln sich im (extrazellulären) Nährmedium in replikative Promastigoten um, die mikroskopisch oder auch mit weiteren Tests (z.B. PCR-Test) untersucht werden können.
Therapie
Die folgenden Therapieempfehlungen basieren auf den verschiedenen Leitlinien der Deutschen Gesellschaft für Tropenmedizin und Internationale Gesundheit (DTG), wurden aber inhaltlich gekürzt.[3][6] In weniger entwickelten Ländern ist das in den deutschen Leitlinien skizzierte Vorgehen meist nicht verfügbar, so dass dort von anderen, kostengünstigeren Optionen Gebrauch gemacht wird. In den Leitlinien der WHO ist pentavalentes Antimon der wichtigste Wirkstoff zur systemischen Behandlung von Leishmaniosen.[2] Er wird breiter eingesetzt als bei der DTG.
Die deutschen Leitlinien gehen davon aus, dass für jede Infektion der Erreger bekannt ist. Bei kutanen Leishmaniosen wird noch zwischen einfachen und komplexen Läsionen unterschieden. Die vorgeschlagene primäre Behandlungsoption ist häufig pro Leishmanien-Spezies und eventuell noch pro Endemiegebiet unterschiedlich.
Kutane Leishmaniose
Lokale Behandlung
Für eine lokale Behandlung eignen sich einfache Läsionen der Alten Welt bzw. durch Leishmania mexicana bewirkte einfache Läsionen. Eine einfache Läsion ist eine einzelne Läsion bzw. eine Läsion einer Gruppierung von höchstens 3 zusammengehörigen Läsionen, von denen keine einen Durchmesser von mehr als 40 mm hat. Eine lokale Behandlung ist bei einfachen Läsionen auch anderer Leishmanien-Spezies (zwischenzeitlich) angezeigt, wenn aus bestimmten Gründen eine an sich erforderliche systemische Therapie aktuell nicht möglich ist (z.B. Schwangerschaft).
- Periläsionales Antimon: Gabe von pentavalentem Antimon Sb5+ (via Meglumin-Antimonat in Glucantime®) in Form periläsionaler Injektionen um und unter die Läsion, und zwar 1-3 ml 2-3-mal im Abstand von 1-2 Tagen. Auch verschiedene andere Dosierungen werden diskutiert.
- Kryotherapie (i.a. flüssiger Stickstoff)
- Thermotherapie (z.B. 50 Grad Celsius, für 30 Sekunden). Leishmanien sind temperaturempfindlich, allerdings sind die Verfahren bisher nicht standardisiert.
- Selbstheilung der Läsionen abwarten. Nach Auffassung der DTG ist die durch Selbstheilung gewonnene Immunität in Deutschland nicht relevant. Es wird daher in Normalfall eine lokale Therapie zur Vermeidung von unschönen Narben angestrebt.
Die Präferenzen sind für verschiedene Leishmanien-Spezies verschieden. Auch die Kombination von periläsionalem Antimon mit Kryotherapie oder Thermotherapie wird für bestimmte Spezies vorgeschlagen. Der Erfolg einer Behandlung mit Kryotherapie oder pentavalentem Antimon wird in Metaanalysen mit rund 67% angegeben.[7] Allgemein empfiehlt die deutsche Leitlinie bei Läsionen bis etwa 2 cm eine Kryotherapie, deren Ergebnisse durch eine Kombination mit periläsionalem Antimon verbessert werden können.[3]
Systemische Behandlung
Systemisch behandelt werden grundsätzlich
- komplexe kutane Leishmaniosen
- durch Leishmanien vom Subgenus Viannia oder Leishmania amazonensis bewirkte Infektionen
- rezidivierende, disseminierte und diffuse kutane Leishmaniosen.
Merkmal einer komplexen kutanen Leishmaniose ist das Vorhandensein von mehr als 3 Läsionen oder einer Einzelläsion von mehr als 40 mm Durchmesser, von potentiell stigmatisierenden Läsionen, von Satellitenläsionen entlang von Lymphbahnen oder von therapierefraktären Läsionen.
Die folgende Tabelle zeigt die am häufigsten genannten Behandlungsoptionen. Leishmania infantum kann eine kutane und/oder viszerale Leishmaniose bewirken und ist weltweit vertreten. Bei Infektionen mit Leishmania major, Leishmania tropica, Leishmania infantum und Leishmania mexicana ist die systemische Behandlung nur im Falle komplexer kutaner Leishmaniosen erforderlich.
| Wirkstoff und Dosis | Leishmanien-Spezies |
|---|---|
| Sb5+: 20 mg/kgKG pro Tag i.v. plus Pentoxifyllin oral zu 400 mg/8 h, über 20 Tage | L. brasiliensis, L. peruviana, L. naiffi, L. amazonensis, L. infantum |
| LAmB (AmBisome®): 2–3 mg/kgKG pro Tag mittels Infusion bis zu einer Gesamtdosis von 40 mg/kg KG | L. brasiliensis, L. peruviana, L. naiffi, L. amazonensis |
| Miltefosin (Impavido®): ab 45 kgKG -> 150 mg oral pro Tag für 28 Tage | L. mexicana, endemiegebietabhängig: L. brasiliensis, L. peruviana, L. naiffi, L. amazonensis, L. major, L. infantum |
| Ketoconazol (200 mg Tabletten) 600 mg oral pro Tag für 28 Tage | L. mexicana, L. panamensis, L. major, L. tropica |
| L. = Leishmania (Spezies); Sb5+ = Pentavalentes Antimon; LAmB = Liposomales Amphotericin B; i.v. = intravenös; "Infusion" impliziert "intravenös". | |
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Behandlungsdauer und Dosis gelten nicht für rezidivierende, disseminierte und diffuse kutane Leishmaniosen. Diese werden meistens mit pentavalentem Antimon behandelt, eventuell in höherer Dosierung und eventuell in mehreren Therapiezyklen zu 20-30 Tagen.
Außer Miltefosin (für Infektionen durch bestimmte Leishmanien-Spezies) sind die erwähnten Wirkstoffe in Deutschland nicht zugelassen. Die Therapien mittels Sb5+ und LAmB umschreiben Chemotherapien mit erheblichen Nebenwirkungen, deren Erfolg keinesfalls gesichert ist. Ein niedergelassener Arzt, der eine Therapie eigenständig durchführen möchte, sollte die rechtlichen Aspekte der Behandlung stets im Auge haben.
Mukokutane Leishmaniose
Eine mukokutane Leishmaniose wird stets systemisch behandelt, und zwar mit den gleichen Wirkstoffen, mit denen die Viannia-Leishmaniose therapiert wird, als deren Spätfolge sie auftritt. Wie erwähnt, werden 90% aller mukokutanen Leishmaniosen durch Leishmania brasiliensis bewirkt, der Rest fast ausschließlich durch Leishmania panamensis. Im Allgemeinen wird die Therapiedauer verlängert, manchmal wird auch die Dosis erhöht. Pentavalentes Antimon und Pentoxifyllin werden für 30 Tage verabreicht, liposomales Amphotericin B bis zu einer Gesamtdosis von 60 mg/kg KG.
Viszerale Leishmaniose
Viszerale Leishmaniosen werden stets systemisch behandelt.
| Wirkstoff und Dosis | |
|---|---|
| LAmB: mindestens 5 Einzeldosen je 3–4 mg/kg KG mittels Infusion über 10-21 Tage (z.B. 3-4 mg/kgKG täglich am Tag 0,1,2,3,4 und 10), bis zu einer Gesamtdosis von 20 mg/kgKG | |
| Miltefosin: tägliche Dosis von 1,5 bis 2,5 mg/kgKG oral, bis max. 150 mg/Tag. Behandlungsdauer 28 Tage. | |
| LAmB = Liposomales Amphotericin B; "Infusion" impliziert "intravenös". | |
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Therapeutischer Ausblick
Die amastigote unbegeißelte Form der Leishmanien überlebt in den dendritischen Langerhans-Zellen der Haut und den Makrophagen und ist damit der körpereigenen Abwehr nicht zugänglich.
Es hängt vom Immunstatus der Makrophagen und des Wirtes ab, ob die Leishmanien-Zellmembranen in kleine Antigene von weniger als 20 Aminosäuren zerkleinert werden, die dann von den MHC-II-Rezeptoren dieser Makrophagen oder dendritischen Hautzellen den immunkompetenten T-Helfer-Zellen präsentiert werden können. Erst dann ist eine wirksame, körpereigene Abwehr der Leishmanien möglich.
Von den Brucellen, die auch in den Makrophagen überleben, ist bekannt, dass Membranlysate, die subkutan verabreicht werden, zu einer Stimulierung der zellulären und humoralen Abwehr, nicht nur gegen Brucellen führen. Bei den Leishmanien bleibt abzuwarten, ob immunstimulatorische Maßnahmen dieser Art Erfolg haben werden.
Quellen
- ↑ Dube U, Eichenfield D. Cutaneous Leishmaniasis. N Engl J Med. 2025 - Fallbericht mit Abb.
- ↑ 2,0 2,1 2,2 2,3 2,4 Control of the leishmaniases WHO Technical Report 949, WHO 2010
- ↑ 3,0 3,1 3,2 3,3 3,4 Diagnostik und Therapie der kutanen und mukokutanen Leishmaniasis in Deutschland AWMF-Register 042/007 – Leitlinie der Deutschen Gesellschaft für Tropenmedizin DTG, November 2010, abgerufen am 27.3.2021
- ↑ Walochnik, J., Aspöck, H.: Sandmücken, Leishmanien und Leishmaniosen - neue Dimensionen alter Krankheiten In: H. Aspöck (Hrsg.) Krank durch Arthropoden, Denisia 30 (2010): 673–694.
- ↑ Stauch, A., Duerr, H.-P., Picado,A. et al.: Model-Based Investigations of Different Vector-Related Intervention Strategies to Eliminate Visceral Leishmaniasis on the Indian Subcontinent PLoS Negl Trop Dis 8(4): e2810. doi:10.1371/journal.pntd.0002810.
- ↑ Diagnostik und Therapie der viszeralen Leishmaniasis (Kala-Azar) AWMF-Register 042/004 – Leitlinie der Deutschen Gesellschaft für Tropenmedizin DTG, Stand März 2012, abgerufen am 31.12.2021
- ↑ López-Carvajal, L et al.: Efficacy of cryotherapy for the treatment of cutaneous leishmaniasis: meta-analyses of clinical trials BMC Infect Dis. 2016; 16: 360. Published online 2016 Jul 26. doi: 10.1186/s12879-016-1663-3 PMCID: PMC4960741 PMID: 27456008