Embryogenese
Synonym: Embryonalentwicklung
Englisch: embryogenesis
Definition
Die Embryogenese ist der biologische Prozess, der zur Bildung des Embryos führt. Er dauert etwa 8 Wochen, beginnt mit der Befruchtung der Eizelle und endet mit dem Beginn der Fetogenese.
Den Zeitraum der Embryogenese bezeichnet man als Embryonalperiode.
Einteilung
...nach Zeitraum
Die Embryogenese wird in zwei Abschnitte untergliedert, und zwar in:
- die präembryonale Phase (1.-3. SSW p.c.): In dieser Zeit entstehen die drei Keimblätter. Sie umfasst die Entwicklung der Zygote zur Blastozyste, die Blastogenese.
- die Embryonalphase im engeren Sinn (4.-8. SSW p.c.): In dieser Periode formen sich die embryonalen Organanlagen.
Manche Lehrbücher teilen die Phasen anders ein. Als Vorembryonalperiode wird zum Beispiel nur die erste Entwicklungswoche definiert und dabei der Zeitpunkt der Implantation als Zäsur gesetzt.
...nach Organsystem
In der speziellen Embryologie wird die Embryogenese häufig in Bezug auf einzelne Organe oder Körperteile untergliedert, z.B.:
Präembryonale Phase
Befruchtung
Die Befruchtung dauert insgesamt ungefähr 24 Stunden. Nach dem Eisprung (Ovulation) wird die Eizelle in Richtung Isthmus tubae uterinae transportiert. Dort beginnt die Befruchtung (Konzeption, Fertilisation) mit der Imprägnation (Eindringen der Spermatozoons in die Eizelle). Durch die Akrosomreaktion mit Freisetzung lysosomaler Enzyme durchdringt das Spermatozoon die Zona pellucida. Anschließend verschmelzen die Zellmembranen von Samen- und Eizelle. Hierbei depolarisiert die Eizelle und entleert ihre kortikalen Granula. Dies führt zum Polyspermieblock, der dafür sorgt, dass keine weiteren Samenzellen in die Eizelle eindringen. Der Kern des Spermatozoons dekondensiert und bildet einen männlichen Vorkern.
Gleichzeitig beendet die Eizelle die zweite Reifeteilung der Meiose, sodass ein weiblicher Vorkern entsteht. Beide Vorkerne durchlaufen die S-Phase, bevor es zur Vereinigung (Syngamie) kommt. So entsteht die diploide Zygote. Erst werden die paternalen und maternalen Chromosomen unmittelbar in eine gemeinsame Mitosespindel aufgenommen, dann erfolgt eine Teilung der Zygote in zwei Blastomere. Das Spermatozoon liefert nur wenige Organellen für die Zygote, unter anderem das Zentriol sowie Mitochondrien. Letztere werden jedoch direkt abgebaut, sodass die Mitochondrien der Zygote mütterlicher Herkunft sind.
Falls die Eizelle nicht befruchtet wird, stirbt sie innerhalb 12 bis 24 Stunden nach Ovulation ab. Wenn es zur Eientwicklung ohne Spermatozoon kommt (Parthenogenese), scheitert die Weiterentwicklung bei Säugetieren spätestens im Somitenstadium an einer fehlerhaften Plazentabildung. Einige Vertebraten können sich jedoch parthenogenetisch vermehren.
Für das deutsche Embryonenschutzgesetz wurde die Vereinigung der Vorkerne als Beginn des schutzwürdigen embryonalen Lebens festgelegt. Je nach religiösen, kulturellen und ethischen Überzeugungen ergeben sich andere Zeitpunkte.
Furchung
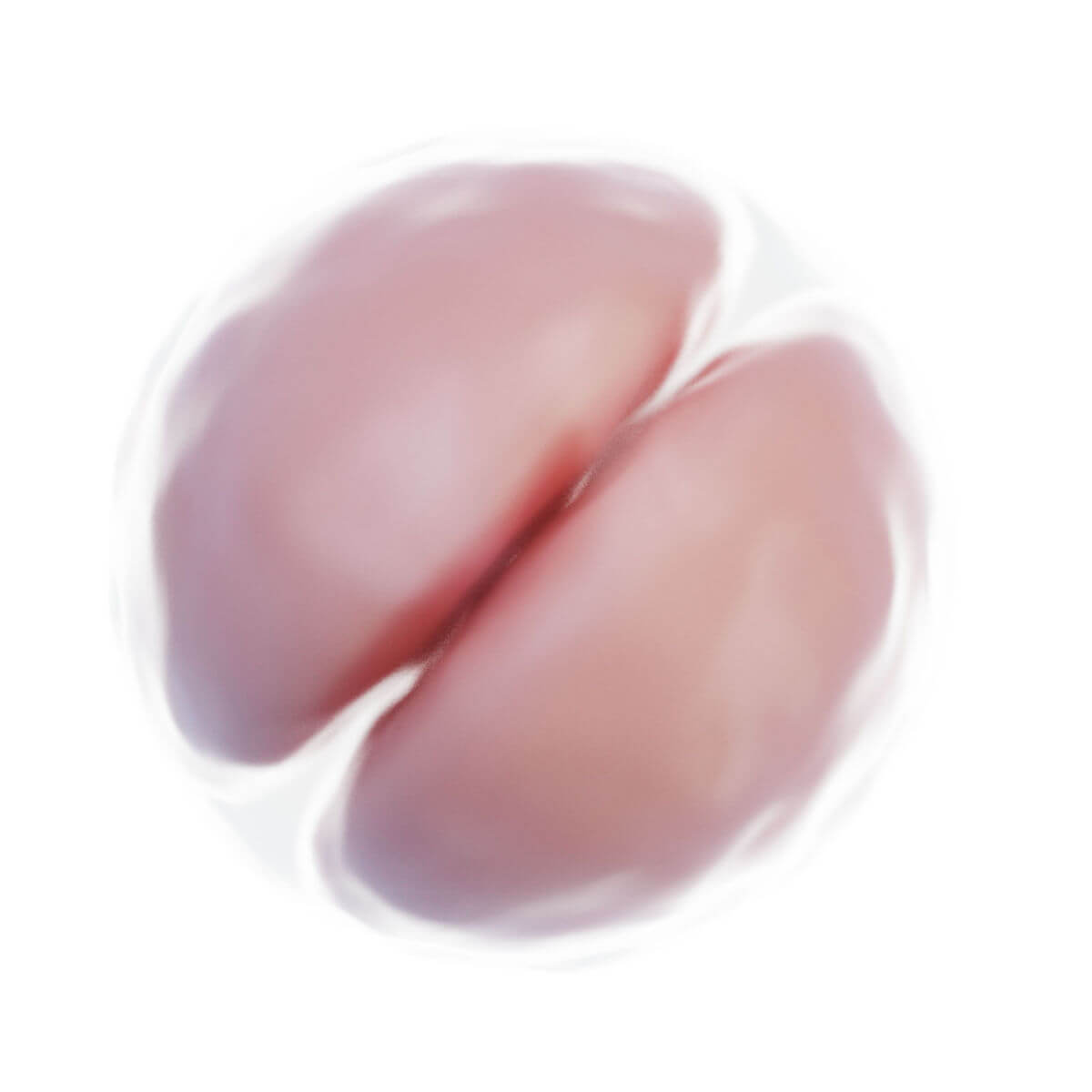
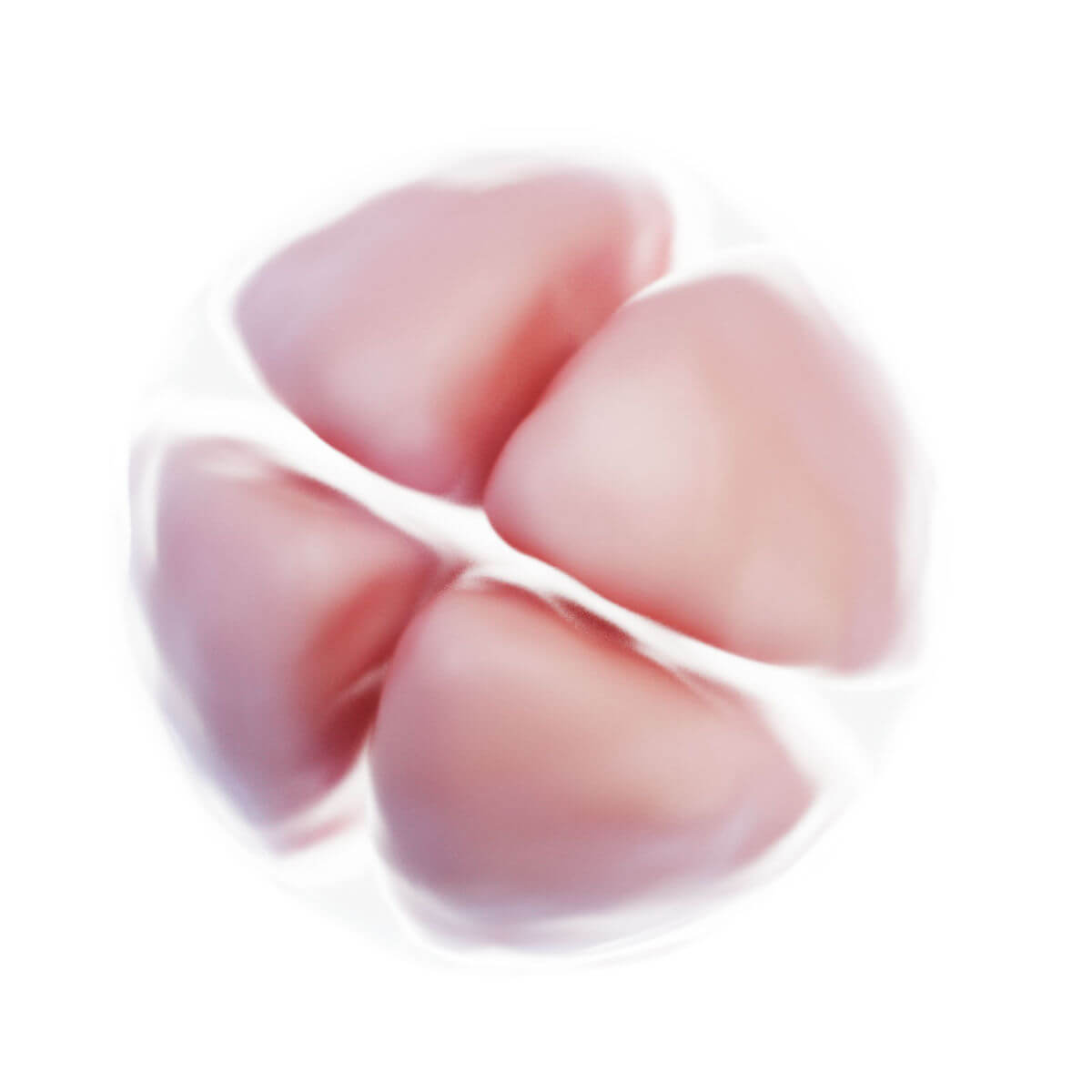
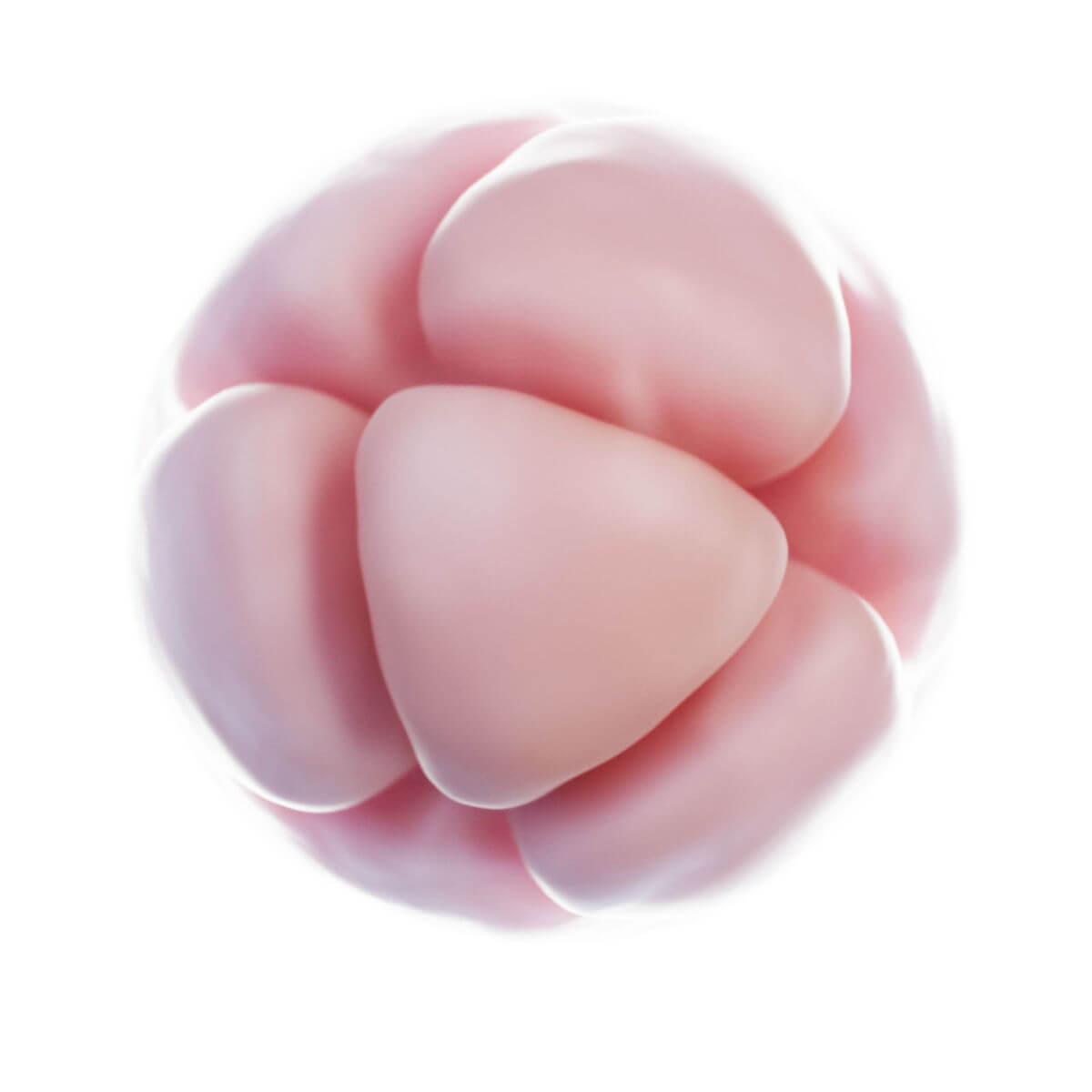
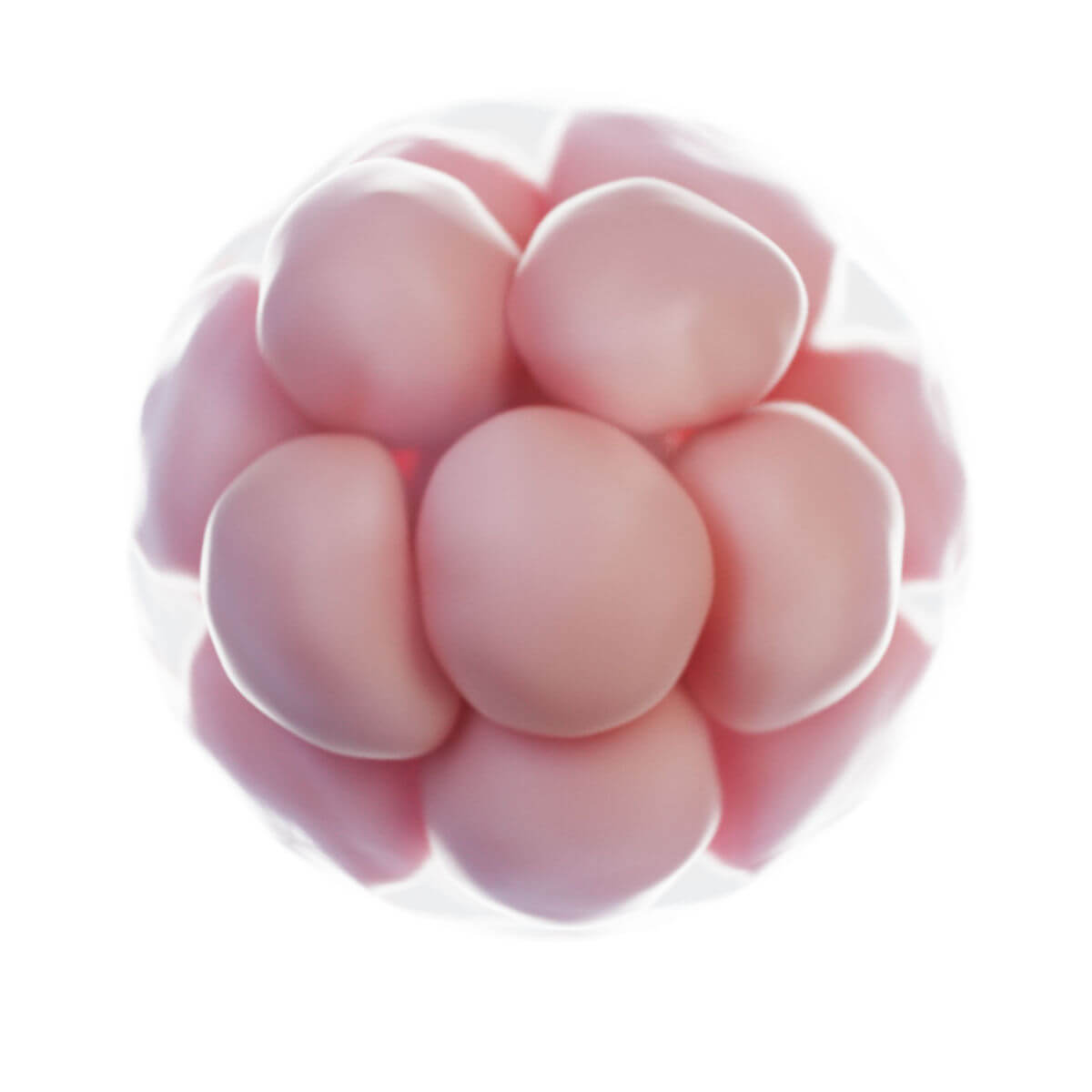
Innerhalb weniger Stunden nach Befruchtung entsteht auf der Oberfläche der Zygote unterhalb der Zona pellucida eine tiefe Furche. 30 Stunden nach Befruchtung entstehen durch Teilung zwei Tochterzellen, sogenannte Blastomere. Nach 40 Stunden liegen bereits 4 Zellen und nach drei Tagen 12 bis 16 Zellen vor. Der Keim wird nun als Morula bezeichnet. Der Durchmesser ist jedoch unverändert zur Eizelle, da die Zona pellucida das Gesamtvolumen konstant hält. Sie verhindert eine vorzeitige Implantation.
Kompaktierung
Zwischen dem 8- und 16-Zellstadium rücken die Zellen aneinander (Kompaktierung). Die Blastomere besitzen inzwischen schon eine unterschiedliche funktionelle Differenzierung und verlieren ihre Totipotenz. Eine äußere Zelllage entsteht durch Ausbildung von Zonulae occludentes mit E-Cadherin (Uvomorulin) und umschließt eine innere Zellmasse. Diese Musterbildung wird durch Diffusion von Morphogenen durch Nexus ermöglicht.
Blastozyste
Drei bis vier Tage nach Befruchtung tritt die Morula in die Gebärmutterhöhle ein. In der äußeren Zelllage erfolgt ein gerichteter Ionen- und Wassertransport mittels basolateraler Natrium-Kalium-ATPase und apikalen Natriumkanälen. Natrium wird in Richtung der inneren Zellmasse gepumpt und Wasser folgt passiv. Der Interzellularraum weitet sich zu einem exzentrischen, flüssigkeitsgefüllten Raum, der Blastozystenhöhle.
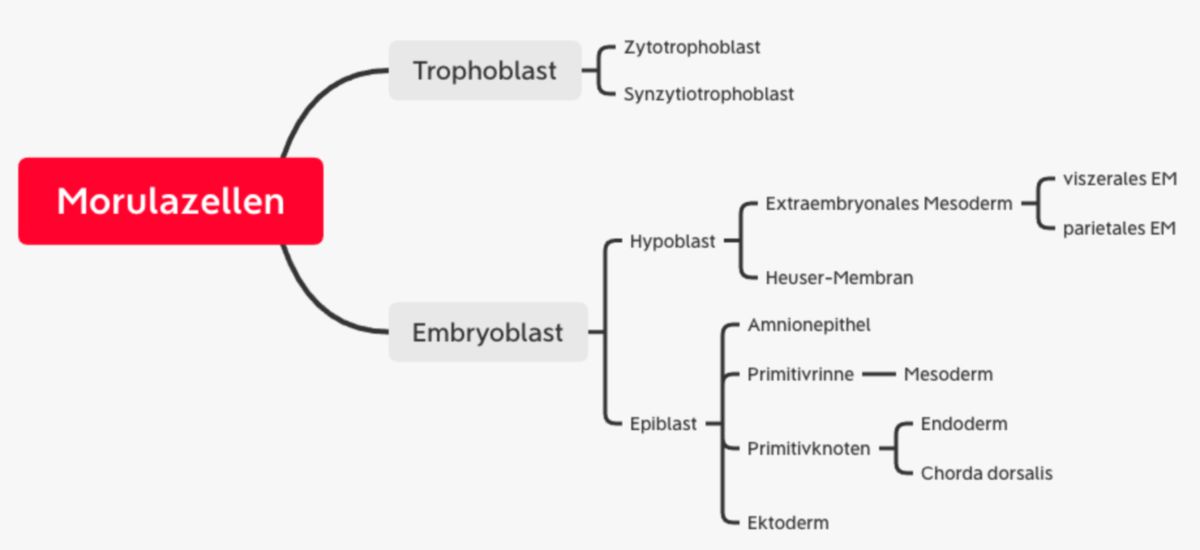
In diesem Blastozytenstadium bildet die innere Zellmasse eine Anhäufung an einer Seite der Blastozyste und wird Embryoblast genannt. Die äußere Zellschicht umgibt als einschichtiges Epithel die Blastozytenhöhle und wird als Trophoblast bezeichnet. Der Embryoblast ist pluripotent, die Trophoblastzellen werden zu Anteilen der Plazenta. Zu diesem Zeitpunkt beginnt die Auflösung der Zona pellucida ("Hatching") und 5 bis 6 Tage nach Befruchtung ist die Blastozyste implantationsreif.
Implantation
Zwischen dem 5. und 6. Tag nach Befruchtung heftet sich die Blastozyste an das Endometrium. Der Teil des Trophoblasts, der dem Embryoblast anliegt (polarer Trophoblast) nimmt den ersten Kontakt auf und teilt sich schneller als der restliche (parietale) Trophoblast. Die Zellen des polaren Trophoblasten wandern nach apikal und fusionieren miteinander, sodass zwischen Trophoblast und mütterlichem Gewebe der Synzytiotrophoblast entsteht. Der Trophoblast unter dem Synzytiotrophoblast bleibt bis in die Fetalperiode als einschichtiges Epithel erhalten (Zytotrophoblast) und liefert Nachschub für den Synzytiotrophoblasten. Der Synzytiotrophoblast wächst infiltrativ in die Uterusschleimhaut ein, bis er auf mütterliche Blutgefäße trifft. Etwa am 9. Tag schließt sich die Uterusschleimhaut über der Implantationsstelle. Am gegenüberliegenden Pol entsteht ebenfalls die Differenzierung in Zyto- und Synzytiotrophoblast. Im Inneren des Synzytiotrophoblasten entstehen Lakunen, die sich nach Eröffnung der mütterlichen Blutgefäße mit Blut füllen und sich später zu den intervillösen Räumen der Plazenta erweitern.
Zum Zeitpunkt der Implantation befindet sich die Uterusschleimhaut in der späten Sekretionsphase. Es kommt nicht zur Menstruation, da der Synzytiotrophoblast das humane Choriongonadotropin (HCG) produziert. Dieses Hormon stimuliert die ovarielle Synthese von Geschlechtshormonen und verhindert ein Absterben der Uterusschleimhaut.
Die Implantation findet an der hinteren oder vorderen Wand der Gebärmutterhöhle statt. Wenn die Blastozyste in der Nähe vom Zervixkanal implantiert, kann die Plazenta später den Geburtsweg versperren (Placenta praevia). Eine ektope Implantation außerhalb des Uterus (z.B. im Eileiter, in der Bauchhöhle) kann zur extrauterinen Gravidität führen.
Keimscheibe
Während der Implantation entstehen aus dem Embryoblasten zwei verschiedene Zelllagen: Die zur Blastozytenhöhle orientierten Zellen bilden ein einschichtiges Gewebe (Hypoblast, primitives/viszerales Endoderm). Die dem Trophoblasten anliegenden Zellen werden zu einem zylindrischen Epithel (Epiblast). Am achten Tag hat sich somit eine zweiblättrige Keimscheibe entwickelt.
Am Rand der Keimscheibe wandern die Hypoblastzellen nach lateral aus und bilden eine flache Epithelschicht an der Innenwand der Blastozystenhöhle, die später Heuser-Membran genannt wird. Die Blastozytenhöhle wird dann als primärer Dottersack bezeichnet
Gegenüberliegend konfluieren erweiterte Extrazellularräume zwischen den Epiblastzellen und dem polaren Trophoblasten zu einem flüssigkeitsgefüllten Hohlraum, der primären Amnionhöhle. Anschließend wandern Epiblastzellen aus und kleiden die Höhle aus (Amnioblast, Amnionepithel). Die Höhle wird dann sekundäre Amnionhöhle genannt.
Der Trophoblast wächst schneller als der Dottersack und die Amnionhöhle, sodass dazwischen Spalträume entstehen. Diese Spalträume werden von Hypoblastzellen besiedelt und werden dann extraembryonales Mesoderm (Retikulum) genannt. Später entsteht auch aus dem Primitivstreifen extraembryonales Mesoderm (siehe unten). Dieses lockere Netzwerk umhüllt die Amnionhöhle und den primären Dottersack.
Spalträume zwischen den Zellen des extraembryonalen Mesoderms konfluieren zu einem Hohlraum, dem extraembryonalen Zölom (Chorionhöhle). Dieses trennt das extraembryonale Mesoderm in eine parietale Schicht (dem Zytotrophoblasten anliegend) und eine viszerale Schicht (Amnion und Dottersack überziehend). Das parietale Mesoderm bildet mit dem Zyto- und Synzytiotrophoblasten das Chorion, aus dem der fetale Teil der Plazenta entsteht.
Zwischen Chorion und Amnion bleibt eine verbindende Mesodermbrücke erhalten, der sogenannte Haftstiel. Er liegt später am kaudalen Ende der Keimscheibe.
Gastrulation
Die Gastrulation beginnt mit der dritten Woche. Sie ist gekennzeichnet durch drei wichtige, gleichzeitig ablaufende Prozesse:
- Räumliche Musterbildung (kraniokaudale Körperachse)
- Entstehung der dreiblättrigen Keimscheibe
- Bildung der Urkeimzellen
Bereits am 9. Tag liegt am späteren kranialen Pol der Keimscheibe eine streifenförmige Verdichtung im Hypoblasten vor (vorderer Randbogen, Protochordalplatte). Somit lässt sich der kraniale vom kaudalen Pol unterschieden.
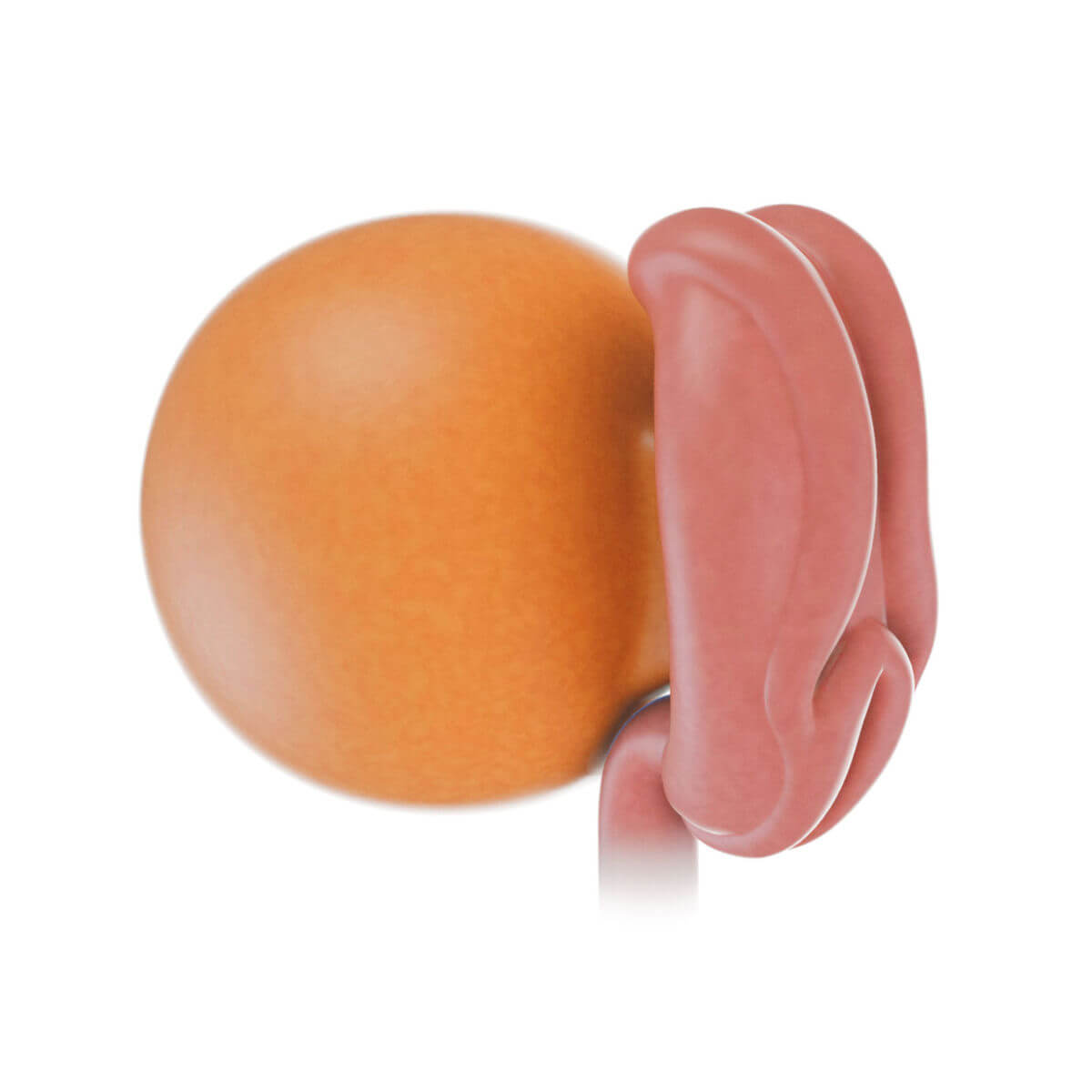
Gegenüber dem vorderen Randbogen entsteht um den 14. Entwicklungstag am späteren kaudalen Pol im Epiblast eine Zellverdichtung, der Primitivstreifen. Er verlängert sich nach kranial bis zur Mitte der Keimscheibe und bildet dort eine knotenförmige Verdichtung, den Primitivknoten. Im Primitivstreifen senkt sich dorsal die Primitivrinne ein. Lateral und kranial liegende Epiblastzellen wandern auf diese Rinne zu, verlassen den Zellverband nach ventral (Ingression) und wandeln sich in einen unpolarisierten Zelltyp um (epithelial-mesenchymale Transition). Somit entsteht zwischen Epiblast und Hypoblast eine neue Zelllage, das Mesoderm (primäres Mesenchym, Mesoblast). Diese Zellen gewinnen am Rand der Keimscheibe Anschluss an das extraembryonale Mesoderm.
Die meisten Zellen des Primitivknotens wandern nach kranial und bilden median einen flachen Zellstrang, der sich in die Ebene der Hypoblastzellen schiebt und diese nach lateral auseinander drängt. Sie verdrängen den Hypoblasten immer weiter nach kranial, lateral und später auch nach kaudal (ventral unter dem Primitivstreifen entlang) und werden so zum innersten Keimblatt, dem Endoderm (Entoderm, Entoblast).
Andere Zellen des Primitivknotens verbleiben median als Chordaplatte (Chordafortsatz). Auch hier entsteht ventral eine Rinne und die aufgeworfenen Ränder verschmelzen zu einem Rohr (Chorda dorsalis, Notochord). Die lateral der Chorda liegenden Endodermzellen wandern ventral vor die Chorda und bilden somit auch median eine durchgehende Endodermschicht. Des Weiteren wandern einige Zellen aus dem Primitivknoten zwischen Hypoblast und Epiblast nach kranial und bilden dort das prächordale Mesoderm. Später wird diese Zellplatte als Prächordalplatte in das Endoderm aufgenommen. Sie ist beteiligt an der Auskleidung der Rachenhöhle und an der Bildung von Mesenchym und Muskulatur des Kopfes. Weitere Zellen des Primitivknotens haben Anteil an der Bildung der Neuralplatte und des paraxialen Mesoderms.
Die in der dorsalen Schicht zurückbleibenden Epiblastzellen werden durch Wachstumsfaktoren aus dem Trophoblast, Mesoderm und Chorda zum äußeren Keimblatt, dem Ektoderm.
Kranial der Prächordalplatte bleibt ein kleiner runder Bereich frei von Mesoderm. Dort liegen Endoderm und Ektoderm direkt aufeinander und bilden die Rachenmembran (Bucco-, Oropharyngealmembran). Später entsteht auch kaudal vom Primitivstreifen eine ähnliche, mesodermfreie Stelle, die Kloakenmembran.
Im kaudalen Bereich des Primitivstreifens entstehen Urkeimzellen (primordiale Keimzellen/Geschlechtszellen) vor allem unter dem Einfluss von BMP4 des Trophoblasten. Die Urkeimzellen sind nun die einzigen, die zu adulten Gameten werden können. Sie werden als Teil der Keimbahn den somatischen Zellen gegenübergestellt. Diese zellen verlassen zusammen mit Mesodermzellen die Keimscheibe nach kaudal zum Haftstiel und wandern in die Dottersackwand und Allantois. Da später der proximale Teil des Dottersacks die Darmanlage bildet, werden die Urkeimzellen in das Epithel des Hinterdarms verlegt. Von dort aus besiedeln sie die Gonadenanlagen.
Embryonalphase
Ab der 4. Woche beginnt die Embryogenese im engeren Sinn, bei der es zur Ausbildung der einzelnen Organsysteme und der Körperformen kommt.
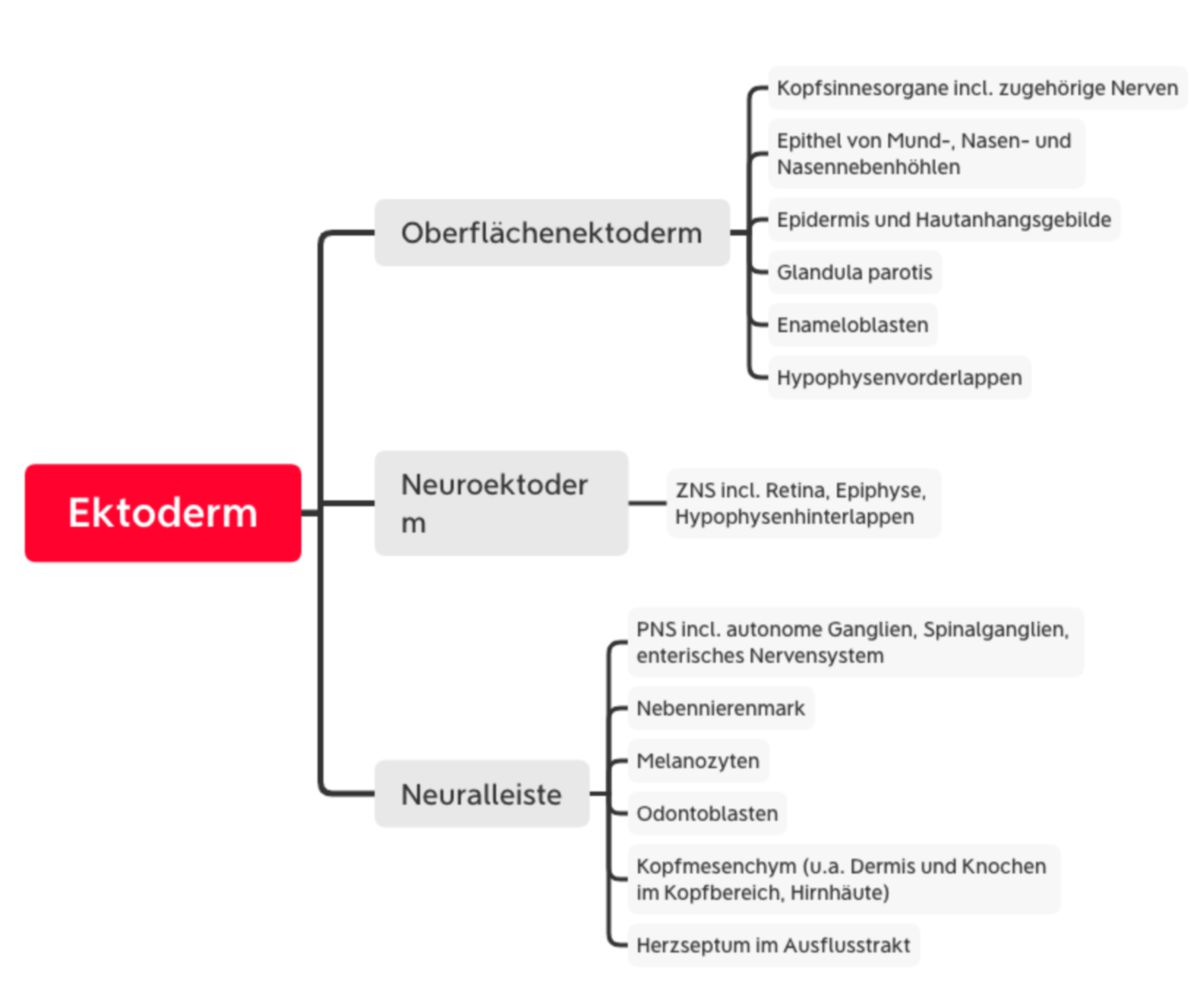
Ektoderm
Schon bei der Entstehung des Ektoderms gliedert es sich in zwei Abschnitte: die zentral und kranial gelegene Neuralplatte (Neuroektoderm) und das nach außen anschließende Oberflächenektoderm (epidermales Ektoderm).
Im kranialen Bereich des Oberflächenektoderms entstehen umschriebene Epithelverdickungen (Plakoden), die sich später an der Bildung der Kopfsinnesorgane und entsprechenden Nerven beteiligen (Riech-, Ohr-, Linsen-, Trigeminusplakode). Aus dem restlichen Oberflächenektoderm entsteht die Epidermis mit Hautanhangsgebilden (Haare, Nägel, Talgdrüsen, Schweißdrüsen, Milchdrüsen) sowie das Epithel von Mund-, Nasen- und Nasennebenhöhlen. Außerdem geht aus dem Oberflächenektoderm die Glandula parotis, Enameloblasten und der Hypophysenvorderlappen hervor.
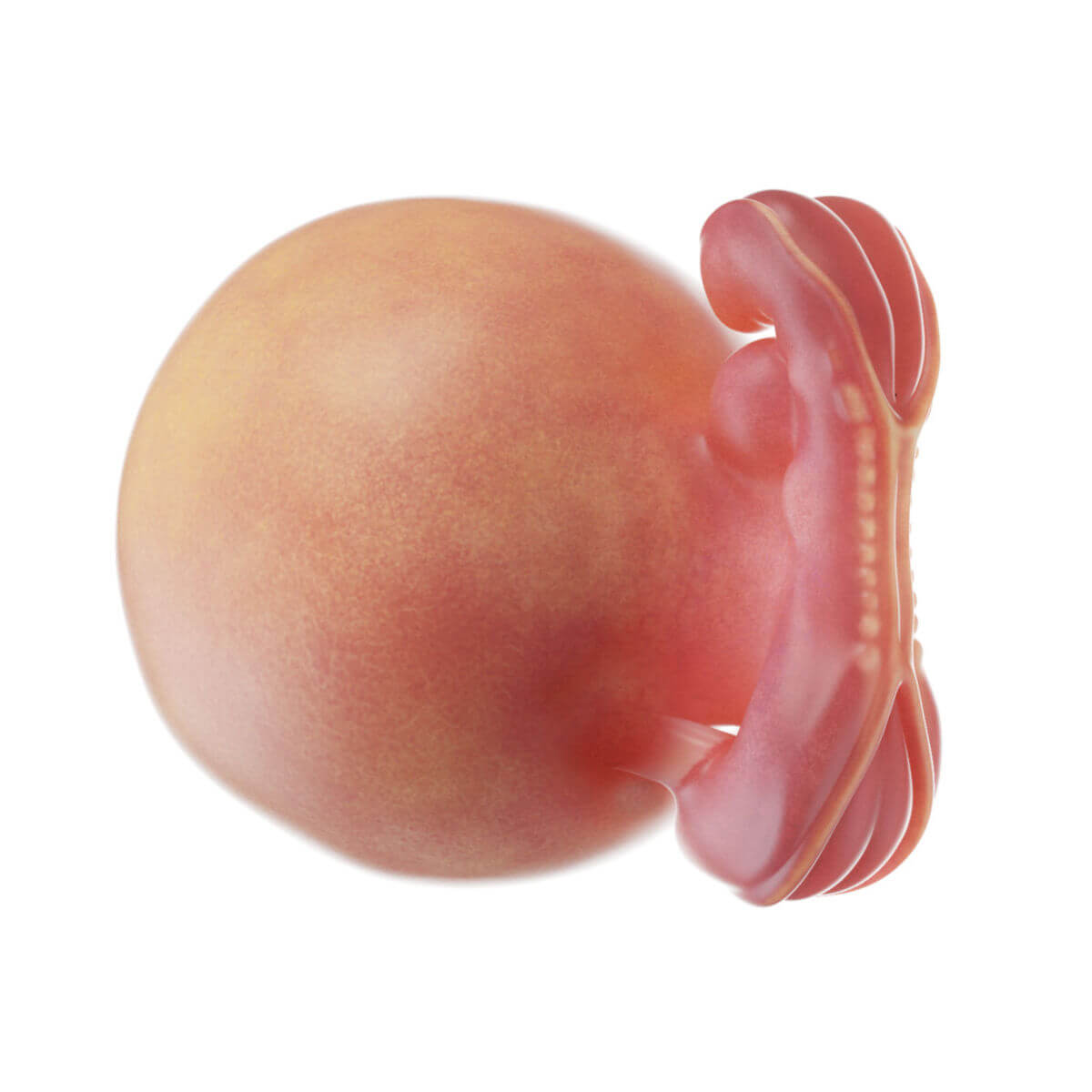
Die Neuralplatte wird durch die Chordaplatte bzw. Chorda dorsalis induziert. Diese sezerniert unter anderem Chordin und Noggin, die BMP4 binden. BMP4 induziert normalerweise die Bildung von Oberflächenektoderm. Die Neuralplatte verlängert sich weiter nach kaudal und vertieft sich am 18. Tag in der Mittellinie zur Neuralrinne. Gegen Ende der 4. Woche verschmelzen sich die seitlichen Wülste zum Neuralrohr (Neurulation). Im vorderen Abschnitt verbleibt der Neuroporus cranialis, der am 24. Tag, und kaudal der Neuroporus caudalis, der am 26. Tag schließt. Aus dem Neuralrohr entwickelt sich das zentrale Nervensystem inklusive Retina, Epiphyse und Hypophysenhinterlappen.
Nach der Neurulation wird das Neuralrohr vom Oberflächenektoderm überdeckt. Einzelne Ektodermzellen wandern jedoch aus und bilden an der dorsalen Seite des Neuralrohrs einen unpaaren Strang (Rumpfneuralleiste). Diese Zellen wandern nach lateral und bilden paarige Anlagen. Im kranialen Bereich liegt direkt eine paarig angelegte Kopfneuralleiste vor. Diese Zellen werden zu Neuronen und Gliazellen des peripheren Nervensystems inklusive der autonomen Ganglien, der Spinalganglien und des enterisches Nervensystems. Außerdem entstehen aus ihnen Nebennierenmark, Melanozyten, Herzseptum im Ausflusstrakt und das Kopfmesenchym (Hirnhäute, Dermis und Knochen im Kopfbereich, Odontoblasten). Für die weitere Entwicklung des Neuroepithels ist neben der Chorda auch die Bodenplatte entscheidend. Sie entsteht aus dem Primitivknoten.
Des Weiteren entsteht die kaudale Anlage des ZNS aus dem Rest des Primitivstreifens, der sich kaudal an das Neuralrohr anschließt. Nachdem sich der Neuroporus kaudalis verschlossen hat, proliferieren die Zellen des kaudalen Primitivstreifens zur Rumpfschwanzknospe. Diese wölbt sich nach dorsal und kaudal in die Amnionhöhle vor. Hier entwickeln sich alle 3 Keimblätter gleichzeitig (sekundäre Neurulation/Gastrulation): Zentral entsteht das Endoderm des Schwanzdarmes, dorsal davon erst das solide Neuralrohr, dazwischen die Chorda dorsalis des Steißes und seitlich das Mesoderm mit bis zu 20 Somiten. Anschließend kommt es zur Kanalisierung zum Neuralrohr und zur Auswanderung von Neuralleistenzellen.
Störungen der Bildung des Neuralrohrs führen zur Anenzephalie (Fehlen der Gehirnanlage), Mikrozephalie (Verminderung) oder Spina bifida.
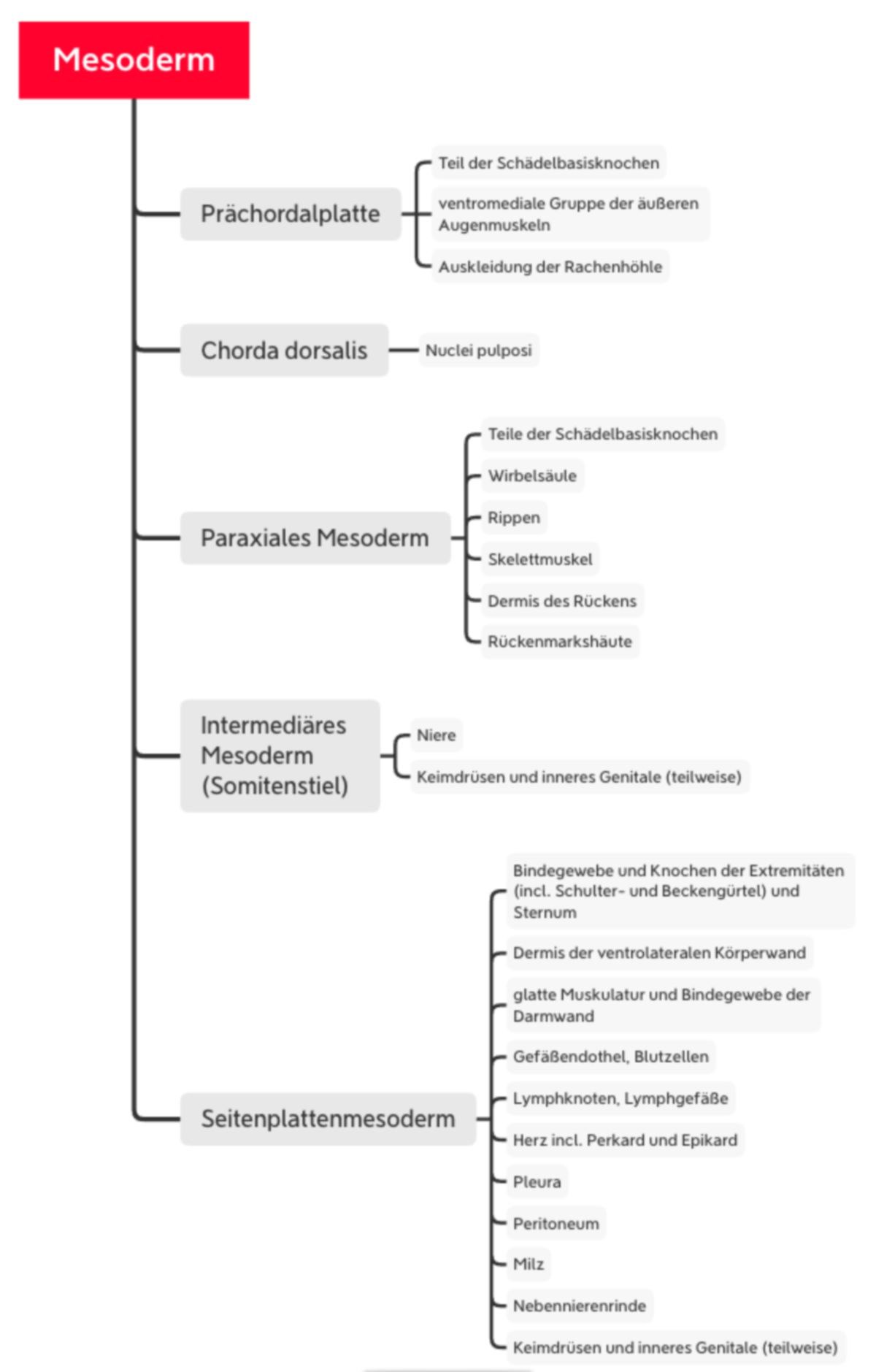
Mesoderm
Unter Beteiligung des Signalmoleküls Sonic hedgehog aus der Chorda verdichtet sich das Mesoderm beidseits strangförmig zum paraxialen Mesoderm. Nach lateral folgen das intermediäre Mesoderm und das Seitenplattenmesoderm. Die unterschiedlichen Abschnitte stammen auch von verschiedenen Zellen des Primitivstreifens; von kaudal nach kranial:
- extraembryonales Mesoderm
- Seitenplattenmesoderm
- intermediäres Mesoderm
- laterale Hälfte des paraxialen Mesoderms
Die mediale Hälfte der Somiten entsteht aus Zellen des Primitivknotens.
Prächordales Mesoderm
Wie bereits erwähnt, entstehen aus der Prächordalplatte ein Teil der Schädelbasisknochen sowie die ventromediale Gruppe der äußeren Augenmuskeln. Weiterhin ist sie beteiligt an der Auskleidung der Rachenhöhle.
Chorda dorsalis
Die Chorda dorsalis hat überwiegend regulatorische Funktionen durch Synthese und Sekretion von Wachstumsfaktoren. Aus ihr entstehen die Nuclei pulposi der Bandscheiben.
Seitenplattenmesoderm
Innerhalb des Seitenplattenmesoderms entsteht ein Spalt, der die Anlage des intraembryonalen Zöloms (Leibeshöhle) bildet. Durch den Spalt wird das Mesoderm in zwei epithelartig angeordnete Blätter trennt: Somatopleura (Ektoderm anliegend) und Splanchnopleura (Endoderm anliegend). Kaudal trennen sich die Blätter vollständig voneinander, sodass eine direkte Verbindung zwischen Zölom und Chorionhöhle entsteht. Kranial bleibt eine Verbindung bestehen (Septum transversum). Aus der medialen Splanchnopleura entstehen glatte Muskulatur und Bindegewebe der Darmwand. In der lateralen Splanchnopleura entstehen Blutinseln. Aus den äußeren Zellen der Blutinseln entsteht eine Endothelschicht, die inneren Zellen werden zu Blutzellen (Vaskulogenese). Durch Zusammenschluss benachbarter Blutinseln entstehen die ersten blutgefüllten Gefäße des Embryos (z.B. paarige Aortenanlage). Ganz lateral in der Splanchnopleura besteht eine Verbindung mit dem extraembryonalen Mesoderm auf dem Dottersack. Die ersten Blutgefäße können deshalb durch Bildung von neuen Gefäßästen (Angiogenese) Anschluss an Blutgefäße des Dottersacks gewinnen, die ungefähr zeitgleich entstehen. Später entstehen auch im extraembryonalen Mesoderm von Allantois, Haftstiel und Chorion Blutgefäße. Aus der Somatopleura entstehen die nichtmuskulären Bestandteile der ventrolateralen Körperwand.
Die Zellen von Splanchno- und Somatopleura, die an die Leibeshöhle angrenzen, bleiben epithelähnlich und bilden später das Mesothel der serösen Häute von Bauch-, Brusthöhle und des Herzbeutels. Die parietale seröse Haut aus der Somatopleura bedeckt die Wände der Körperhöhlen, die viszerale seröse Haut der Splanchnopleura die Oberfläche vieler Organe. Erst durch die kraniokaudale Krümmung und laterale Abfaltung des Embryos wird die Leibeshöhle verschlossen (siehe unten).
Kranial (vor der Neuralplatte) bildet sich in der Splanchnopleura parallel zum Septum transversum ein schmaler Streifen von Blutinseln (kardiogene Platte). Die Inseln verbinden sich zum endothelialen Endokardschlauch des Herzens. Anliegende epitheliale Zellen der Splanchnopleura werden zum Myokard und deren Serosabedeckung (Epikard), die dorsal anliegende Somatopleura wird zum Herzbeutel (Perikard). Die Bildung des Herzschlauchs wird durch das Endoderm über FGF2 in der 3. Entwicklungswoche induziert. Später bekommt der Schlauch Anschluss an intra- und extraembryonale Gefäße und gegen Ende der 3. Woche beginnen erste rhythmische Kontraktionen.
Paraxiales Mesoderm
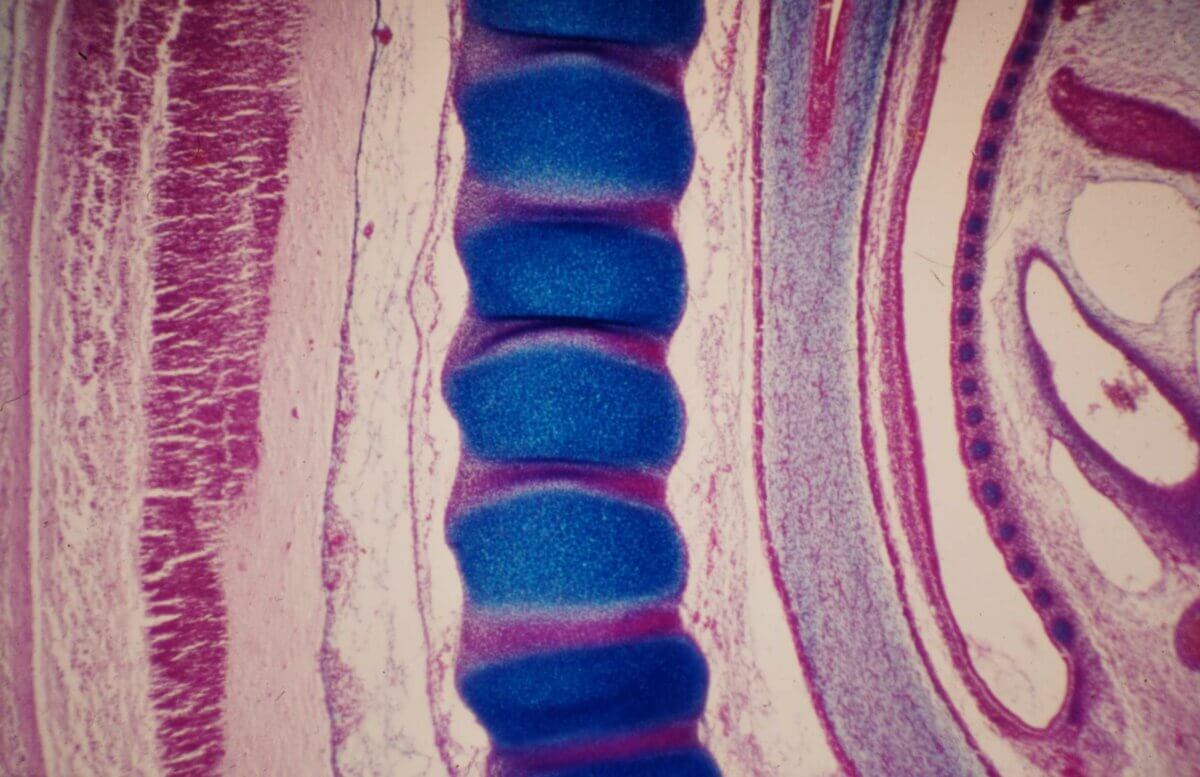
Ab Ende der 3. Woche wird das strangförmige paraxiale Mesoderm in eine Kette von perlenförmiger Somiten umgeformt. Damit beginnt die metamere Gliederung des Körpers. Diese Segmentierung zeigt sich später im Aufbau der Wirbelsäule in Wirbel und Rückenmarkssegmente. Das paraxiale Mesoderm wird dabei zu Epithelblasen mit zentralem Hohlraum umgewandelt (mesenchymal-epitheliale Transformation) und außen von einer Basalmembran bedeckt. Die Bildung der Somiten beginnt kranial des Primitivknotens auf beiden Seiten der Chorda ungefähr am 20. Entwicklungstag und setzt sich dann nach kaudal fort. Sie haben engen Kontakt mit Neuralplatte bzw. Neuralrohr (medial), Oberflächenektoderm (dorsal), intermediärem Mesoderm (lateral) und Endoderm/Splanchnopleura/Aortenanlage (ventral).
Das Neuroepithel und die Chorda induzieren über Sonic hedgehog, das Oberflächenektoderm über ein Signalmolekül der Wnt-Klasse und BMP4 eine Gliederung der Somitenblase in ein ventromediales und dorsolaterales Segment. Das ventromediale Segment bildet die Transkriptionsfaktoren Pax-1 und -9, wird mesenchymal (Sklerotomzellen), wandert nach medial auf die Chorda zu, sodass sich die gegenüberliegenden Sklerotomzellen treffen. So entstehen segmentweise mesenchymale Kerne für die Wirbel. Der dorsolaterale Teil bleibt epithelial, exprimiert Pax-3 und -7 und liefert nach ventromedial und ventrolateral die Vorläuferzellen von Skelettmuskelzellen (Myotom, myogene Zellen) und nach außen die Vorläuferzellen der Dermis (= Dermatomyotom). Die Identität der Somiten entlang der kraniokaudalen Achse wird durch Hox-Gene festgelegt.
Intermediäres Mesoderm
In dem auch Somitenstiel genannten intermediären Mesoderm bilden sich segmental angeordnete Epithelien (Nephrotome) und ein longitudinaler epithelialer Zellstrang, der später kanalisiert (Urnierengang). Außerdem wird aus dem intermediären Mesoderm und dem anliegenden Zölomepithel des Seitenplattenmesoderms der größte Teil des Urogenitalsystems (Niere, Keimdrüsen, inneres Genital)
Allantois
Im frühen Somitenstadium stülpt sich kaudal eine blind endende Aussackung des Hypoblasts als Allantoisdivertikel in das extraembryonale Mesoderm des Haftstiels vor. Zunächst steht es in offener Verbindung mit der Harnblase. Später obliteriert es zum Urachus. Die mesodermale Bedeckung im Haftstiel nimmt an Umfang zu und bildet die strukturelle Grundlage der Nabelschnur.
Endoderm
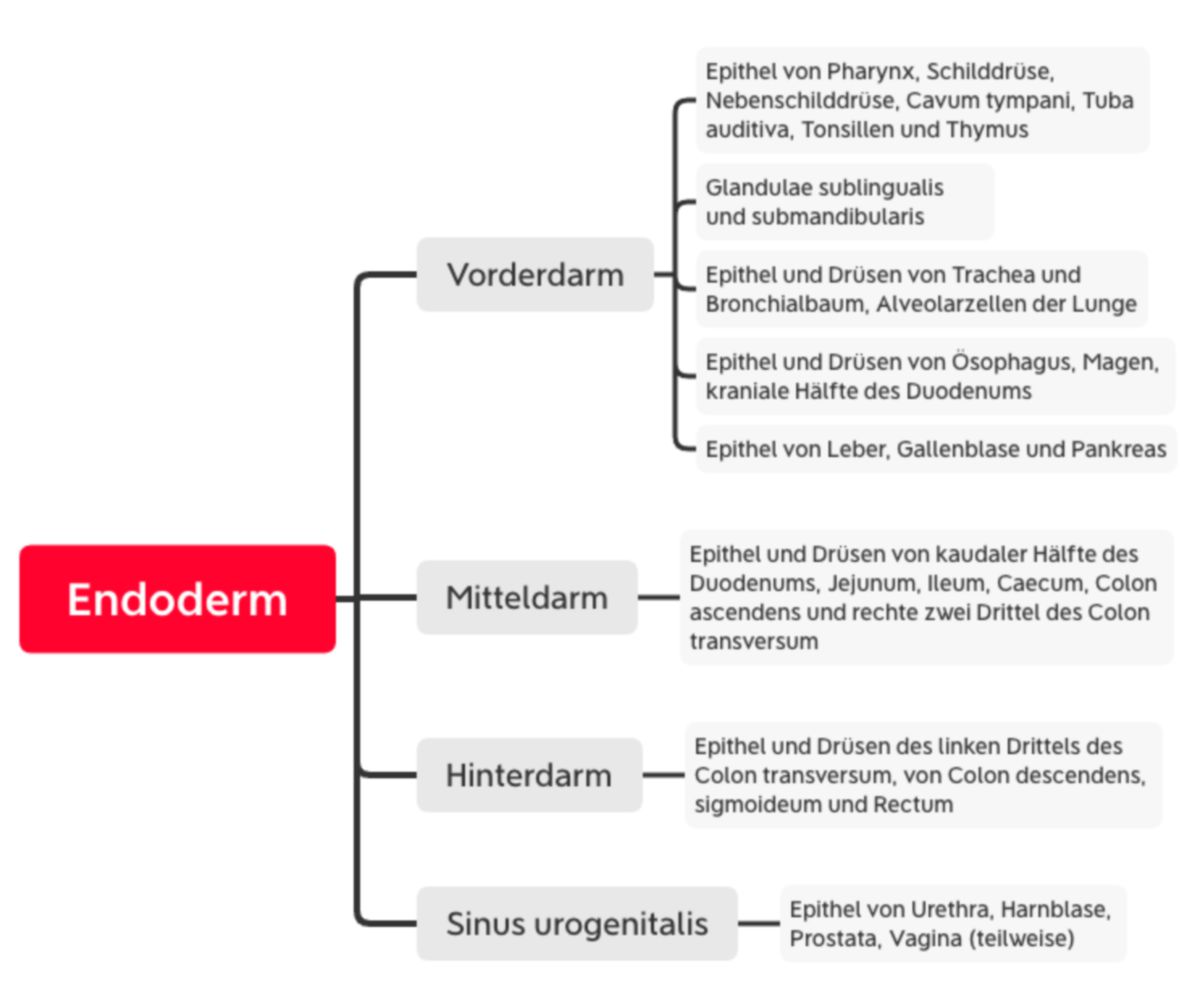
Noch während der Hypoblast durch das Endoderm ersetzt wird, kommt es durch starkes Wachstum der Neuralplatte zu einer kraniokaudalen Krümmung des Embryos (Konvexität nach dorsal). Somit verlagert sich die Position des Septum transversum (kranialer Pol) und Haftsteils (kaudaler Pol) nach ventral. Das Septum wird auf die Höhe zwischen Perikardhöhle und Bauchhöhle verlagert und bildet das Zwerchfell. Insgesamt krümmt sich der Embryo über dem Haftstiel zusammen, der die ersten Nabelschnurgefäße führt. Wenig später im Stadium der Somitenbildung beginnt die laterale Abfaltung durch Vorwachsen der Somatopleura nach ventral zur Ausbildung der Leibeswand. Insgesamt wird der Dottersack teilweise in die Leibeshöhle aufgenommen und der Nabel beginnt sich zu bilden. Zwischen dem restlichen Dottersack und dem sich entwickelnden Darm verbleibt der Ductus omphaloentericus (Ductus vitellinus, Dottergang). Der kraniale Abschnitt wird als Vorderdarm, der kaudale als Hinterdarm bezeichnet. Der mittlere Abschnitt formt den Mitteldarm, der sich rasch verlängert und viele Darmschlingen bildet. Dadurch kommen große Teile des Mitteldarms zunächst extraembryonal in der Chorionhöhle zu liegen und der Nabel behält bis zum Ende der siebten Entwicklungswoche eine weitere Öffnung (physiologischer Nabelbruch). Der Vorderdarm ist gegenüber der Amnionhöhle durch die Rachenmembran verschlossen, der Hinterdarm durch die Kloakenmembran.
Aus dem Endoderm entwickeln sich die gesamten Epithelien des Darmrohrs inklusive Leber, Pankreas sowie Epithelien der unteren Atemwege und Lunge
Der Sinus urogenitalis entwickelt sich ebenfalls aus dem Endoderm und differenziert sich teilweise zum Epithel der Urethra, Harnblase, Prostata und Vagina.
Rechts-Links-Differenzierung
Früh entsteht auf molekularer Ebene eine asymmetrische Differenzierung in Rechts und Links, die sich später z.B. in der morphologischen Differenzierung der Organe und Körperhöhlen zeigt. Beteiligte Wachstumsfaktoren sind Nodal, Pitx-2, Lefty-1, -2, eHAND, dHAND. Defekte im Dynein-Molekül mit immotilen Kinozilien führen zum Kartagener-Syndrom mit Situs inversus.
Klinik
Während der Embryogenese ist das Risiko für Missbildungen am größten. Sie können durch Infektionskrankheiten, Toxine, Arzneistoffe, ionisierende Strahlung oder andere Faktoren ausgelöst werden und führen in der Regel zu Spontanaborten.
Bildquelle
- Blastogenese: pictures by www.sciepro.com; CC BY-ND 4.0 DE
- Embryogenese: pictures by www.sciepro.com; CC BY-ND 4.0 DE