Gap Junction
Synonyme: Nexus, elektrische Synapse, Macula communicans
Definition
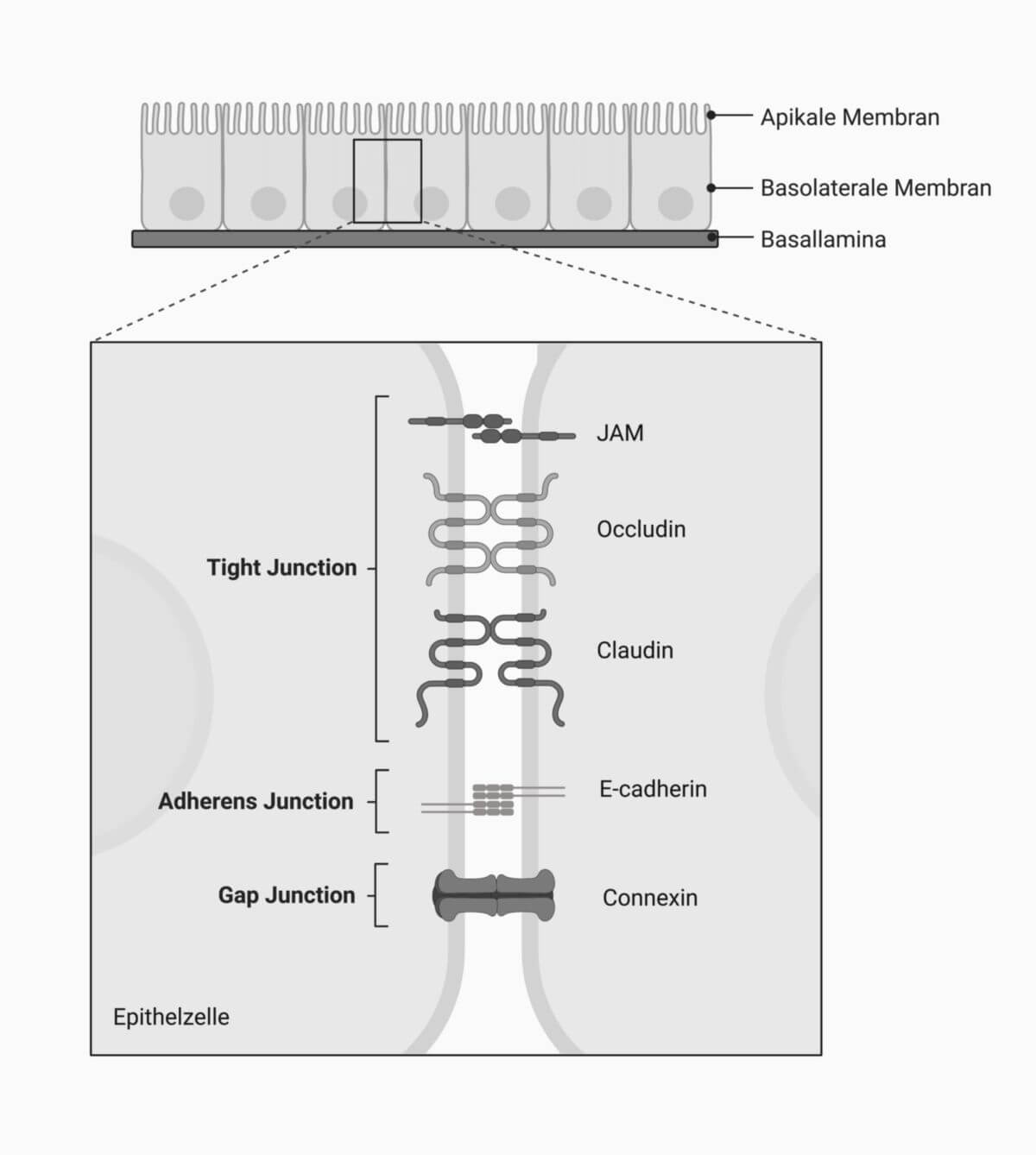
Gap Junctions sind porenbildende Proteinkomplexe, welche die Plasmamembran zweier Zellen eng miteinander verbinden – es besteht ein Spalt von nur 2-3,5 nm Breite. Sie gehören zu den Zellkontakten und stehen im Dienste der Zelladhäsion und Zellkommunikation, da sie das Zytoplasma zweier Zellen direkt miteinander verbinden.
Aufbau
Eine Gap Junction ist ein Cluster bzw. ein Plaque aus vielen Gap-Junction-Kanälen. Sie bestehen jeweils aus zwei Connexonen (Hemikanälen), die wiederum aus sechs Connexinen aufgebaut sind. Bei den Connexinen handelt es sich um Transmembranproteine mit jeweils 4 Transmembrandomänen. Wenn sie aus einheitlichen Connexinen aufgebaut sind, bezeichnet man die Hemikanäle als homomer, andernfalls als heteromer.
Ein Connexon ist etwa 7,5 nm lang und hat einen Durchmesser von 2,5 nm. Es ragt dabei ungefähr 0,7 nm in das Zytoplasma und 1,7 nm in den Extrazellulärraum. Connexone können in manchen Zellen auch ungepaart auftreten und bilden dann einen Kanal zwischen dem Zytoplasma der Zelle und dem Extrazellulärraum. Die Connexone sind in einem nahezu regelmäßigen hexagonalen Muster in der Zellmembran angeordnet. Ihre Anzahl und Verteilung ist abhängig vom Zelltyp von kann von einigen wenigen bis zu mehreren Tausend Kanälen pro µm2 reichen.
Bei den Gap Junctions liegen sich die Connexone so gegenüber, dass ein vollständiger Kanal entsteht, der beide Zellen miteinander verbindet und den schnellen Austausch von Ionen und kleinen Molekülen ermöglicht. Die spezifischen Eigenschaften von Gap Junctions bzw. Connexonen richten sich nach der Art der verbauten Connexine.
3D-Modell: Gap Junction
Vorkommen
Gap Junctions kommen beim Menschen in fast allen Körpergeweben vor, in denen Zellen miteinander in Kontakt treten. Vor allem im Embryonalstadium haben sie eine wichtige Bedeutung, da sie für die normale Gewebeentwicklung und die Ausbildung der Zellpolarität notwendig sind.
Beim Erwachsenen spielen sie aus funktioneller Sicht im Herzmuskelgewebe, im Epithelgewebe sowie im Nervengewebe und in der Retina eine bedeutsame Rolle.
Funktion
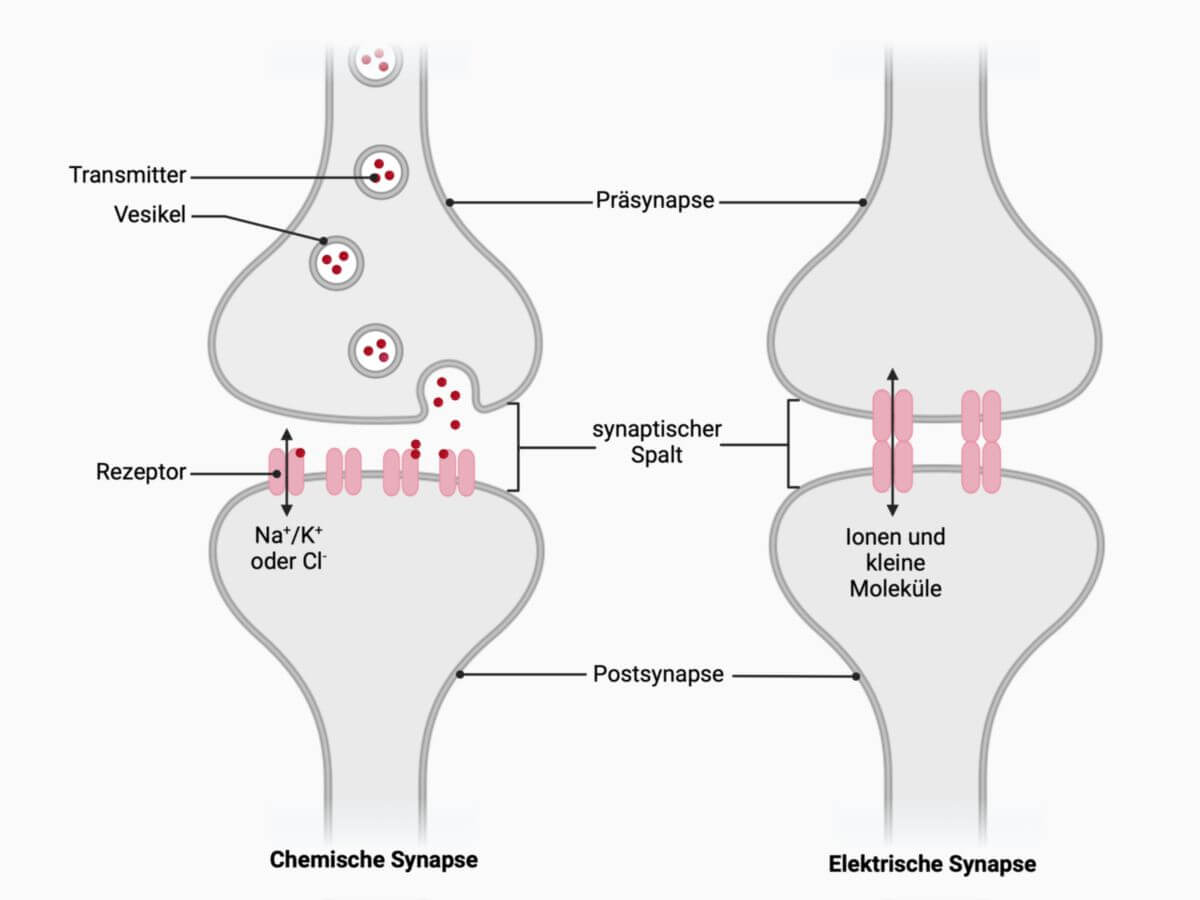
Gap Junctions dienen dem Signal- und Stoffausstausch zwischen benachbarten Zellen. Dabei werden Ionen (Ca2+, K+) oder kleine Moleküle (z.B. Glucose, cAMP oder cGMP) durch Diffusion direkt von Zelle zu Zelle bewegt. Einige Formen von Gap Junctions haben eine selektive Durchlässigkeit für bestimmte Stoffe.
In Neuronen, Herzmuskelzellen und Retinazellen fungieren Gap Junctions als elektrische Synapsen. Die Depolarisation der präsynaptischen Zelle führt zu einem Potentialgefälle zwischen den beiden, durch Gap Junctions verbundenen Zellen. Dadurch fließen Kationen von der präsynaptischen zur postsynaptischen Zelle und umgekehrt Anionen von der post- zur präsynaptischen Zelle. Wird der Schwellenwert an der postsynaptischen Membran überschritten, folgt hier ein Aktionspotential, und das Signal kann praktisch ohne Zeitverzögerung (10-5 s) weitergeleitet werden. Dies erlaubt aufgrund der geringen Zeitverzögerung eine schnelle Synchronisation des Zellverbandes (z.B. des Myokards).
Neben der viel geringeren Zeitverzögerung unterscheiden sich Gap Junctions von chemischen Synapsen auch darin, dass bei diesen die Erregungsübertragung i.d.R. in beide Richtungen erfolgen kann. Allerdings können auch Gap Junctions einiger Zellen in ihrer Stromrichtung reguliert werden, entweder von Ca2+-abhängig oder Membranpotential-abhängig. Die Rolle von Gap Junctions im Körper ist jedoch funktionell begrenzt: Eine direkte Erregungsübertragung auf weit entfernte Zellen oder eine hemmende Erregungsübertragung ist nicht möglich.
Neben der elektrischen Kopplung dienen Gap Junctions der metabolischen Koordinierung, z.B. von Osteozyten des Knochens oder von embryonalen Gewebeverbänden.
Shut-Off
Bei einer Schädigung bzw. Apoptose der Nachbarzelle werden die Gap Junctions in der Regel schnell geschlossen. Triggerfaktoren sind u.a. ein Anstieg der Ca2+-Konzentration im Zytoplasma oder ein Abfall des pH-Werts. Dadurch wird die gesunde Zelle metabolisch von ihrem Nachbarn abgekoppelt und geschützt.
Klinik
Mutationen des Connexin 32 führen zu Degeneration peripherer Nerven (X-chromosomal vererbte Formen der hereditären motorisch-sensiblen Neuropathie). Mutationen von Connexin 43 sind eine Ursache von schweren angeborenen Herzfehlern.
siehe Hauptartikel: Connexin