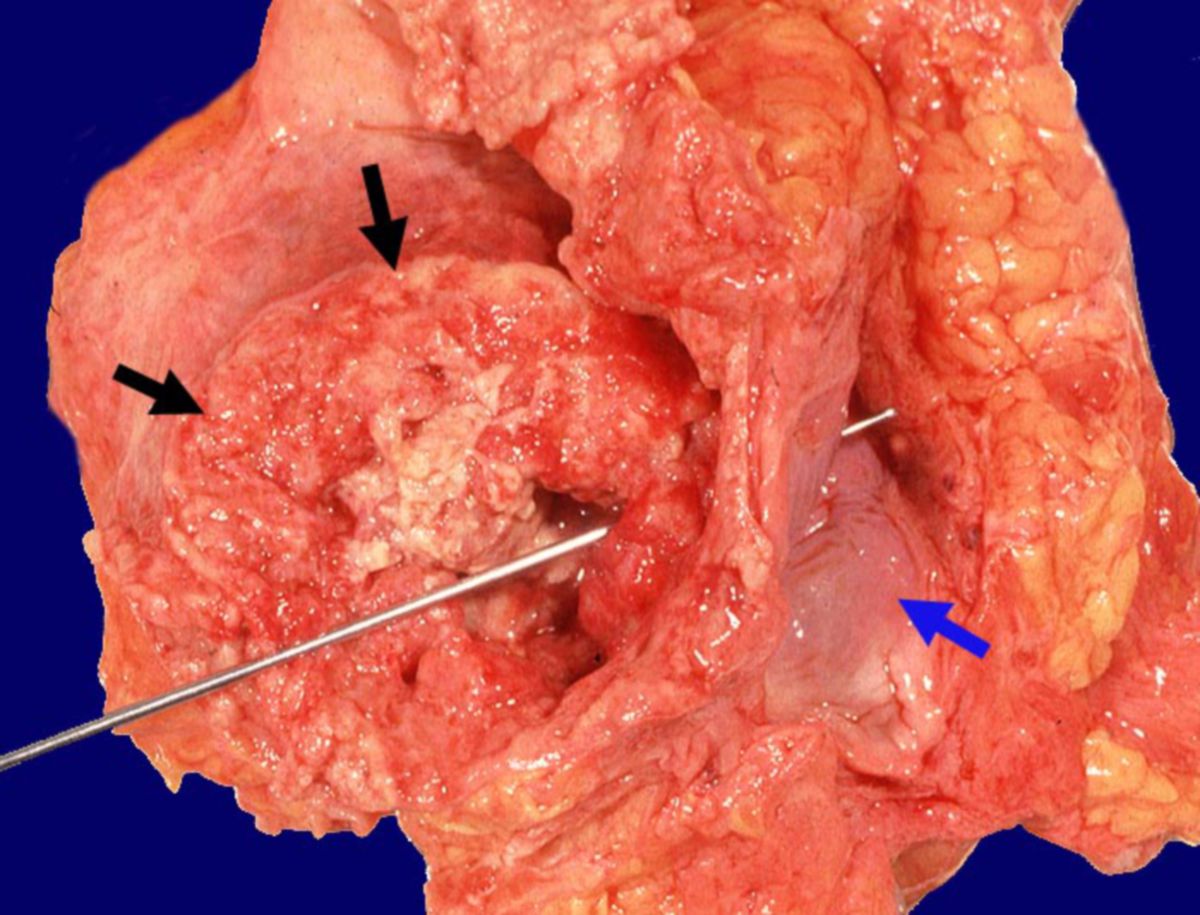
Harnblasenkarzinom
Synonym: Blasenkrebs, Harnblasenkrebs, Blasentumor
Englisch: carcinoma of the bladder
Definition
Harnblasenkarzinome sind maligne, epitheliale Tumoren (Karzinome), welche die Wand der Harnblase befallen.
- ICD-10-Code: C.67.- Bösartige Neubildung der Harnblase
Epidemiologie
Das Harnblasenkarzinom macht etwa 3 bis 4 % aller Krebserkrankungen aus. In Deutschland finden sich durchschnittlich fast 12.000 jährliche Neuerkrankungen bei Männern und 4.500 bei Frauen. Somit ist das Harnblasenkarzinom in Deutschland der 4. häufigste Tumor bei Männern und der 14. häufigste bei Frauen.
Das mediane Erkrankungsalter beträgt ungefähr 75 Jahre. Urothelkarzinome der Harnblase vor dem 20. Lebensjahr sind extrem selten, dabei handelt es sich in der Regel um Rhabdomyosarkome.
Klassifikation
In 95 % der Fälle liegt ein Urothelkarzinom vor. Selten finden sich andere Tumorentitäten:Plattenepithelkarzinome (2 %), Adenokarzinome (1 %), sehr selten Urachuskarzinome, kleinzellige Karzinome oder neuroendokrine Karzinoide.
Die aktuelle (2026) WHO-Klassifikation aus dem Jahr 2016 unterscheidet zwischen invasiven Urothelkarzinomen (z.B. nested, mikropapillär, riesenzellig) und nicht-invasiven urothelialen Läsionen (z.B. urotheliales Carcinoma in situ, urotheliales Papillom).
Ätiologie
Die genauen molekularbiologischen Mechanismen, die zur Entstehung eines Harnblasenkarzinoms führen, sind aktuell (2026) noch weitgehend unbekannt. Allerdings existieren gesicherte Risikofaktoren.
Medikamente und Chemikalien
- Nitrosamine
- Aromatische Amine (z.B. 2-Naphthylamin, 4-Aminodiphenyl, o-Toluidin)
- Arsen
- Cyclophosphamid
- Pioglitazon (umstritten)
- SGLT2-Inhibitoren (umstritten)
- Chlornaphazin (außer Handel)
- Phenacetin (außer Handel)
- Aristolochiasäure (in Deutschland seit 1987 verboten)
In diesem Zusammenhang ist eine berufsbedingte Exposition zu berücksichtigen. Harnblasenkarzinome finden sich als anerkannte Berufskrankheit (BK-Nr. 1301) v.a. bei:
- Maler und Lackierer
- Beschäftigte in der Gummiindustrie
- Arbeiter im Steinkohlenbergbau
- Busfahrer bzw. LKW-Fahrer
- Hochofenarbeiter und Schmelzer z.B. in der Aluminiumindustrie
Nikotinabusus
Weiterhin stellt der Nikotinabusus einen wichtigen unabhängigen Risikofaktor dar. Sowohl die Dauer als auch die Menge erhöhen das relative Risiko. Beispielsweise führt der Konsum von 10 Zigaretten pro Tag über 10 Jahre zu einem relativen Risiko von 2,1 (Männer) bzw. 1,2 (Frauen).
Chronische Entzündungen
Chronische Entzündungen der Harnblase und Blasensteine (nicht jedoch Nierensteine) können die Karzinomentstehung begünstigen. Dabei ist insbesondere das Risiko für Plattenepithelkarzinome erhöht. Auch eine mehrjährige Harnableitung mittels Dauerkatheter (z.B. bei Querschnittslähmung) erhöht vermutlich das Karzinomrisiko.
Patienten mit Bilharziose und Befall der Harnblase besitzen ein besonders hohes Risiko, insbesondere für Plattenepithelkarzinome.
Strahlentherapie
Eine Strahlentherapie im kleinen Becken (z.B. im Rahmen der Therapie von Gebärmuttertumoren) kann mit einer mehrjährigen Latenzzeit zur Entwicklung eines Harnblasenkarzinoms führen.
Genetische Prädisposition
In genomweiten Assoziationsstudien erwiesen sich bislang (2026) 14 Einzelnukleotid-Polymorphismen und eine Gendeletion als signifikant bzgl. der Auslösung eines Harnblasenkarzinoms. Darunter befindet sich z.B. das Gen FGFR3, das für den Fibroblasten-Wachstumsfaktor-Rezeptor 3 codiert. Diese Rezeptor-Tyrosinkinase reguliert die Proliferation und Differenzierung von Zellen; Mutationen führen zu einer überaktiven Form des Proteins.[1] Die bisherige Datenlage lässt jedoch keine Aussagen zur genetischen Prädisposition zu.
Eine Ausnahme stellen spezielle genetische Syndrome dar. So ist z.B. das Lynch-Syndrom mit einem erhöhten Karzinomrisiko im oberen Harntrakt assoziiert.
Ernährung
Es existieren Hinweise für eine Zusammenhang von fettreicher, obstarmer Ernährung und Harnblasenkarzinome. Kaffeekonsum und Trinkmenge werden derzeit (2026) nicht als Risikofaktoren eingestuft.
Klinisches Bild
Leitsymptom des Harnblasenkarzinoms ist eine Makro- bzw. Mikrohämaturie, die meist schmerzlos ist.
Bei ungefähr 11 bis 22 % der Patienten mit einer Makrohämaturie und 10 bis 15 % mit asymptomatischer Mikrohämaturie liegt ein Malignom der Harnwege vor. 68 bis 98 % der Patienten mit Harnblasenkarzinom zeigen eine Makrohämaturie.
Weiterhin treten irritative Symptome (Harndrang, Pollakisurie, Dysurie) bei 20 bis 25 % der Patienten mit einem Harnblasenkarzinom auf. Dabei liegt in ungefähr 40 % der Fälle eine begleitende Harnwegsinfektion vor. Diese kann den Untersuchenden in falscher Sicherheit wiegen. Eine differenzierte Abklärung, insbesondere nach scheinbar rezidivierenden Harnwegsinfektionen ist daher unerlässlich.
In fortgeschrittenen Stadien sind zusätzlich B-Symptome (Gewichtsabnahme, Nachtschweiß, Fieber), eine Anämie oder ein Harnstau mit Flankenschmerzen möglich. Bei ossären Metastasen können Knochenschmerzen vorkommen.
Diagnostik
Bei Vorliegen der typischen klinischen Zeichen sollte eine weitergehende diagnostische Abklärung erfolgen. Diese setzt sich aus mehreren Komponenten zusammen, die ergänzend zueinander sind.
Urindiagnostik
Ein Urinteststreifen dient zur Erkennung einer Mikrohämaturie, zeigt jedoch falsch-positive Befunde bei Hämoglobin- und Myoglobinurie. Daher sollte bei der Abklärung einer Mikrohämaturie eine Mikroskopie des Urinsediments zur Beurteilung der Erythrozytenmorphologie durchgeführt werden.
Eine Urinzytologie aus frischem Urin oder Morgenurin dient dem Nachweis von abgeschilferten Tumorzellen. Eine negative Urinzytologie schließt ein high grade Urothelkarzinom mit hoher Sicherheit aus. Eine eindeutig positive Urinzytologie belegt das Vorliegen eines Urothelkarzinoms im Harntrakt mit hoher Wahrscheinlichkeit.
Sonographie
Bei klinischem Verdacht auf ein Harnblasenkarzinom sollte primär eine Sonographie erfolgen. Sie ermöglicht die Abklärung einer begleitenden Harnstauung als Zeichen eines lokal fortgeschrittenen Harnblasenkarzinoms sowie die Abgrenzung von anderen Ursachen einer Makrohämaturie (z.B. Urolithiasis). Weiterhin kann die Blasenwand beurteilt werden.
Zystoskopie
Als Standard in der Primärdiagnostik dient eine Weißlicht-Zystoskopie (WLC) am besten mit einem flexiblen Zystoskop. Die Sensitivität beträgt 62 bis 84 %, die Spezifität 43 bis 98 %. Eine Fluoreszenz-basierte Zystoskopie mit Einsatz von Hexaminolevulinat erhöht vermutlich die Detektionsrate.
Bei zystoskopischem Verdacht auf ein Harnblasenkarzinom soll eine Biopsie und histologische Sicherung erfolgen.
Immunhistochemie
Die Immunhistochemie eignet sich u.a. zum Nachweis einer urothelialen Differenzierung in unklaren Fällen sowie zur Abgrenzung reaktiver Läsionen von einem Carcinoma in situ (CIS):
- Urothelkarzinom: z.B. GATA3, Zytokeratin 7 (CK7), Zytokeratin 20 (CK20), S-100-Protein
- Plattenepithelkarzinom: z.B. P63
- neuroendokriner Tumor: z.B. Synaptophysin, Chromogranin A
- reaktive Läsion: z.B. CD44, CK20-negativ
Staging
Die Stadieneinteilung des Harnblasenkarzinoms erfolgt nach der TNM-Klassifikation der Harnblasenkarzinome bzw. der UICC-Klassifikation.
| Stadium | TNM | Beschreibung |
|---|---|---|
| Stadium 0a | Ta, N0, M0 | nicht-muskelinvasives papilläres Karzinom ohne regionale Lymphknotenmetastasen oder Fernmetastasen |
| Stadium 0is | Tis, N0, M0 | Carcinoma in situ |
| Stadium I | T1, N0, M0 | Infiltration der Submukosa |
| Stadium II | T2, N0, M0 | Infiltration der Tunica muscularis |
| Stadium III | T3 - T4a, N0, M0 | Infiltration des perivesikalen Gewebes (T3) bzw. Eindringen in Prostatastroma, Bläschendrüse, Uterus, Vagina (T4a) |
| Stadium IV | T4b, N0, M0 | Infiltration in Beckenwand oder Bauchwand |
| jedes T, N1 bis N3, M0 | Metastasen in regionären Lymphknoten | |
| jedes T, jedes N, M1 | Fernmetastasen (insb. Knochen, Leber, Lunge, Peritoneum, Gehirn) |
Die T-Stadien bis T1 werden als nicht-muskelinvasives Harnblasenkarzinom (NMIBC) zusammengefasst. Ab Stadium T2 spricht man von einem muskelinvasiven Harnblasenkarzinom (MIBC).
Bei einem NMBIC muss bis auf eine Sonographie keine weitere Bildgebung des oberen Harntrakts erfolgen. Ausnahmen stellen eine Tumorlokalisation im Bereich des Trigonum vesicae und/oder multiple Tumoren und/oder high grade Tumore dar. In diesen Situationen sollte eine CT-Urographie durchgeführt werden, alternativ eine MRT oder eine Ausscheidungsurographie (AUG).
Bei einem muskelinvasiven Harnblasenkarzinom müssen weitere Herde im Harntrakt augeschlossen werden. Daher wird eine CT des Abdomens (mit CT-Urographie), des Beckens und des Thorax mit Kontrastmittel durchgeführt. Die CT des Beckens kann durch eine MRT-Untersuchung ersetzt werden. Bei klinischen Hinweisen kann eine kraniale CT oder eine Knochenszintigraphie indiziert sein.
CT-Fallbeispiel
DICOM-Modelle können auf Mobilgeräten leider nicht angezeigt werden.
Risikostratifizierung
Nach Diagnose eines NMIBC erfolgt anhand der EORTC-Kriterien eine Risikostratifizierung (low, intermediate und high risk). Sie ermöglicht eine Vorhersage der Progressions- und Rezidiv-Wahrscheinlichkeit. Die Kriterien basieren auf sechs klinischen und pathologischen Faktoren:
- Anzahl der Tumoren
- Tumorgröße
- Rezidivrate
- T-Stadium
- Vorhandensein eines CIS
- Tumor-Grading
Differentialdiagnosen
Differentialdiagnosen einer Hämaturie sind neben einem Harnblasenkarzinom:
- Harnwegsinfekte (z.B. hämorrhagische Zystitis), Glomerulonephritis
- weitere Tumore: Nierenzellkarzinom, Prostatakarzinom oder Sarkome
- benigne Prostatahyperplasie
- Urolithiasis
- zystische Nierenerkrankungen
- Harnröhrenstrikturen
- Hämoglobinurie bei intravasaler Hämolyse
- Rotfärbung des Urins bei Verzehr großer Mengen von roter Bete, Brombeeren und Rhabarber, bei Einnahme von Rifampicin oder im Rahmen einer Myoglobinurie.
Weiterhin ist an eine vesikointestinale Fistel im Rahmen eines Morbus Crohn zu denken.
Therapie
Die Therapie des Harnblasenkarzinoms richtet sich nach dem Staging. Bei frühzeitiger Diagnose ist eine minimal-invasive Therapie möglich, fortgeschrittenere Stadien erfordern meist ein radikales Vorgehen mit Entfernung der Harnblase.
siehe Hauptartikel: Therapie des Harnblasenkarzinoms
Lokal begrenzter Tumor
Ein lokal begrenzter Tumor umfasst die T-Stadien pTa, pTis und pT1. Die Standardtherapie ist eine transurethrale Resektion (TUR) mittels Elektroschlinge. Innerhalb von 6 Stunden postoperativ wird Mitomycin-C intravesikal appliziert ("Frühinstillation").
In bestimmten Fällen, insbesondere bei einem CIS, wird eine Immunmodulation mit intravesikaler Installation von Bacillus Calmette-Guérin-Stämmen (BCG) (attenuierte Mykobakterien) in wöchentlichem Abstand postoperativ für mindestens ein Jahr empfohlen.
Bei bestimmten Risikokonstellationen wird eine TUR-Nachresektion innerhalb von 4 bis 6 Wochen oder eine radikale Zystektomie empfohlen..
Lokal fortgeschrittener Tumor
Als lokal fortgeschrittener Tumor werden Rezidivtumore und MIBC (pT ≥ 2) bezeichnet. In kurativer Intention ist eine radikale Zystektomie mit pelviner Lymphadenektomie und anschließender Harnableitung die Therapie der Wahl. Präoperativ (neoadjuvant) und ggf. postoperativ (adjuvant) kann eine Cisplatin-basierte Chemotherapie erfolgen. In ausgewählten Fällen kann auch eine adjuvante Immuntherapie erfolgen.
Die radikale Zystektomie umfasst die Entfernung der gesamten Blase und Nachbarorgane:
- Mann: Prostata, Bläschendrüse, proximaler Samenleiter, ggf. distaler Harnleiter
- Frau: Uterus, Adnexe, ggf. distaler Harnleiter, ggf. ventrales Drittel der Vaginalwand
Es gibt eine Vielzahl an verschiedenen Möglichkeiten zur Harnableitung, wobei keine vergleichenden Daten aus randomisierten kontrollierten Studien vorliegen. Entsprechend müssen Patienten über die verschiedenen Formen und Vor- bzw. Nachteile aufgeklärt werden.
Unterschieden wird grundsätzlich zwischen inkontinenter Harnableitung und kontinenter Harnableitung:
- Harnleiterhautfisteln (Ureterokutaneostomie bzw. Transuretero-Ureterokutaneostomie): Implantation der Ureteren in die Bauchhaut und Ableitung des Urins in einen permanent aufgeklebten Auffangbeutel (einfachste Operationsform, Einsatz insbesondere in palliativen Stadien bei multimorbiden Patienten)
- Ileum-/Kolon-Conduit: Ein Darmstück wird ausgeschaltet und zu einem Reservoir geformt, an das die Ureteren angeschlossen werden und das perkutan im rechten Unterbauch ausgeleitet wird; Urinbeutel wird permanent auf die Haut geklebt (Goldstandard der inkontinenten Ableitung)
- transrektale Harnableitungen ("Ureterosigmoideostomie"): Implantation der Uretern in das Rektum, Kontinenz über Musculus sphincter ani (Limitationen aufgrund vieler Risiken)
- orthotoper Harnblasenersatz (Neoblase): Bildung eines intestinalen Reservoirs, in dem die Ureteren und die Urethra eingenäht werden, z.B. Studer-, Ulmer-Neoblase (Routineverfahren insbesondere bei Patienten unter 75. Lebensjahr)
- katheterisierbare Pouchformen: antirefluxive Implantation der Ureteren in ein aus Dünndarm, Ileozökalpol oder Sigma gebildetes Niedrigdruckreservoir, welches über eine intermittierende Katheterisierung entleert werden kann
Fernmetastasierter Tumor
Bei Fernmetastasen kommen eine palliative Chemotherapie, eine palliative Zystektomie sowie weitere symptomatische Maßnahmen in Frage.
Die Erstlinientherapie bei metastasiertem Harnblasenkarzinom besteht in einer Cisplatin-basierten Chemotherapie. Falls der Patient nicht für eine Cisplatin-basierte Therapie geeignet ist, z.B. bei schlechtem Allgemeinzustand, eingeschränkter Nierenfunktion oder höhergradiger Herzinsuffizienz, kann Gemcitabin und Carboplatin eingesetzt werden.
Im metastasierten Setting stellen zudem Immuncheckpoint-Inhibitoren einen festen Bestandteil der systemischen Therapie dar. Die Auswahl der Therapie richtet sich nach Vorbehandlung, PD-L1-Status, Komorbiditäten und Therapieziel.
Nach Ansprechen oder Stabilisierung unter platinbasierter Erstlinientherapie ist Avelumab als Erhaltungstherapie zugelassen und etabliert.
Bei Progress nach platinbasierter Chemotherapie stellt Pembrolizumab eine zugelassene und etablierte systemische Therapieoption dar. Weitere mögliche Optionen in späteren Therapielinien sind Vinflunin oder Taxane, deren Einsatz jedoch gegenüber modernen Immun- und zielgerichteten Therapien an Bedeutung verloren hat.
CTLA-4-Inhibitoren (z.B. Ipilimumab, Tremelimumab) werden im Rahmen klinischer Studien untersucht, derzeit jedoch ohne etablierte Standardindikation.
Rehabilitation
Nach Zystektomie sowie nach Chemotherapie ist eine stationäre, fachurologische Anschlussheilbehandlung notwendig. Ziele sind die Therapie von postoperativen Funktionsstörungen (v.a. Inkontinenz, Sexualstörungen), die Wiederherstellung der physischen und psychischen Leistungsfähigkeit sowie der Teilhabe am Sozialleben. Sie umfasst eine psychoonkologische Betreuung, Physiotherapie, Entspannungsverfahren sowie Patientenschulung und Sozialberatung.
Nachsorge
Wegen der Rezidivneigung sind bei behandelten Patienten regelmäßige Kontrolluntersuchungen notwendig. Je nach Risikokonstellation (EORTC-Kriterien) unterscheidet sich das Zeitintervall und das Ausmaß der eingesetzten Diagnostik der Harnblasenkarzinome.
Eine Knochenszintigraphie (in Kombination mit SPECT oder SPECT/CT) ist empfohlen bei Knochenschmerzen oder unklarer Erhöhung der alkalischen Phosphatase. Unklare Befunde sollten durch eine konventionelle Röntgendiagnostik oder MRT bzw. CT abgeklärt werden.
Je nach Art und Länge des ausgeschalteten Darmsegments für die Harnableitung kann eine metabolische Azidose auftreten. Daher ist bei der Nachsorge auf die Anfertigung einer Blutgasanalyse (BGA) zu achten. Weiterhin sollte bei Resektion des terminalen Ileums auf einen Vitamin-B12-Mangel (ab 20 cm Länge) und auf ein Gallensäureverlustsyndrom (bei Resektion von 60 bis 80 cm) geachtet werden.
Prognose
Ohne sofortige Therapie ist mit einer frühzeitigen Metastasierung zu rechnen. Die 5-Jahres-Überlebensrate beträgt je nach Stadium 75 % (I), 50 % (II), 25 % (III) und < 5 % (IV).
Prävention
Abgesehen von der Vermeidung genannter Risikofaktoren existieren keine Empfehlungen zur Prävention eines Harnblasenkarzinoms.
Bei Hochrisikopersonen (z.B. Raucher, berufsbedingte Risikogruppen) kann evtl. mittels Urinuntersuchungen auf Mikrohämaturie ein Harnblasenkarzinom früher erkannt werden. Eine wiederholte asymptomatische Mikrohämaturie sollte entsprechend urologisch evaluiert werden.
Grundsätzlich liegt jedoch derzeit (2019) kein diagnostischer Marker zur Früherkennung des Harnblasenkarzinoms vor. Ein Screening z.B. mittels Urinzytologie, CK20, CYFRA 21-1 oder NMP 22 wird weder für die Gesamtbevölkerung noch für Risikopopulationen empfohlen.
Bildquellen
- Bildquelle DICOM-Viewer: Kirk et al. (2016). The Cancer Genome Atlas Urothelial Bladder Carcinoma Collection (TCGA-BLCA) (Version 8). The Cancer Imaging Archive.
Literatur
- S3-Leitlinie Harnblasenkarzinom, Stand 03.2025, abgerufen am 23.01.2026
Quellen
- ↑ Genetics Home References, Eintrag Bladder cancer abgerufen am 10.6.2016