Prostatakarzinom
Synonyme: Prostata-Ca, Prostatakrebs
Englisch: carcinoma of the prostate, prostate cancer
Definition
Epidemiologie
Beim Prostatakarzinom handelt es sich um den häufigsten malignen Tumor beim Mann. Prostatakrebs macht in Deutschland etwa 22,7 % aller Krebserkrankungen aus. Dabei werden etwa 75.000 Neuerkrankungen pro Jahr diagnostiziert.
Des Weiteren ist das Prostatakarzinom die zweithäufigste Ursache für krebsbedingte Todesfälle bei Männern. Im Jahr 2020 verstarben 15.400 Patienten an einem Prostatakarzinom.
Das durchschnittliche Erkrankungsalter liegt bei ca. 71 Jahren. Es wird davon ausgegangen, dass sowohl die Prävalenz als auch die Inzidenz aufgrund des demographischen Wandels ansteigen werden.[1] Das Lebenszeitrisiko für die Diagnose wird auf 10 bis 15 % geschätzt.
Ätiologie
Die Ätiologie des Prostatakarzinoms ist wie bei vielen anderen Krebserkrankungen bisher (2025) noch nicht eindeutig geklärt. Es existieren jedoch verschiedene Risikofaktoren:
- Alter: Das Risiko für ein Prostatakarzinom steigt mit dem Lebensalter.
- Familiäre Veranlagung: Männer, deren Väter und/oder Brüder an einem Prostatakarzinom erkrankt sind bzw. waren, haben ein zweifach erhöhtes Risiko, ebenfalls an einem Prostatakarzinom zu erkranken.[2]
- Keimbahnmutationen, wie die HOXB13-Mutation, können das Risiko um das 8-fache erhöhen. Auch Mutationen in BRCA1 und BRCA2 erhöhen das Risiko um das 3 bis 8-fache und sind mit weiteren Krebserkrankungen assoziiert (z.B. HNPCC und HBOC).
- Rauchen: mit aggressiveren Verläufen und erhöhter Mortalität assoziiert, nicht klar mit der Entstehung
- Alkoholkonsum: inkonsistente Datenlage
Pathologie
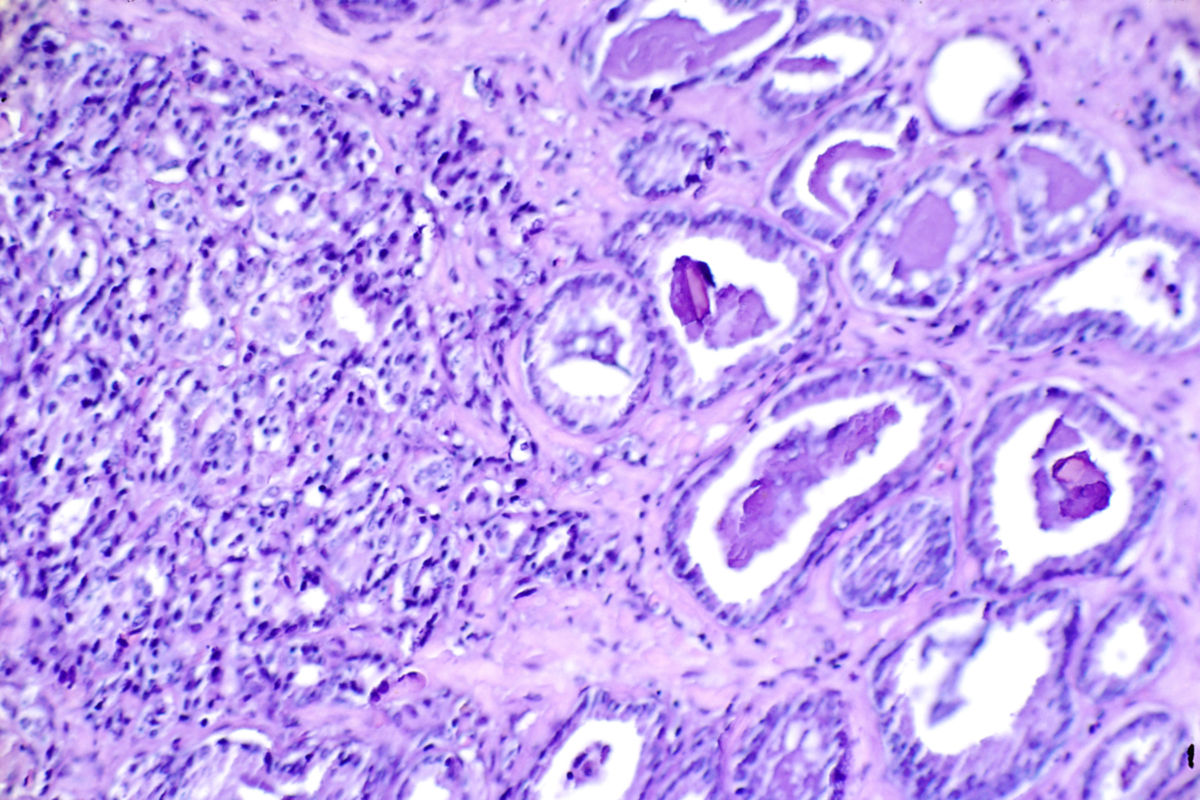
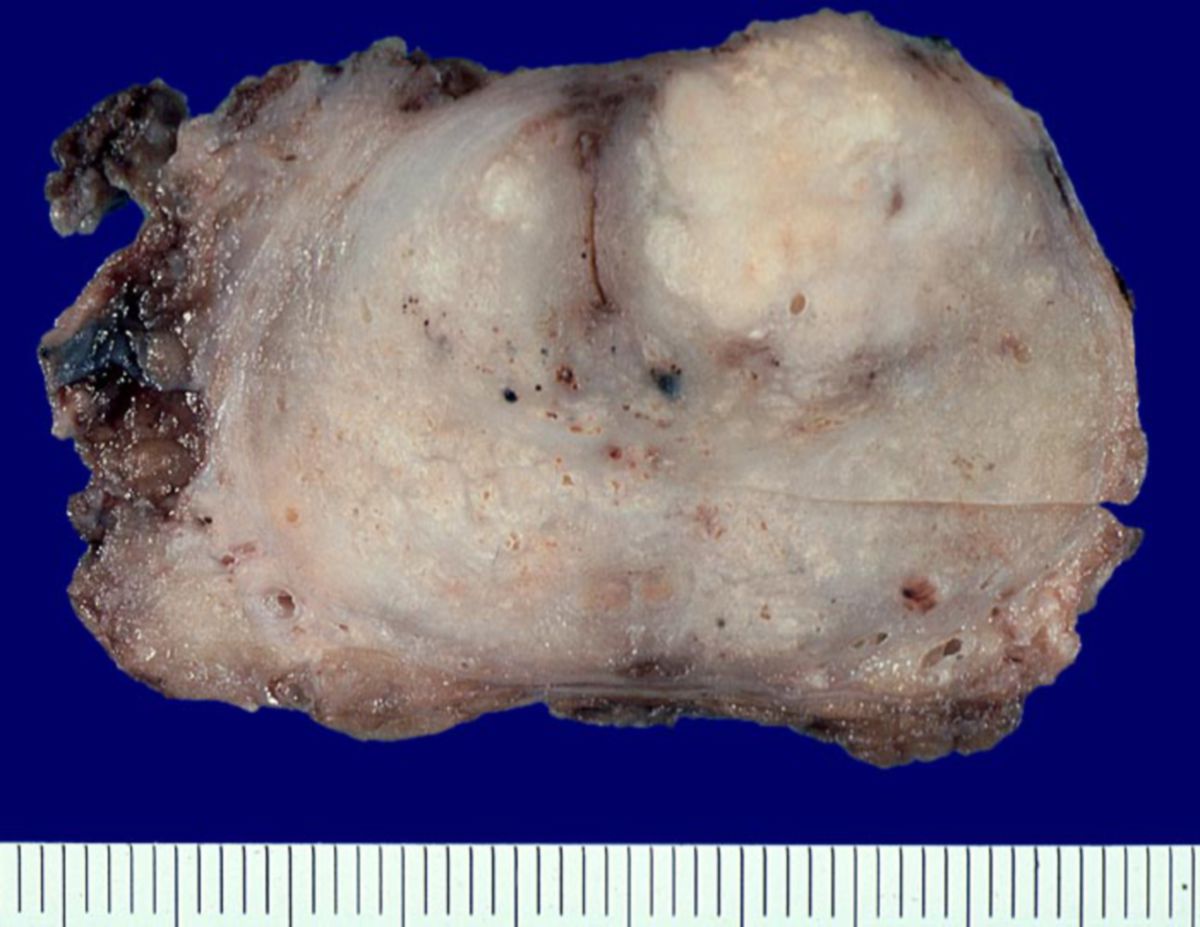
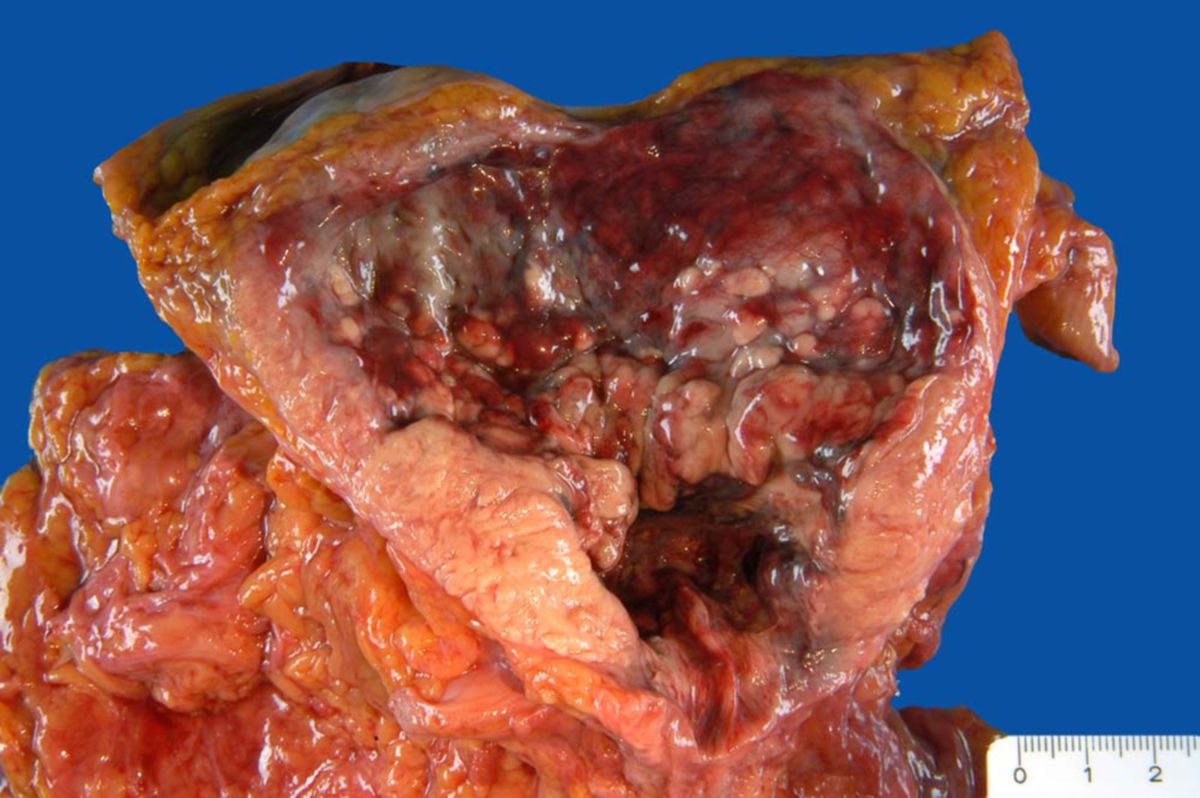
Das Prostatakarzinom ist in der überwiegenden Mehrzahl ein Adenokarzinom der Prostata, das aus den Drüsenepithelzellen hervorgeht. Etwa 95 % aller malignen Prostatatumoren gehören zu dieser Gruppe. Histologisch entstammen sie meist den Azini der peripheren Zone, die mit rund 70 % der Fälle den Hauptsitz darstellt. Deutlich seltener entwickeln sich Tumoren aus der zentralen oder der Übergangszone der Prostata; diese machen zusammen etwa 20 - 30 % aus.
Neben dem klassischen azinären Adenokarzinom existieren seltenere Varianten, darunter das duktale Adenokarzinom, das sich häufig periurethral entwickelt und durch ein aggressiveres klinisches Verhalten mit erhöhter Metastasierungsneigung gekennzeichnet ist. Noch seltenere Sonderformen umfassen neuroendokrine Karzinome (inklusive kleinzelligem Prostatakarzinom), muzinöse Adenokarzinome und andere histologische Subtypen, die sich in Prognose und Therapie teils erheblich unterscheiden.
Zytogenetik
Im Gegensatz zu anderen epithelialen Malignomen zeigt das Prostatakarzinom keine typische Adenom-Karzinom-Sequenz und auch kein spezifisches Mutationsmuster. Es sind eine Vielzahl unterschiedlicher Zelllinien des Prostatakarzinoms bekannt.
Zytogenetisch zeigen sich heterogene genomische Veränderungen in Form von Punktmutationen an verschiedenen DNA-Positionen sowie Verlusten von Allelen oder ganzen Chromosomen. Manchmal liegt zusätzlich eine Polyploidie vor. Eine wichtige Rolle spielen wahrscheinlich Veränderungen des Androgenrezeptor-Gens. In späteren Erkrankungsstadien können auch klassische Tumorsuppressorgene wie TP53 von Deletionen oder Mutationen betroffen sein.
Klinik
Im Frühstadium ist Prostatakrebs meist asymptomatisch. Im späteren Stadium können unter anderem folgende Beschwerden auftreten:
- Miktionsstörungen
- Pollakisurie
- Dysurie (Algurie)
- Schwacher Harnstrahl
- Nachtropfen
- Unterbrechung des Harnstrahls
- Restharnbildung
- Nykturie
Bei ausgedehnten Tumoren kann es weiterhin zu Erektionsstörungen kommen. Eine Hämaturie oder Hämatospermie sind selten.
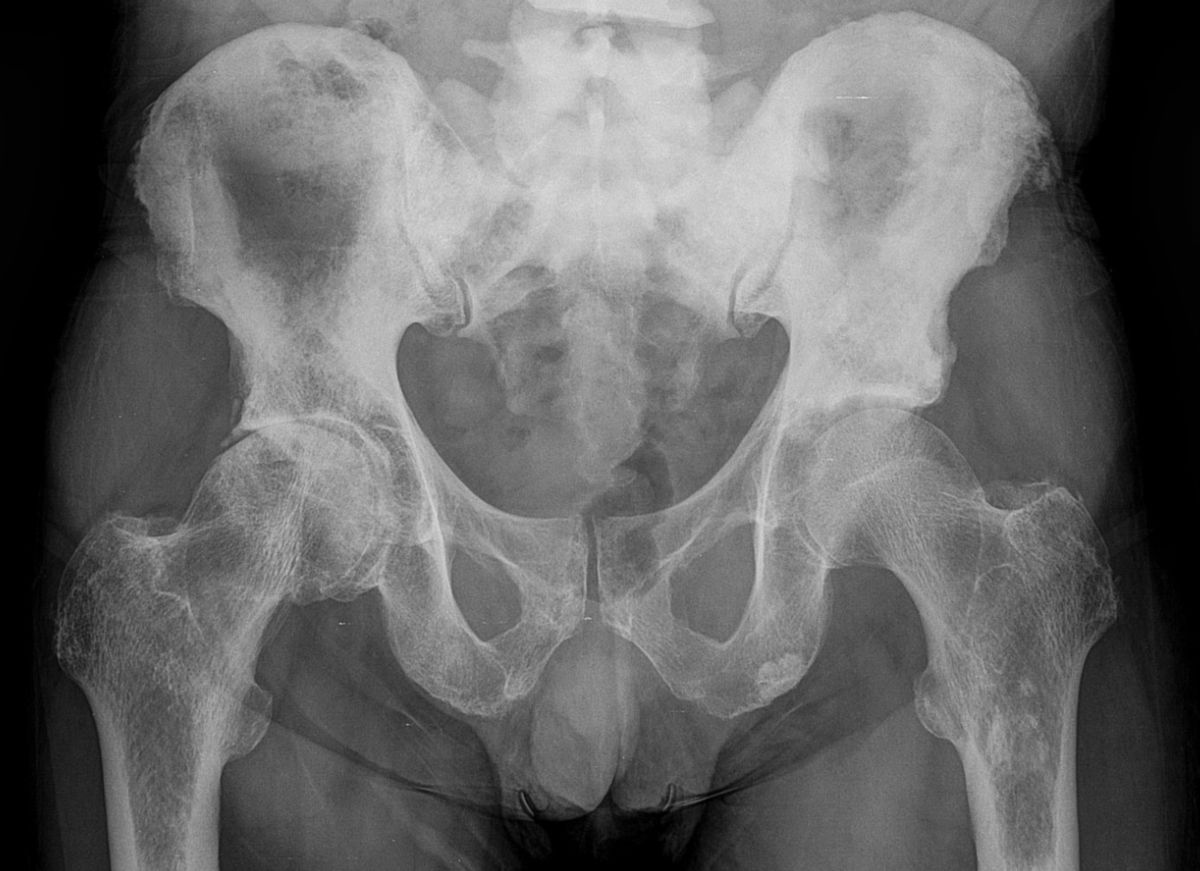
Das Prostatakarzinom kann sich durch lokale Invasion (typischerweise in die Blase und die Samenblasen, selten in Harnröhre oder Rektum), durch lymphatische Ausbreitung (zuerst pelvine, dann paraaortale und inguinale Lymphknoten) oder durch hämatogene Metastasen ausbreiten. Häufige Lokalisationen für hämatogene Metastasen sind:
- Knochen (90 %)
- Lunge (45 %)
- Leber (25 %)
- Pleura (20 %)
- Nebennieren (15 %)
Tritt im fortgeschrittenen Stadium eine Metastasierung auf, können neben Allgemeinsymptomen wie Anämie und ungewolltem Gewichtsverlust weitere Beschwerden hinzukommen, die von der Lokalisation der Metastasen abhängig sind, z.B.
- pathologische Frakturen und neurologische Ausfälle bei Knochenmetastasen
- Lymphödem der Beine oder des Hodensacks bei Lymphknotenmetastasen
Diagnostik
Die Diagnostik des Prostatakarzinoms stützt sich heute (2026) auf ein mehrstufiges Vorgehen.
Nach einem auffälligen PSA-Wert oder anderen Verdachtsmomenten wird zunächst eine klinische Untersuchung vorgenommen, bei der die digital-rektale Untersuchung (DRU) zwar weiterhin Teil der urologischen Basisdiagnostik ist, in der Früherkennung jedoch keine eigenständige Rolle mehr spielt (siehe Früherkennung).
Bildgebung
- Transrektale Sonografie: Sie ist eine kostengünstige Primärmethode, welche die Prostatagröße und auffällige Herde darstellen kann. Ihre Sensitivität für die Detektion klinisch signifikanter Prostatakarzinome ist jedoch begrenzt, sodass sie heute vor allem zur Volumenbestimmung und zur Berechnung der PSA-Dichte dient und nicht zur alleinigen Tumordiagnostik geeignet ist.
- Multiparametrische MRT der Prostata: Sie ermöglicht eine hochsensitive Detektion suspekter Areale und erlaubt die Einstufung nach dem international etablierten PI-RADS-Score. Bei Nachweis von PI-RADS 4 oder 5 sowie in ausgewählten Fällen von PI-RADS 3 erfolgt die Indikation zur Biopsie.
Für das Staging werden ebenfalls bildgebende Verfahren eingesetzt. Insbesondere die PSMA-PET/CT hat sich als deutlich überlegen gegenüber Knochenszintigrafie und konventioneller CT erwiesen und wird bei höhergradigen Tumoren (ISUP ≥ 3, cT3/4, PSA > 20 ng/ml) empfohlen. Ergänzend können Abdomensonografie und CT zur Beurteilung von Lymphknotenmetastasen eingesetzt werden.
siehe Hauptartikel: Prostatakarzinom (Bildgebung)
Biopsie
Um eine definitive pathohistologische Diagnose zu ermöglichen, werden Biopsien der suspekten Bereiche entnommen. Der Zugang erfolgt entweder transperineal oder transrektal. Neben der klassischen Stanzbiopsie werden zunehmend modernere Verfahren eingesetzt. Heute (2025) gilt die MRT-gesteuerte Fusionsbiopsie als diagnostischer Standard, da sie eine höhere Detektionsrate klinisch signifikanter Karzinome bei gleichzeitiger Reduktion unnötiger Biopsien erlaubt.
siehe Hauptartikel: Prostatabiopsie
Verlaufskontrolle
Die Verlaufskontrolle erfolgt weiterhin primär durch die Bestimmung des PSA-Wertes.
Humangenetische Untersuchung
Bei Patienten mit metastasiertem Prostatakarzinom sollte eine humangenetische Beratung und eine Keimbahntestung angeboten werden. Hintergrund ist die hohe Prävalenz pathogener Varianten in DNA-Reparaturgenen von > 10 % in diesem Patientenkollektiv.
Einteilung
...nach Gleason-System und ISUP-Gruppen
Das Grading anhand des Gleason-Scores dient der prognostischen Beurteilung des Prostatakarzinoms und beruht auf der histologischen Morphologie des Drüsenmusters. Dabei wird die Summe der häufigsten und zweithäufigsten Wachstumsmuster erfasst und jeweils mit einem Grad von 1 bis 5 bewertet:
- Grad 1 entspricht gut differenzierten, drüsenbildenden Tumoren.
- Grad 5 beschreibt undifferenzierte, solide oder strangförmige Zellverbände.
Die beiden dominierenden Muster werden addiert. Daraus ergibt sich ein Gleason-Score zwischen 2 und 10 (z.B. 3+4=7).
Da sich gezeigt hat, dass verschiedene Kombinationen (z. B. 3+4 vs. 4+3) prognostisch sehr unterschiedlich verlaufen, hat die International Society of Urological Pathology (ISUP) 2014 ein vereinfachtes, klinisch orientiertes Grading-System eingeführt, die ISUP-Graduierungsgruppen (ISUP-GG). Dieses ersetzt zunehmend die reine Gleason-Zahl und wird auch in der aktuellen UICC-Klassifikation berücksichtigt:
| ISUP-GG | Gleason | Beschreibung |
|---|---|---|
| 1 | 3+3=6 | Gut differenziert, niedriges Risiko |
| 2 | 3+4=7 | überwiegend Gleason-Muster 3, günstiges intermediäres Risiko |
| 3 | 4+3=7 | überwiegend Gleason-Muster 4, ungünstiges intermediäres Risiko |
| 4 | 8 (4+4, 3+5, 5+3) | hohes Risiko |
| 5 | 9-10 (4+5, 5+4, 5+5) | sehr hohes Risiko |
...nach TNM-Klassifikation
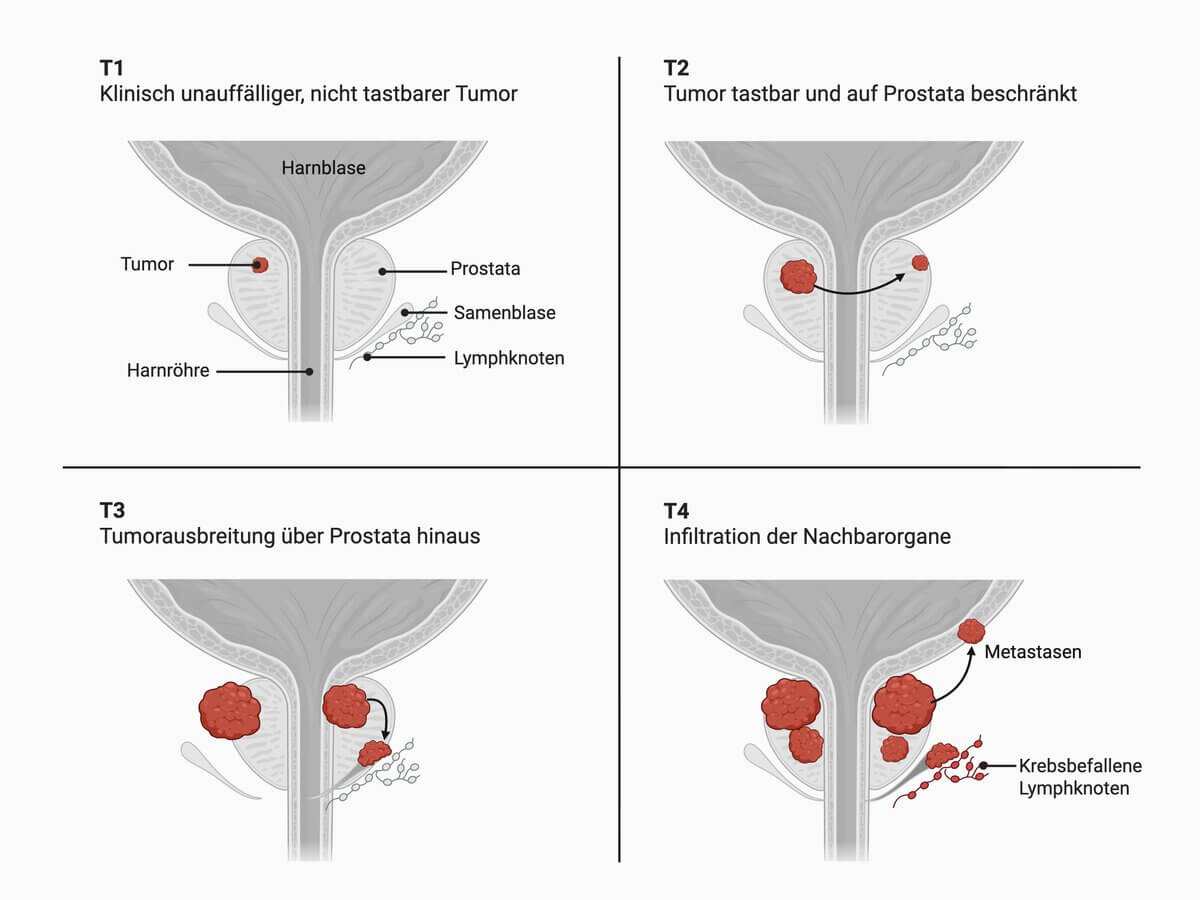
Das Prostakarzinom kann nach der TNM-Klassifikation wie folgt eingeteilt werden:[3]
Tumorgröße
| T-Kategorie | Bedeutung |
|---|---|
| T1 | Klinisch unauffälliger, nicht tastbarer Tumor
|
| T2 | Tumor tastbar und auf Prostata beschränkt
|
| T3 | Ausdehnung des Tumors über die Prostatakapsel hinaus
|
| T4 | Nachbarorgane sind von dem Tumor infiltiert (z.B Rektum, Beckenboden) |
Lymphknoten
| N-Kategorie | Bedeutung |
|---|---|
| N0 | Keine regionale Lymphknotenmetastasen nachweisbar |
| N1 | Regionale Lymphknotenmetastasen nachweisbar |
Fernmetastasen
| M-Kategorie | Bedeutung |
|---|---|
| M0 | Keine Fernmetastasen |
| M1 | Fernmetastasen
|
...nach UICC-Stadien
Die UICC-Stadien des Prostatakarzinoms (8. Auflage) basieren auf einer Kombination aus TNM-Kategorie, PSA-Wert und ISUP-GG.
| Stadium | TNM-Befund | PSA | ISUP-GG |
|---|---|---|---|
| I | T1 oder T2a, N0, M0 | < 10 ng/ml | 1 |
| IIA | T1 oder T2a, N0, M0 | < 20 ng/ml | 2 |
| IIB | T2b oder T2c, N0, M0 | < 20 ng/ml | 1 - 2 |
| IIC | T1 oder T2, N0, M0 | < 20 ng/ml | 3 - 4 |
| IIIA | T3a, N0, M0 | ≥ 20 ng/ml | jede |
| IIIB | T3b oder T4, N0, M0 | jeder | jede |
| IIIC | jedes T, N0, M0 | jeder | 5 |
| IVa | jedes T, N1, M0 | jeder | jede |
| IVb | jedes T, jedes N, M1 | jeder | jeder |
Zum Zeitpunkt der Diagnosestellung liegt in 68 % der Fälle ein Stadium I oder II vor.
...nach Hormonempfindlichkeit
Neben der Einteilung nach TNM und UICC wird das Prostatakarzinom auch klinisch nach seiner Hormonempfindlichkeit eingeteilt, da hiervon die systemische Therapie maßgeblich abhängt:
Als hormonsensitives Prostatakarzinom (HSPC) bezeichnet man Tumoren, die auf eine Androgendeprivationstherapie (ADT) noch ansprechen. Dies umfasst sowohl lokal fortgeschrittene als auch metastasierte Stadien.
Von einem kastrationsresistenten Prostatakarzinom (CRPC) spricht man, wenn die Erkrankung trotz abgesenktem Testosteronspiegel (< 50 ng/dl) weiter progredient ist. Dies kann sich in einem erneuten PSA-Anstieg, im Auftreten neuer Metastasen oder in klinischer Progression äußern. Dabei unterscheidet man zwischen nichtmetastasierten (nmCRPC) und metastasierten (mCRPC) Formen.
...nach klinischem Risiko
Neben der anatomisch-histologischen Stadieneinteilung wird das Prostatakarzinom auch nach dem klinischen Risiko klassifiziert. Diese Risikostratifikation dient vor allem der Therapieplanung im lokalisierten Stadium und basiert auf prätherapeutischen Parametern wie PSA-Wert, klinischem T-Stadium und histologischem Grading (Gleason-Score bzw. ISUP-Graduierungsgruppe).
Die klassische D’Amico-Klassifikation unterscheidet drei Risikogruppen; die Einstufung erfolgt nach dem jeweils ungünstigsten Kriterium:
- Niedriges Risiko: T1–T2a, PSA < 10 ng/ml und Gleason-Score ≤ 6 (ISUP 1).
- Intermediäres Risiko: T2b oder PSA 10–20 ng/ml oder Gleason-Score 7 (ISUP 2–3).
- Hohes Risiko: T2c oder höher, PSA > 20 ng/ml oder Gleason-Score 8–10 (ISUP 4–5).
In den aktuellen NCCN-Guidelines (Stand 2025) wird eine differenziertere Unterteilung vorgenommen:
- Very low risk: T1c, PSA < 10 ng/ml, ISUP 1, PSA-Dichte < 0,15 ng/ml/cm³, ≤ 2 positive Biopsiezylinder.
- Low risk: T1–T2a, PSA < 10 ng/ml, ISUP 1.
- Intermediate risk: T2b–T2c oder PSA 10–20 ng/ml oder ISUP 2–3. Hier wird zusätzlich zwischen "favorable" (z.B. Gleason 3+4 oder ≤ 50 % positive Stanzen) und "unfavorable" (z.B. Gleason 4+3 oder > 50 % positive Stanzen) unterschieden.
- High risk: T3a oder PSA > 20 ng/ml oder ISUP 4–5.
- Very high risk: T3b–T4 oder primär multiple ISUP-5-Herde.
Therapie
Da das Prostatakarzinom sehr heterogen verlaufen kann und bei vielen Patienten langsam progredient ist, richtet sich die Wahl der Therapie nach Tumorstadium, Differenzierungsgrad, Begleiterkrankungen und Lebensalter. Grundsätzlich unterscheidet man zwischen kurativen Strategien, aktiver Überwachung und palliativen Konzepten.
Aktive Überwachung
Ein wachsender Stellenwert kommt der aktiven Überwachung (Active Surveillance) zu. Sie wird heute nicht nur für Patienten mit niedrigem Risiko (ISUP-GG 1), sondern auch für sorgfältig ausgewählte Patienten mit ISUP-GG 2 empfohlen, sofern weniger als 25 % Gleason-Muster 4 vorliegt und keine kribriformen oder intraduktalen Wachstumsanteile bestehen. Innerhalb der aktiven Überwachung soll der PSA-Wert in den ersten zwei Jahren 3-monatlich (ISUP-GG 2) oder alle 6 Monate (ISUP-GG 1) kontrolliert werden. Zudem wird eine MRT-gestützte Re-Biopsie nach 12 bis 18 Monaten empfohlen. Bei histologischem Progress, nicht aber bei alleinigem PSA-Anstieg soll die aktive Überwachung zugunsten der Operation oder Radiotherapie abgebrochen werden. Eine rein MRT-gestützte aktive Überwachung ohne Re-Biopsie ist möglich, aber noch nicht ausreichend evaluiert. Ziel ist es, eine kurative Therapie nur dann einzuleiten, wenn sich der Befund verschlechtert.
Bei älteren oder multimorbiden Patienten mit begrenzter Lebenserwartung ist das Watchful Waiting eine Option, bei dem eine palliative Behandlung nur bei Symptomen oder Komplikationen erfolgt.
Operative Therapie
Die radikale Prostatektomie wird für Patienten mit lokalisiertem Prostatakarzinom und einer ISUP-GG > 2 oder 2 mit ungünstigem Risikoprofil empfohlen. Während die klassischen offenen Operationen (radikale retropubische und perineale Prostatektomie) historisch bedeutsam waren, haben minimal-invasive und roboterassistierte Ansätze heute den größten Stellenwert. Sie zeigen Vorteile bei der frühen Wiedererlangung der Kontinenz, jedoch keine Unterschiede im langfristigen onkologischen Ergebnis. Eine adjuvante Strahlentherapie wird bei pT3/pT4-Tumoren, positiven Resektionsrändern oder hohem ISUP-Grad empfohlen; alternativ kann bei PSA-Rezidiv eine frühe Salvage-Bestrahlung erfolgen.
Strahlentherapie
Die externe (perkutane) Strahlentherapie erfolgt heute überwiegend als intensitätsmodulierte und bildgeführte Radiotherapie (IMRT/IGRT) mit Gesamtdosen von 74 - 80 Gray. Hypofraktionierte Schemata gelten als gleichwertig. Bei Hochrisikokarzinomen kann außerdem ein fokaler Boost appliziert werden. Bei Patienten mit sehr hohem Risikoprofil und dem Stadium cN0 (PSMA-PET/CT negativ) kann eine ergänzende adjuvante Bestrahlung der Lymphabflussgebiete des Beckens erfolgen.
Eine weitere Option ist die Brachytherapie, die als Monotherapie insbesondere bei günstigem intermediären Risiko in Betracht kommt.
Die Strahlentherapie kann durch eine zusätzliche antihormonelle Therapie ergänzt werden, bei intermediärem Risiko für vier bis sechs Monate, bei Hochrisikotumoren für bis zu drei Jahre.
Medikamentöse Therapie
In fortgeschrittenen Stadien steht die medikamentöse Therapie im Vordergrund. Grundpfeiler ist die Androgendeprivationstherapie (ADT).
Hormonsensitives Prostatakarzinom
Beim HSPC – also in Situationen, in denen die Erkrankung auf eine Absenkung des Testosteronspiegels noch anspricht – gilt heute (2025) die Kombination einer ADT mit zusätzlichen Substanzen als Standard. Hierzu zählen die Chemotherapie mit Docetaxel oder modernen Inhibitoren des Androgenrezeptor-Signalwegs wie Abirateron, Apalutamid, Enzalutamid oder Darolutamid. Diese Kombinationstherapien haben in großen Studien das Gesamtüberleben und die Zeit bis zur Progression deutlich verbessert und sind vor allem im metastasierten HSPC etabliert.
Ältere Antiandrogene der ersten Generation (Cyproteronacetat, Flutamid, Bicalutamid) haben heute nur noch historische Bedeutung.
Kastrationsresistentes Prostatakarzinom
Auch beim CRPC spielen moderne Hormontherapeutika eine wesentliche Rolle. Zusätzlich bleibt die Chemotherapie ein wichtiges Standbein, wobei Docetaxel weiterhin als Standardpräparat gilt und Cabazitaxel bei Progress nach Docetaxel eingesetzt werden kann. In der metastasierten Situation (mCRPC) gewinnen zudem zielgerichtete Ansätze an Bedeutung, darunter PARP-Inhibitoren bei nachgewiesenen DNA-Reparatur-Defekten sowie Radionuklidtherapien wie Lutetium (177Lu) Vipivotid-Tetraxetan, die insbesondere bei therapierefraktären Krankheitsverläufen eingesetzt wird.
Experimentelle Verfahren
Weitere experimentelle Verfahren wie hochintensiver fokussierter Ultraschall (HIFU), immuntherapeutische Ansätze (Sipuleucel-T, in den USA zugelassen) oder virale Vektorvakzinen befinden sich in klinischer Erprobung und sind bislang nicht als Standard etabliert.
Früherkennung
Männer ab 45 Jahren können einmal jährlich eine gesetzliche Früherkennung des Prostatakarzinoms in Anspruch nehmen. Diese umfasst ein ärztliches Gespräch und bislang auch eine digital-rektale Untersuchung. In der neuen S3-Leitlinie der DGU von 2025 wird die digital-rektale Untersuchung nicht mehr als Screeninguntersuchung empfohlen, da ihre Sensitivität für die Früherkennung unzureichend ist.[4]
Im Zentrum steht stattdessen die Bestimmung des prostataspezifischen Antigens (PSA). Diese ist nach wie vor keine GKV-Leistung, wird aber als wichtigstes Instrument der risikoadaptierten Früherkennung angesehen. Empfohlen wird ein Basis-PSA ab dem 45. Lebensjahr (bei genetischer Prädisposition wie BRCA2-Mutation oder Lynch-Syndrom ab 40 Jahren). Das weitere Vorgehen ist abhängig vom Ausgangswert:
- Liegt der PSA-Wert unter 1,5 ng/ml, genügt eine erneute Kontrolle nach fünf Jahren.
- Werte zwischen 1,5 und 3 ng/ml erfordern Kontrollen alle zwei Jahre.
- Ab 3 ng/ml sind engmaschige Kontrollen, eine Risikoeinschätzung unter Berücksichtigung von Prostatavolumen, Familienanamnese und PSA-Dichte sowie gegebenenfalls eine multiparametrische MRT angezeigt.
Damit soll sowohl eine frühe Erkennung klinisch relevanter Karzinome ermöglicht als auch die Gefahr einer Überdiagnostik und Übertherapie reduziert werden.
Möglich ist auch eine transrektale Sonographie, die jedoch ebenfalls keine GKV-Leistung ist.
Besteht nach dieser Abklärung ein konkreter Verdacht auf ein Prostatakarzinom, ist die Biopsie weiterhin der diagnostische Standard.
Podcast


Quiz
Quellen
- ↑ Aktualisierung S3-Leitlinie zum Prostatakarzinom, Pressemitteilung der Deutschen Krebsgesellschaft 01.07.2024, abgerufen am 05.07.2024
- ↑ Leitlinie Prostata-Ca, abgerufen am 27.01.2022
- ↑ EAU Guidelines on Prostata Cancer 2025
- ↑ S3-Leitlinie Prostatakarzinom Version 8.0 - Juli 2025 AWMF-Registernummer: 043-022OL
Bildquelle
Weblink
- S3-Leitlinie Prostatakarzinom. AWMF Registernummer 043 - 022OL, Stand: 31.05.2024, abgerufen am 05.07.2024