Lutetium (177Lu) Vipivotid-Tetraxetan
Handelsname: Pluvicto®
Synonym: 177Lu-PSMA-617 (obsolet)
Englisch: Lutetium Lu-177 vipivotide tetraxetan
Definition
Lutetium (177Lu) Vipivotid-Tetraxetan ist ein Arzneimittel zur Behandlung des metastasierten PSMA-positiven kastrationsresistenten Prostatakarzinoms (PSMA-positives mCRPC). Es wird bei erwachsenen Männern eingesetzt, die bereits eine Antihormon- und eine Chemotherapie erhalten haben.
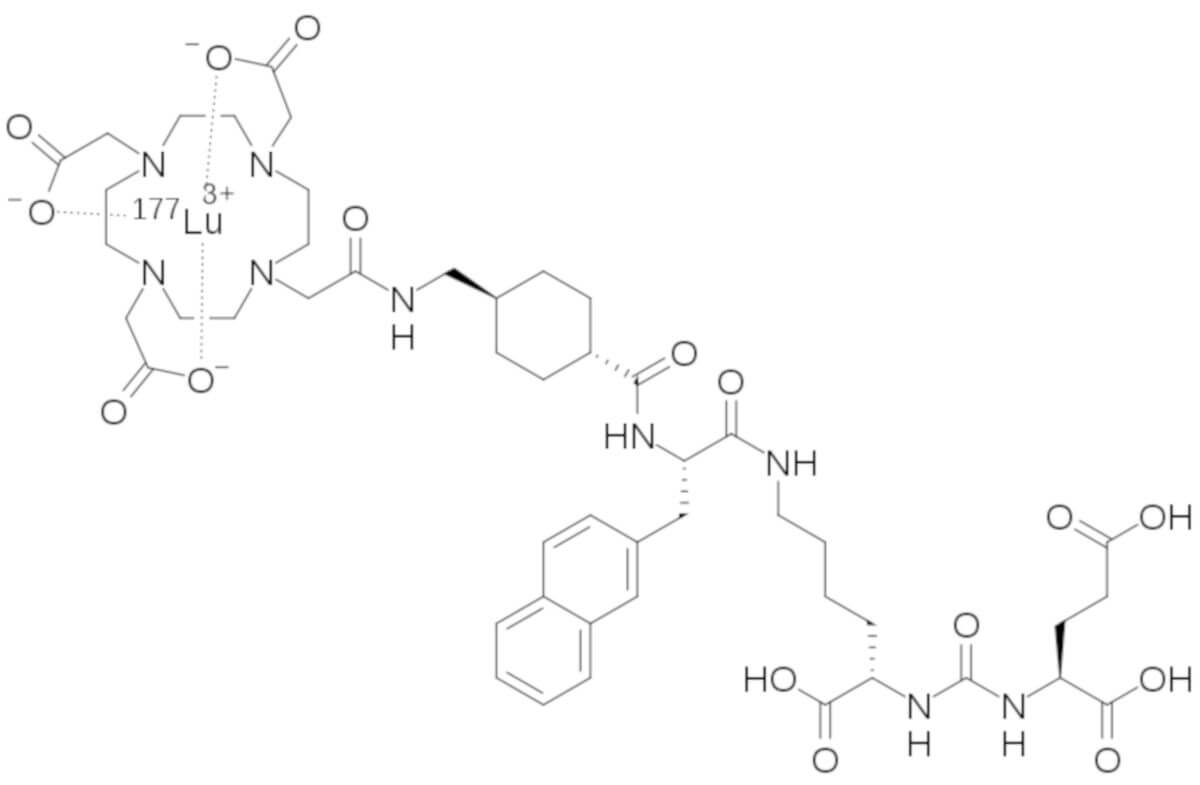
Strukturformel
Chemie
Lutetium (177Lu) Vipivotid-Tetraxetan hat die Summenformel C49H68177LuN9O16 und eine molare Masse von 1216.06 g/mol.
Hintergrund
Das prostataspezifische Membranantigen ist ein Glykoprotein, das in den Zellmembranen von Prostata- und Prostatakrebszellen vorkommt. Bei Prostatakarzinomen, die das Protein exprimieren, kann es daher auch als spezifische pharmakologische Zielstruktur in der Therapie genutzt werden. Das PSMA-positive mCRPC reagiert beispielsweise aufgrund seiner Kastrationsresistenz meist nicht mehr oder nur unzureichend auf eine antihormonelle Therapie. Bei der Anwendung von Lutetium (177Lu) Vipivotid-Tetraxetan handelt es sich entsprechend um eine neue Möglichkeit der zielgerichteten Behandlung dieses Karzinoms.
Wirkmechanismus
Lutetium (177Lu) Vipivotid-Tetraxetan ist ein therapeutischer Radioligand. Das Radionuklid Lutetium-177 wird dabei durch Komplexierung an den Chelatbildner Vipivotid-Tetraxetan gebunden. Andere molekulare Strukturen von Vipivotid-Tetraxetan wiederum können das prostataspezifische Membranantigen (PSMA) auf Prostata- bzw. Prostatakrebszellen binden. Nach der Bindung an die Zielzellen führt die abgegebene radioaktive β-Strahlung zur Schädigung des Tumorgewebes durch Replikationshemmung und Zelltod.
Pharmakokinetik
Der Wirkstoff ist nach Aufnahme zu 60 bis 70 % an Plasmaproteine gebunden. Die Plasmahalbwertszeit liegt bei etwa 41,6 Stunden. Die physikalische Halbwertszeit des Nuklids 177Lu beträgt etwa 6,6 Tage. Lutetium (177Lu) Vipivotid-Tetraxetan wird größtenteils renal eliminiert.
Indikation
Lutetium (177Lu) Vipivotid-Tetraxetan wird bei männlichen Patienten mit metastasiertem PSMA-positivem kastrationsresistentem Prostatakarzinom angewendet, bei denen bereits eine Androgenrezeptor-Signalweg-Hemmung und eine Taxan-basierte Chemotherapie durchgeführt wurde.
Zusammen mit Lutetium (177Lu) Vipivotid-Tetraxetan wurde in den USA der Wirkstoff Gallium (68Ga) Gozetotid zugelassen. Dieser wird als radiopharmazeutisches Injektionspräparat genutzt, um Patienten zu identifizieren, die für eine Therapie mit Lutetium (177Lu) Vipivotid-Tetraxetan geeignet sind. Gallium (68Ga) Gozetotid bindet ebenfalls PSMA-positive Läsionen, die sich anschließend in einer PET-CT lokalisieren lassen.
Anhand weiterer Studien soll ein möglicher Einsatz auch in früheren Stadien der Erkrankung untersucht werden (2023).
Darreichungsform
Lutetium (177Lu) Vipivotid-Tetraxetan wird intravenös verabreicht.
Dosis
Die empfohlene Dosis von Lutetium (177Lu) Vipivotid-Tetraxetan liegt bei 7,4 GBq alle sechs Wochen. Insgesamt werden bis zu sechs Dosen verabreicht. Bei Fortschreiten der Krebserkrankung oder nicht tolerierbaren Nebenwirkungen während der Therapie muss eine Anpassung erfolgen.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Mögliche Nebenwirkungen von Lutetium (177Lu) Vipivotid-Tetraxetan sind z.B.:
Anwendungshinweise
Lutetium (177Lu) Vipivotid-Tetraxetan ist radioaktiv. Eine langfristige Therapie mit dem Wirkstoff kann demnach das Risiko für die Entstehung von Krebs erhöhen. Entsprechend sollten Betroffene über Vorsichtsmaßnahmen aufgeklärt werden, um weitere Strahlungsquellen (beispielweise bei anderen Krebstherapien) zu vermeiden. Weiterhin ist anzuraten, die Trinkmenge v.a. vor und nach der Gabe deutlich zu erhöhen und so oft wie möglich die Blase zu entleeren. Dadurch soll eine Strahlenbelastung der urogenitalen Strukturen reduziert werden.
Folgende enge Kontakte sollten vermieden werden:
- Personen des eigenen Haushalts für mindestens zwei Tage
- Kinder und Schwangere für mindestens sieben Tage
- sexuelle Aktivitäten für mindestens sieben Tage
- getrenntes Schlafen mit Personen des Haushalts für mindestens drei Tage bzw. sieben Tage (Kinder) bzw. 15 Tage (Schwangere)
Aufgrund der möglichen Nebenwirkung einer gravierenden Myelosuppression oder Nephrotoxizität sollten vor und während der Therapie regelmäßige Blutbild- und Nierenwertkontrollen erfolgen, um die Therapie im Ernstfall entsprechend anzupassen oder abzusetzen. Patienten sind über mögliche Symptome und eine sofortige Vorstellung bei einem Arzt aufzuklären. Außerdem sollten Patienten auf eine potenzielle Embryotoxizität sowie die mögliche Entstehung von temporärer bzw. permanenter Infertilität hingewiesen werden. Bis mindestens 14 Tage nach der Therapie mit Lutetium (177Lu) Vipivotid-Tetraxetan sollte effektiv verhütet werden.
Wechselwirkungen
Bisher wurden keine spezifischen Wechselwirkungen von Lutetium (177Lu) Vipivotid-Tetraxetan mit anderen Arzneimitteln festgestellt.
Zulassung
Lutetium (177Lu) Vipivotid-Tetraxetan ist seit März 2022 in den USA zugelassen. Im Dezember 2022 erfolgte die Zulassung in Europa durch die EMA.
Nutzenbewertung
Für Patienten, welche die Standardtherapie und zusätzlich Lutetium (177Lu) Vipivotid-Tetraxetan erhalten haben, zeigte sich ein verbessertes Gesamtüberleben.
Kosten
Die Kosten für eine Dosis von Lutetium (177Lu) Vipivotid-Tetraxetan liegen derzeit bei etwa 42.500 USD. Eine Behandlung mit sechs Zyklen kostet demnach etwa 255.000 USD.
Literatur
- FDA, Highlights of prescribing information, abgerufen am 19.10.2022
- FDA, FDA D.I.S.C.O.: Burst Edition: FDA approval of Pluvicto (lutetium Lu 177 vipivotide tetraxetan) for the treatment of adult patients with prostate-specific membrane antigen-positive metastatic castration-resistant prostate cancer who have been treated with androgen receptor pathway inhibition and taxane-based chemotherapy, abgerufen am 19.10.2022
- FDA, FDA approves Pluvicto for metastatic castration-resistant prostate cancer, abgerufen am 19.10.2022
- Novartis, Novartis Pluvicto™ approved by FDA as first targeted radioligand therapy for treatment of progressive, PSMA positive metastatic castration-resistant prostate cancer, abgerufen am 19.10.2022
- Novartis, targeted treatment for men with PSMA+ mCRPC, abgerufen am 19.10.2022
- Uroforum: Metastasierter Prostatakrebs: Pluvicto® auch in Europa zugelassen, abgerufen am 07.03.2023
Weblinks
- Drugbank - Lutetium Lu-177 vipivotide tetraxetan, abgerufen am 14.07.2024
- Pharmazeutische Zeitung Arzneistoffe - (177Lu)Lutetiumvipivotidtetraxetan, abgerufen am 14.07.2024
- Gelbe Liste Wirkstoffe - (177Lu)Lutetium vipivotid tetraxetan, abgerufen am 14.07.2024
- PubChem: 483928677