Morbus Crohn
nach Antoni Leśniowski (1867 bis 1940), polnischer Urologe und Burrill Bernhard Crohn (1884 bis 1983), amerikanischer Gastroenterologe
Synonyme: Enteritis regionalis, Enterocolitis regionalis, Ileitis terminalis, sklerosierende chronische Enteritis, Morbus Leśniowski-Crohn, Crohn-Ginsburg-Oppenheimer-Krankheit
Englisch: Crohn's disease, regional enteritis
Definition
Der Morbus Crohn ist eine chronisch-entzündliche Darmerkrankung (CED), die bevorzugt das Ileum und das Colon befällt, seltener den Ösophagus und den Mund. Charakterisierend für Morbus Crohn ist der diskontinuierliche, transmurale und segmentale Befall (sog. "skip lesions") der Darmschleimhaut.
Epidemiologie
Die Inzidenz des Morbus Crohn liegt bei etwa 2 bis 3 auf 100.000 Einwohner. Die Prävalenz beträgt etwa 250 bis 500 auf 100.000. In den letzten Jahren hat die Anzahl der Erkrankungen deutlich zugenommen. Die Krankheit tritt geschlechtsunspezifisch auf. Betroffen sind vor allem junge Erwachsene zwischen dem 15. und 35. Lebensjahr.
Ätiologie
Die Entstehung des Morbus Crohn ist bis heute (2024) nicht eindeutig verstanden. Eine Reihe von Entstehungsmechanismen werden in der Fachliteratur angenommen und untersucht. Generell lässt sich eine familiäre Häufung beobachten, sodass eine genetische Disposition anzunehmen ist.
Neuere Theorien gehen von einer komplexen Barriereerkrankung aus. Die Darmschleimhaut bildet mit der ihr aufgelagerten Schleimschicht, die antimikrobielle Peptide (Defensine) enthält, eine funktionelle Einheit. Bei Morbus Crohn scheint die gestörte Defensinbildung eine zentrale Rolle zu spielen. Sie führt zusammen mit anderen Faktoren zu einer reduzierten antimikrobiellen Abwehr und zu einer Veränderung des Mikrobioms. Die eindringenden Bakterien induzieren dann eine lokale Entzündung, die zu einer entgleisten Immunreaktion führen kann.
Dabei spielen wahrscheinlich auch autoimmunologische Prozesse eine Rolle. Bei einigen Patienten lassen sich Antikörper gegen die RNA bestimmter Zellen des Colons nachweisen. Auch das gute Ansprechen von Corticoiden und Besserung unter Nahrungskarenz sprechen für einen immunologischen Prozess.
Eine weitere Hypothese macht bestimmte Mikroorganismen bzw. das darmeigene Mikrobiom für die Entstehung der Erkrankung verantwortlich. In einigen Studien wurde Mycobacterium avium subspecies paratuberculosis (MAP) als möglicher Auslöser des Morbus Crohn vorgeschlagen, der eine ähnliche Erkrankung, die Paratuberkulose, bei Rindern hervorruft.
Ernährungsgewohnheiten (beispielsweise Süßigkeiten), Zigarettenrauch und orale Kontrazeptiva (Anti-Baby-Pille) scheinen das Erkrankungsrisiko zu erhöhen. Für das immer wieder vermutete infektiöse Geschehen durch einen Befall mit Rotaviren, Mykobakterien oder Pseudomonasstämmen sind bis jetzt keine ausreichenden Anhaltspunkte gefunden worden.
Auch psychosomatische Faktoren werden immer wieder diskutiert. Man hat versucht, Zusammenhänge zu psychischen Erkrankungen (beispielsweise Depressionen) herzustellen.
Genetik
Etwa die Hälfte der Crohn-Patienten tragen zumindest auf einem Allel des NOD2-Gens (auch CARD15, Chromosom 16) eine Loss-of-Function-Mutation. Dieses Gen codiert für einen zytosolischen Pattern-Recognition-Rezeptor für das bakterielle Zellwand-Spaltprodukt Muramyldipeptid. Der Mechanismus der Crohn-Prädisposition ist unklar, es wird eine kompensatorische Überaktivierung anderer immunologischer Mechanismen angenommen.
Drei häufig assoziierte Mutationen wurden bisher beschrieben:[1]
Das Risiko an Morbus Crohn zu erkranken, ist bei homozygoten Patienten stark (hundertfach), bei heterozygoten auf über das Doppelte erhöht. Die Mehrzahl der Mutationsträger leidet jedoch nicht an einer CED.
Pathologie
Eine pathologische Untersuchung, vor allem nach Biopsie von Mucosa aus dem Ileum- oder Colonbereich, ergibt im Regelfall die endgültige Diagnose. Die gängigen pathologischen Veränderungen finden sich im Folgenden:
- Makroskopische Veränderungen:
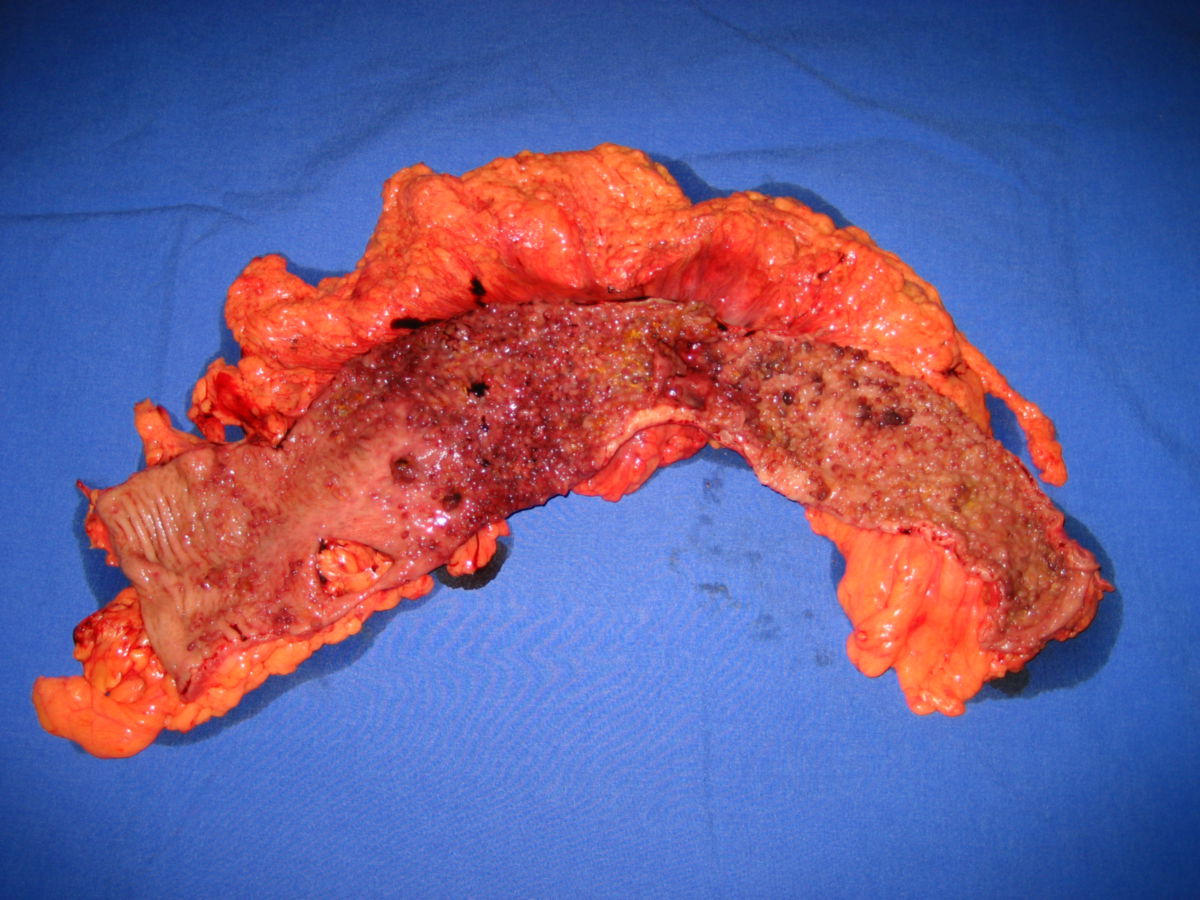
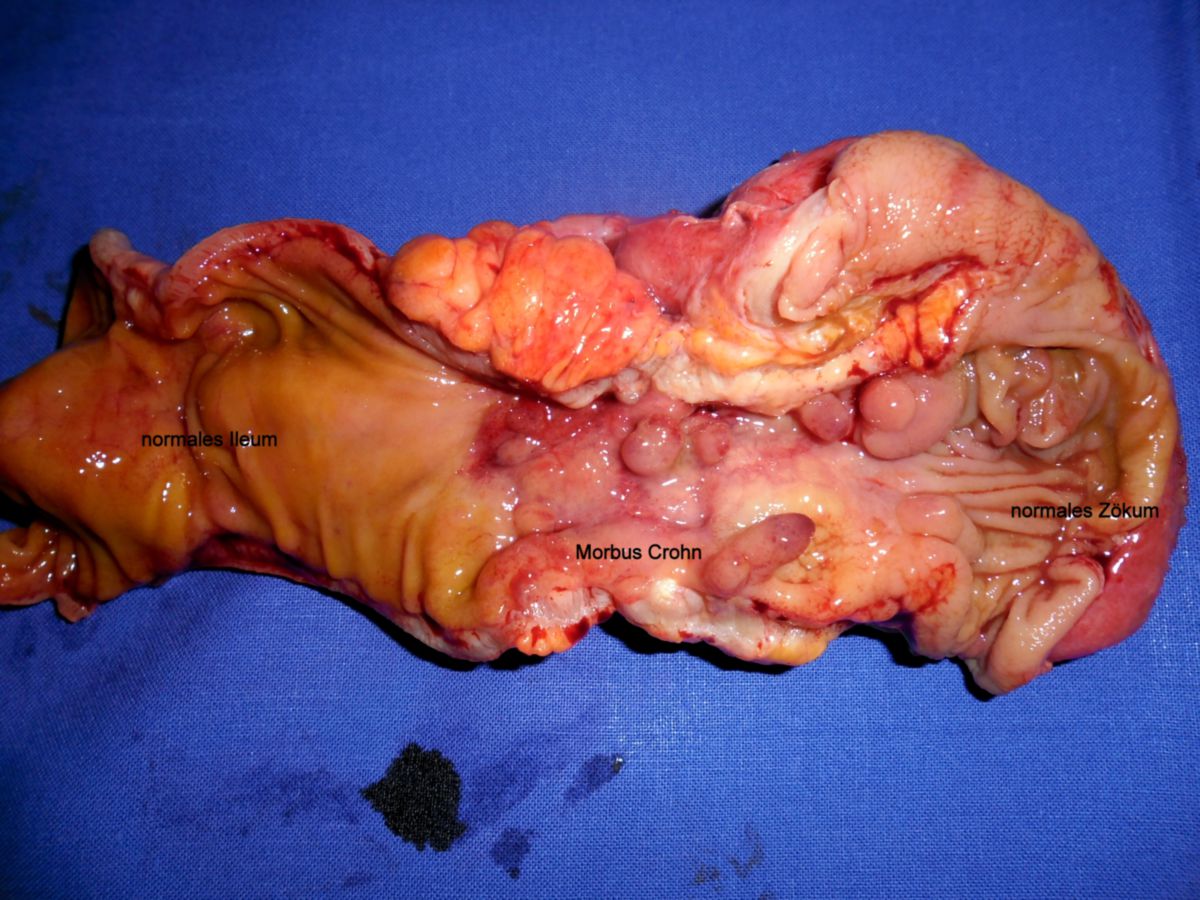
- Gartenschlauchphänomen: Durch Fibrosierung verursachte Segmentstenosen
- Pflastersteinphänomen (Pflasterstein-Relief): Abschnitte entzündeter Schleimhaut wechseln sich mit tiefen Ulzerationen ab, wodurch ein pflastersteinartiges Aussehen entsteht.
- Entzündlicher Konglomerattumor: Verschiedene Darmabschnitte verkleben miteinander.
- Vergrößerung benachbarter Lymphknoten
- Histologische Veränderungen:
- Massive Invasion der Darmwand durch Lymphozyten, (eosinophile) Granulozyten und Histiozyten, Hyperplasie der zugehörigen Lymphknoten in etwa 70 % der Fälle.
- Bildung von nicht-verkäsenden Granulomen (Epitheloidzellgranulome und Mikrogranulome), sowie mehrkernige Riesenzellen in etwa 40 % der Fälle.
Symptomatik
Der Morbus Crohn beginnt meistens beim jungen Erwachsenen mit unspezifischen Symptomen. Dazu gehören Müdigkeit, Gewichtsverlust, Schmerzen im rechten Unterbauch und (meist unblutige) Durchfälle. Daneben können Fieber, Anorexie, Übelkeit und Erbrechen auftreten.
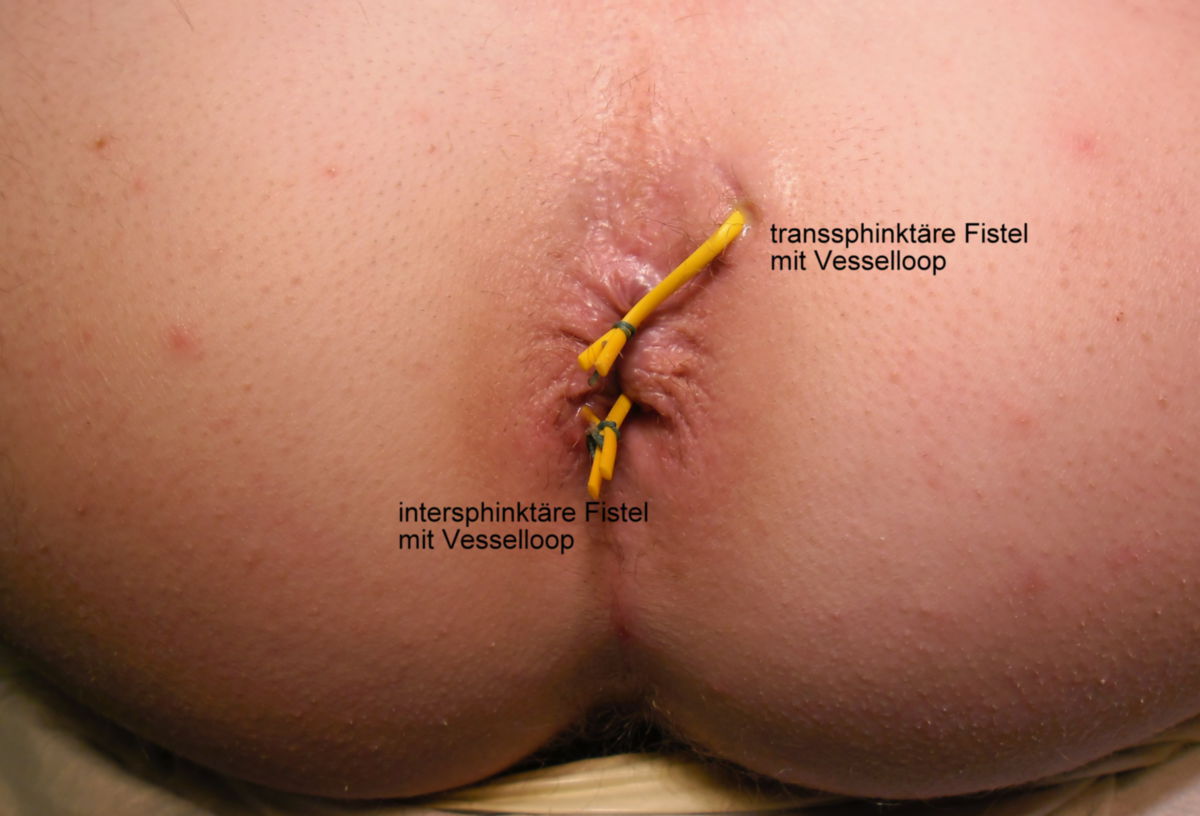
Weiter können Analfissuren, Fisteln und extraintestinale Manifestationen auftreten. Darunter auch schmerzhafte Ulzera und Aphthen in der Mundhöhle.
Extraintestinale Manifestationen
- Haut/Schleimhaut: Erythema nodosum, Pyoderma gangraenosum, endogenes Ekzem, Acrodermatitis enteropathica, Aphthen
- Gelenke: Arthritis, Sakroiliitis, ankylosierende Spondylitis
- Augen: Uveitis, Keratitis, Episkleritis
- Lunge, Atemwege: insbesondere Bronchiektasen, seltener z.B. Bronchiolitis, organisierende Pneumonie, Pleuraergüsse oder opportunistische Infektionen
- Gefäße: Vaskulitis, Thrombosen, Thromboembolien
- Niere: Glomerulonephritis, Nephrolithiasis
- Leber und Gallenwege: Fettleber, Leberabszess, primär-sklerosierende Cholangitis (bei ca. 5 % der Colitis-ulcerosa-Patienten)
- Amyloidose
siehe auch: Pulmonale Manifestationen bei CED
Komplikationen
Aufgrund der chronischen oder intermittierenden Entzündungen in Abschnitten des Magen-Darm-Traktes, kann es zu einer Reihe von Komplikationen kommen:
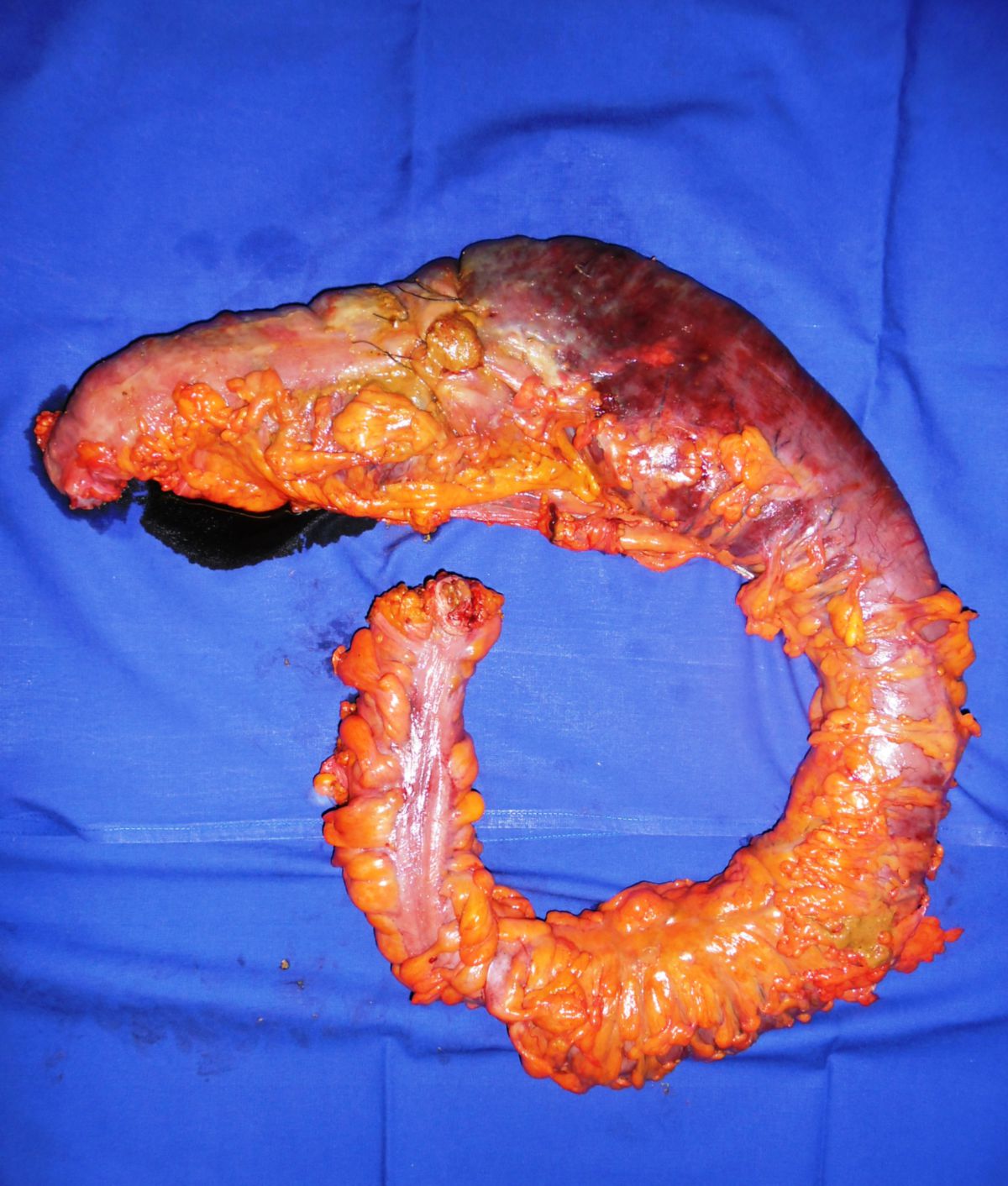
- Mechanischer Ileus: Verschlüsse von Darmabschnitten können anfangs häufig durch Einengung des betroffenen Darmsegmentes während des entzündlichen Prozesses bedingt sein. In späteren Stadien werden diese durch fibröse Strukturen verursacht. Die Häufigkeit eines Ileus wird mit etwa 20 % bis 30 % aller Patienten angegeben.
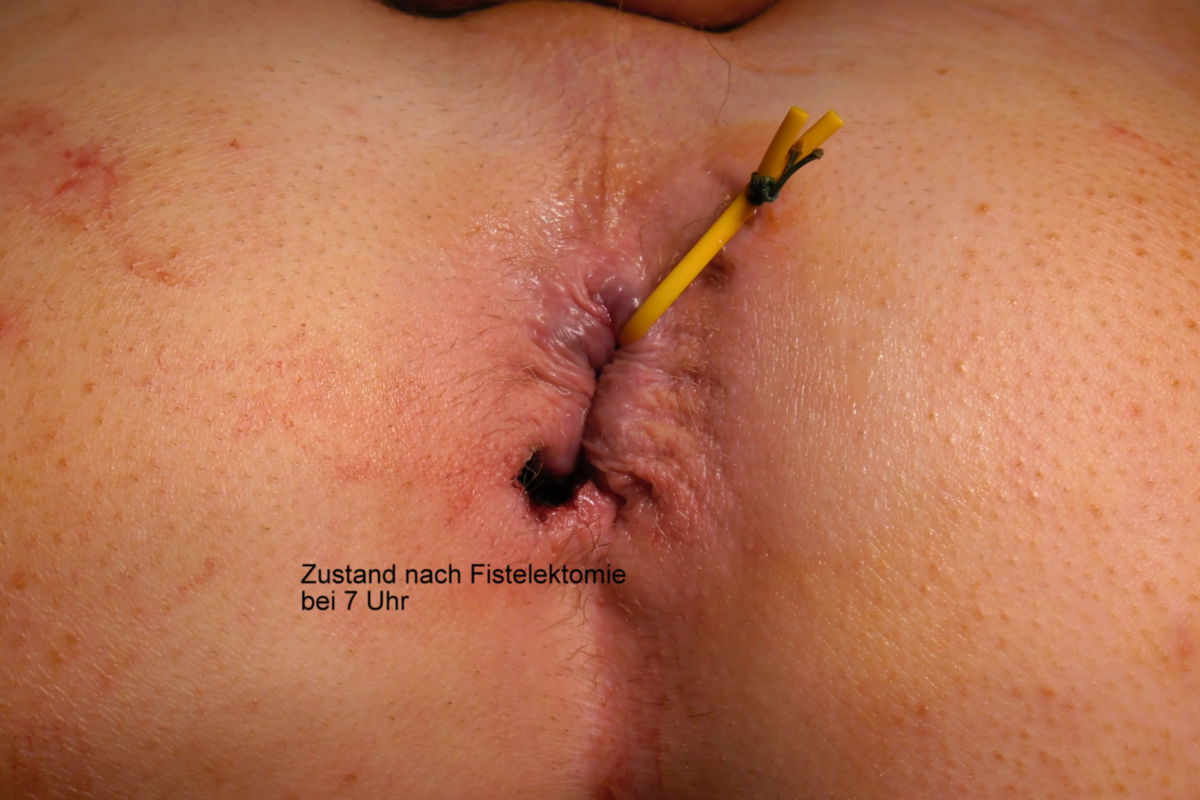
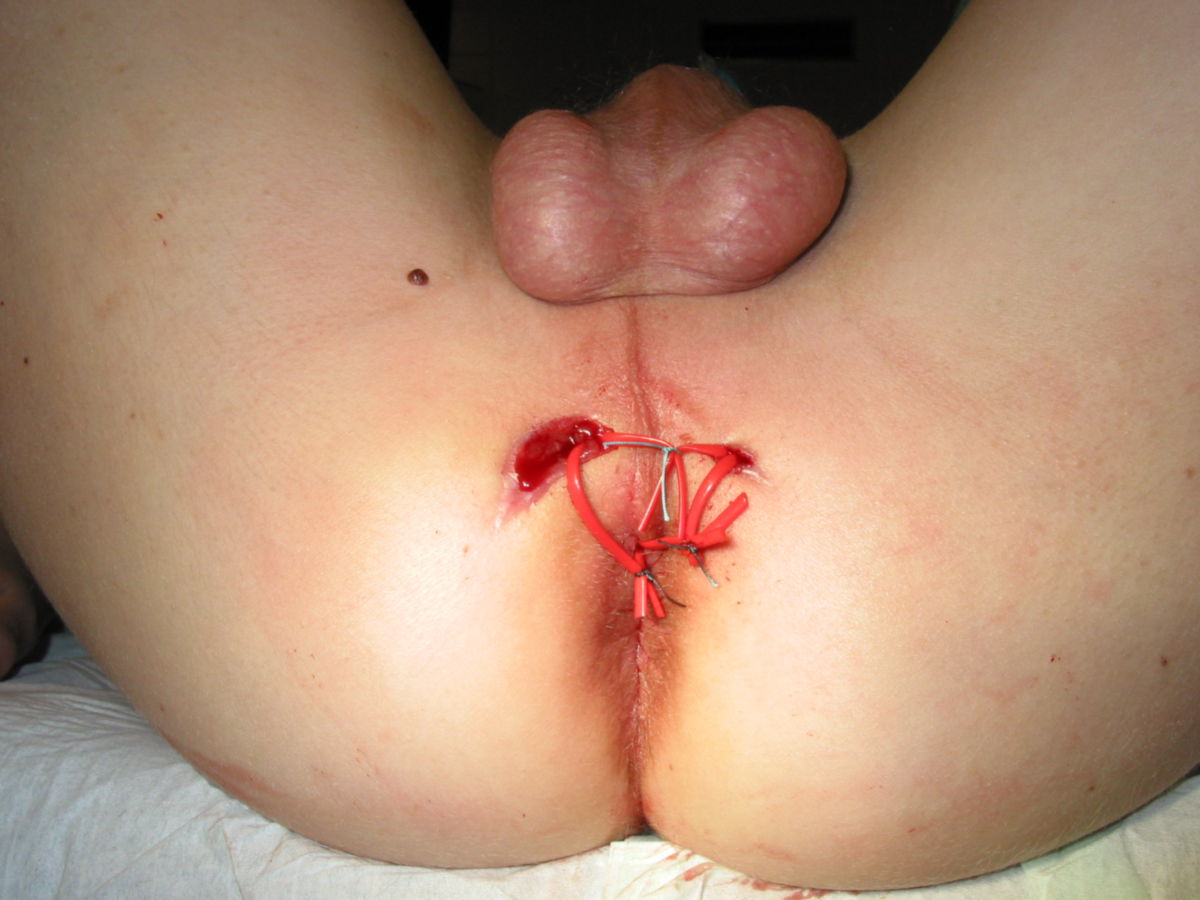
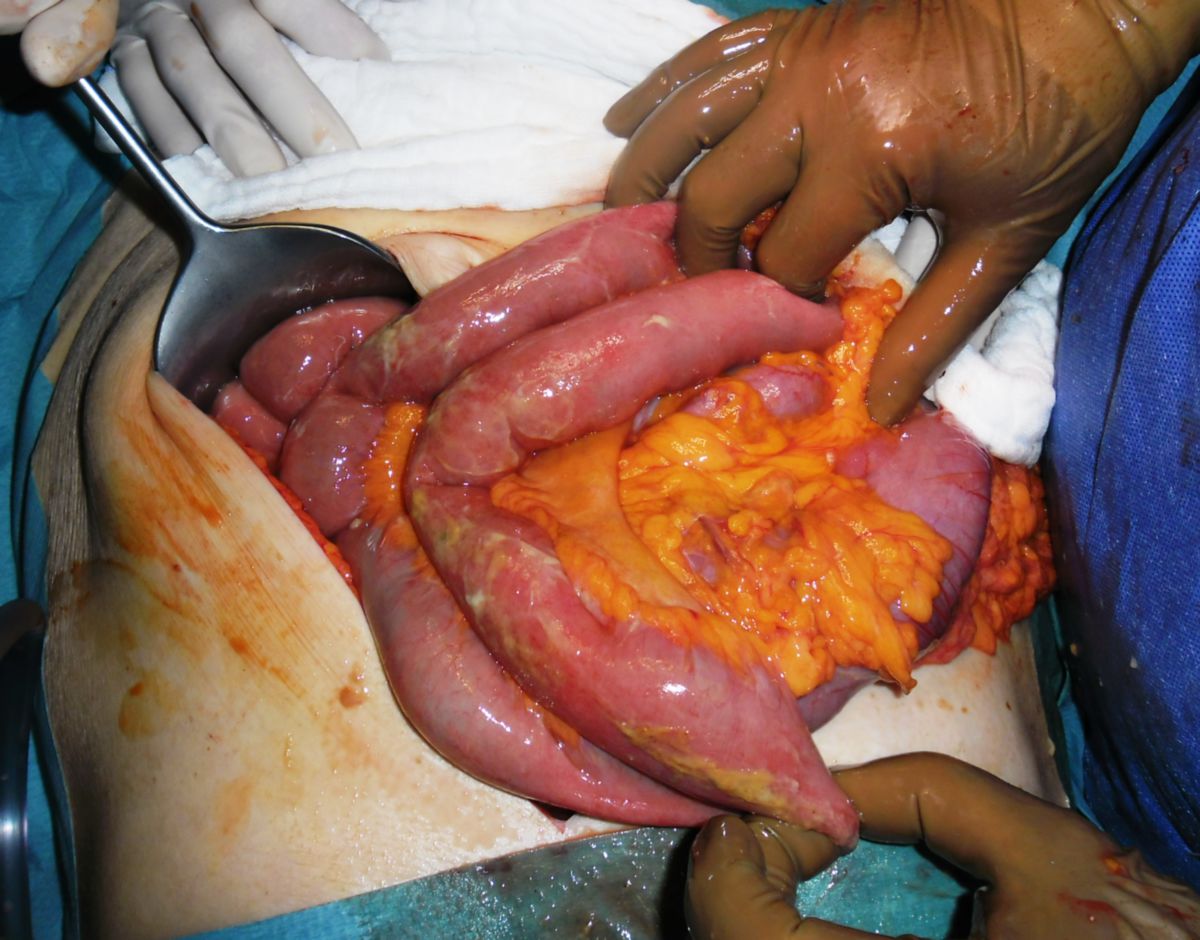
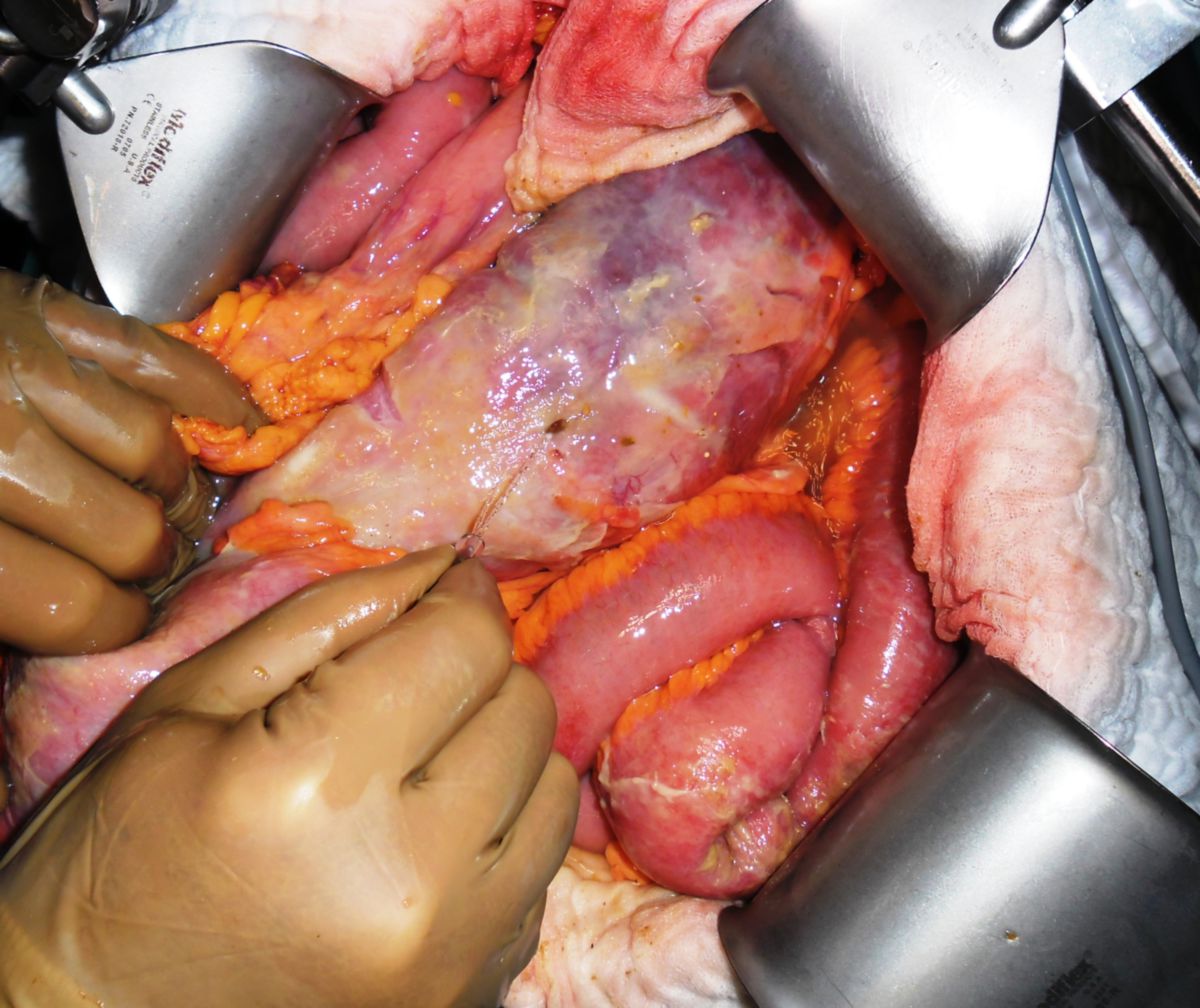
- Fisteln: Fisteln treten im chronischen Verlauf recht häufig auf, und können verschiedene Räume verbinden: kutan, enteroenteritisch, enterovesikal, enterovaginal, peranal, rektal. Seltener hingegen sind Fisteln in der freien Bauchhöhle, da die Umgebung des Darms meist stark verwachsen ist.
- Abszesse: intra- und retroperitoneale Abszesse treten auf.
- Intestinale Blutungen
- Toxisches Megakolon: Dieses vor allem bei Colitis ulcerosa auftretende Symptom wird gelegentlich auch beim Morbus Crohn beschrieben.
- Karzinome: Vor allem für Dünndarmkarzinome besteht eine erhöhte Disposition.
- Megaloblastäre Anämie durch Malabsorption von Vitamin B12 im terminalen Ileum
Diagnostik
Endoskopie
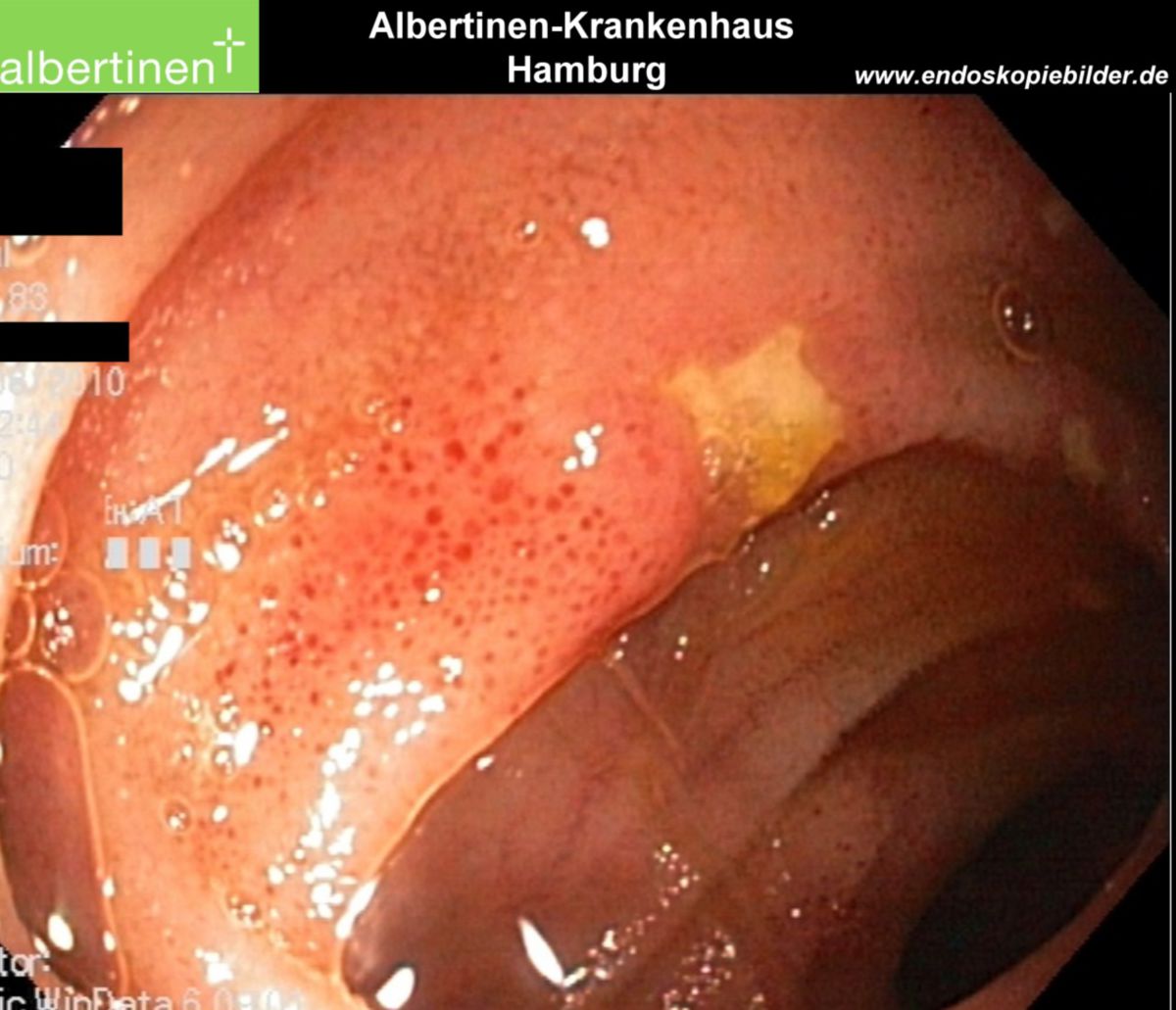
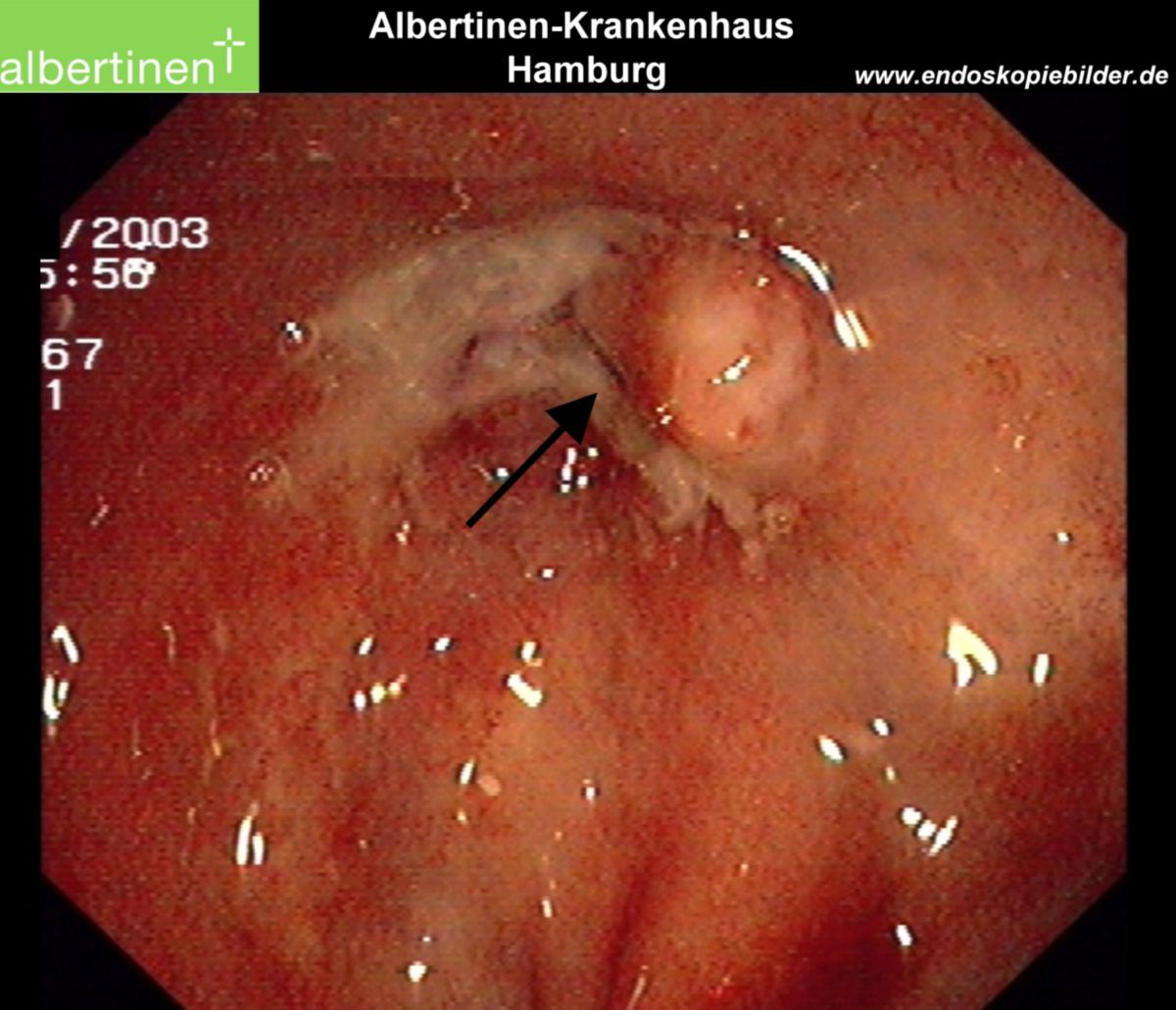
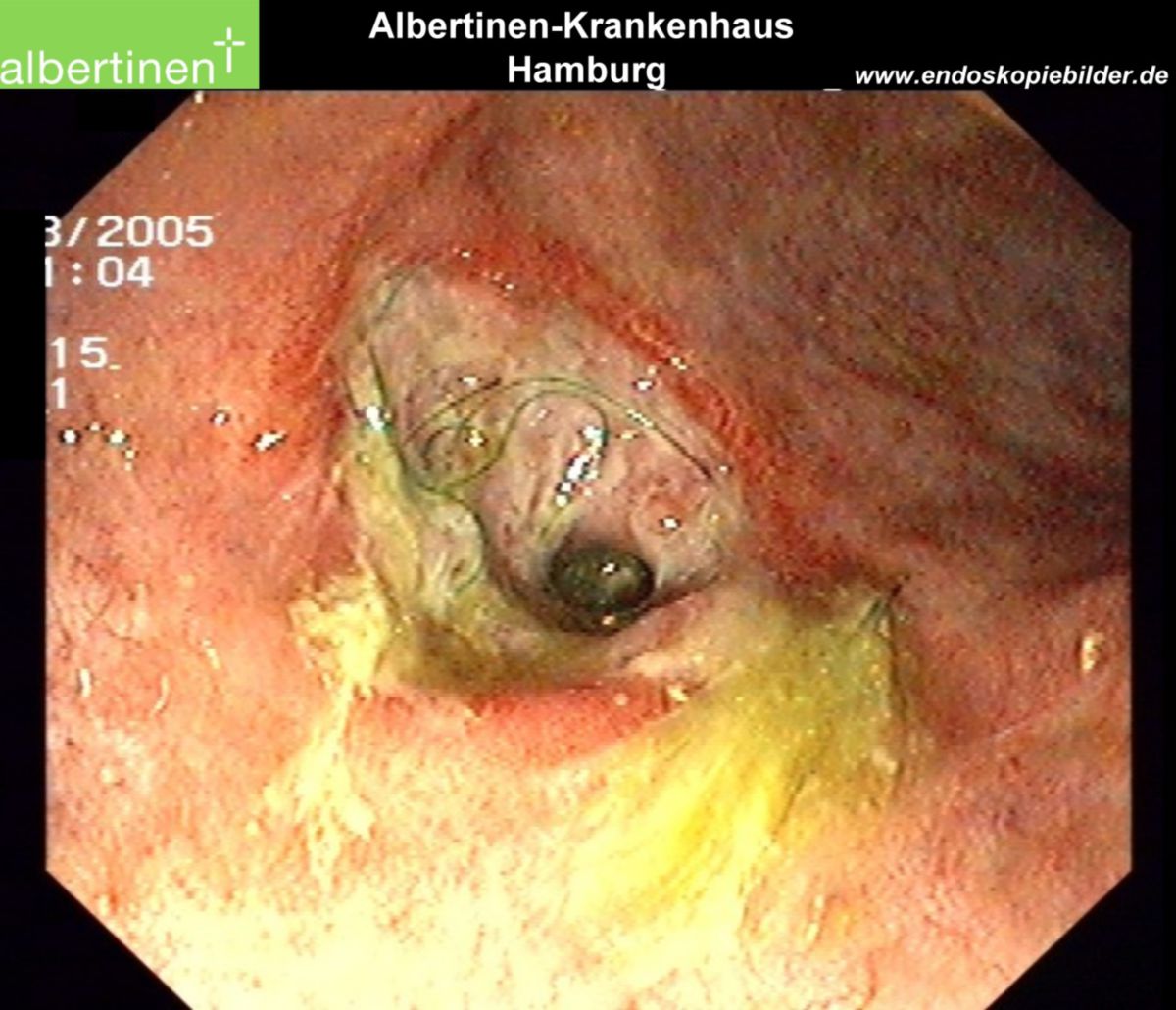
Es erfolgt eine Koloskopie mit Biopsieentnahme. Im endoskopischen Bild von Colon und Ileum lassen sich bereits im Frühstadium Schleimhautläsionen und fleckige Rötungen erkennen. Während eines aktiven Schubs finden sich Ulzerationen, Fissuren sowie Fisteln. Stenosen sind dabei eher eine Spätfolge. Die bei der Koloskopie entnommene Biopsie lässt sich pathologisch analysieren. Ergänzend kann auch eine Kapselendoskopie des Dünndarmes wertvolle Informationen zu Diagnostik und Verlaufskontrolle des Morbus Crohn liefern.
Labor
Beim Morbus Crohn sind typischerweise die Entzündungsparameter (BSG und CRP) erhöht, Malabsorptionszeichen bedingen in manchen Fällen auch die Veränderungen anderer Parameter. Üblicherweise findet sich im Differentialblutbild eine Leukozytose. Zudem können folgende Antikörpertests positiv ausfallen:
- Becherzell-Antikörper (BAK)
- Anti-Saccharomyces-cerevisiae-Antikörper (ASCA)
- Pankreas-Azinus-Antikörper (PAK)
Pankreas-Azinus-Antikörper treten fast nur im Rahmen eines Morbus Crohn auf und sind daher nahezu pathognomonisch.
Bildgebung
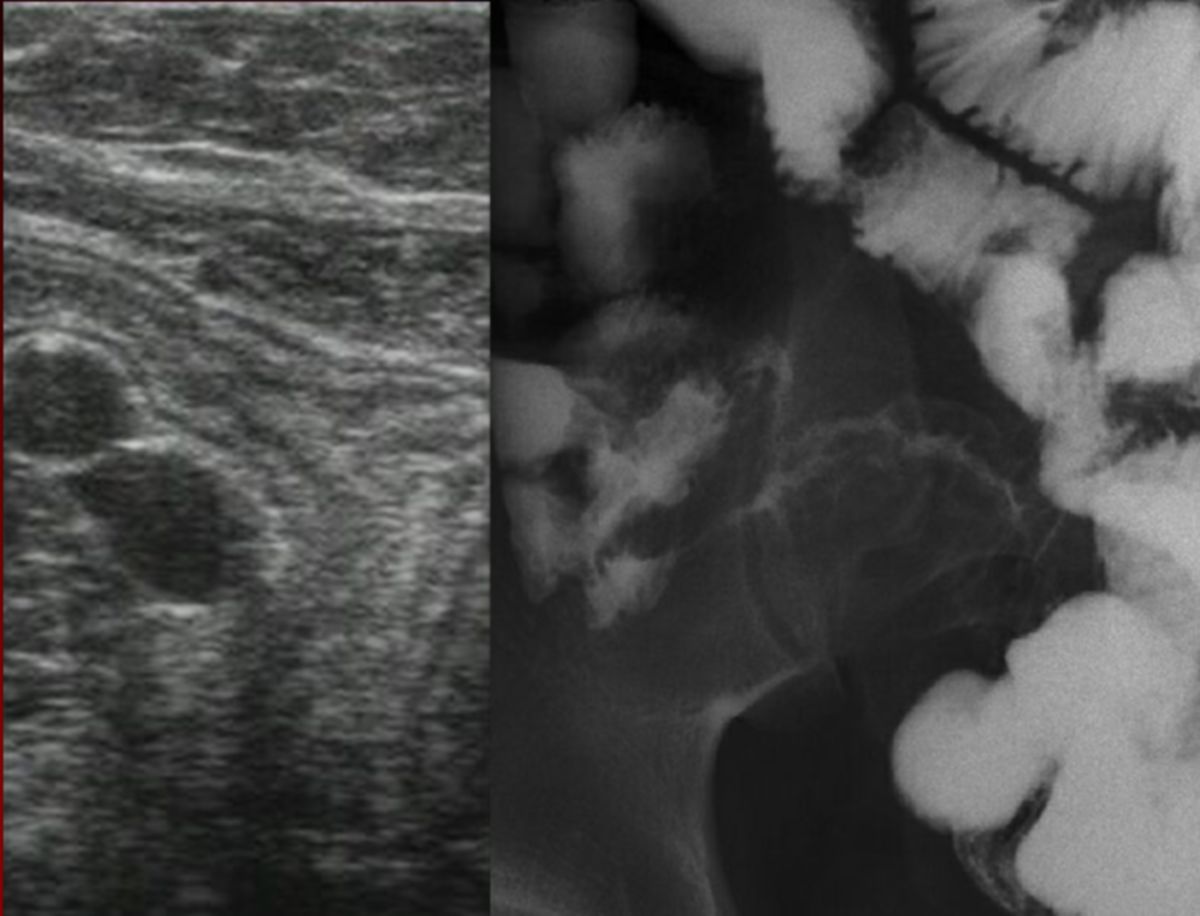
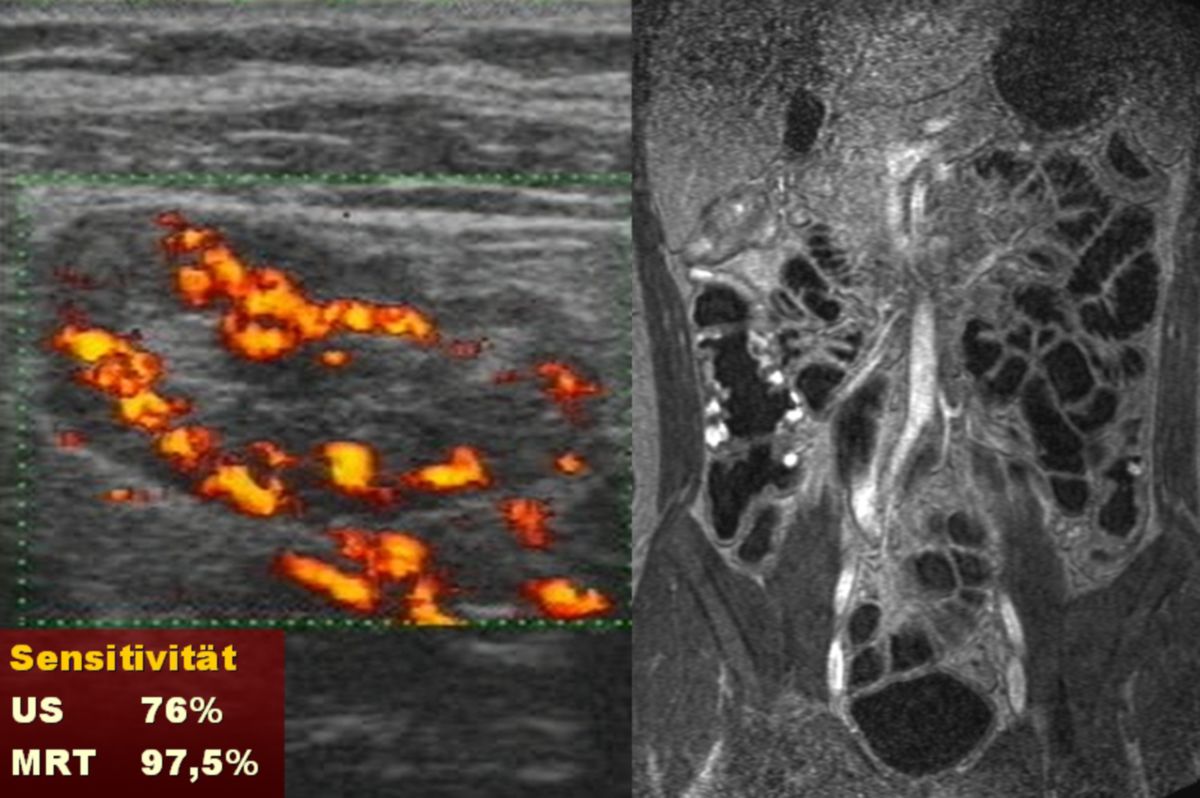
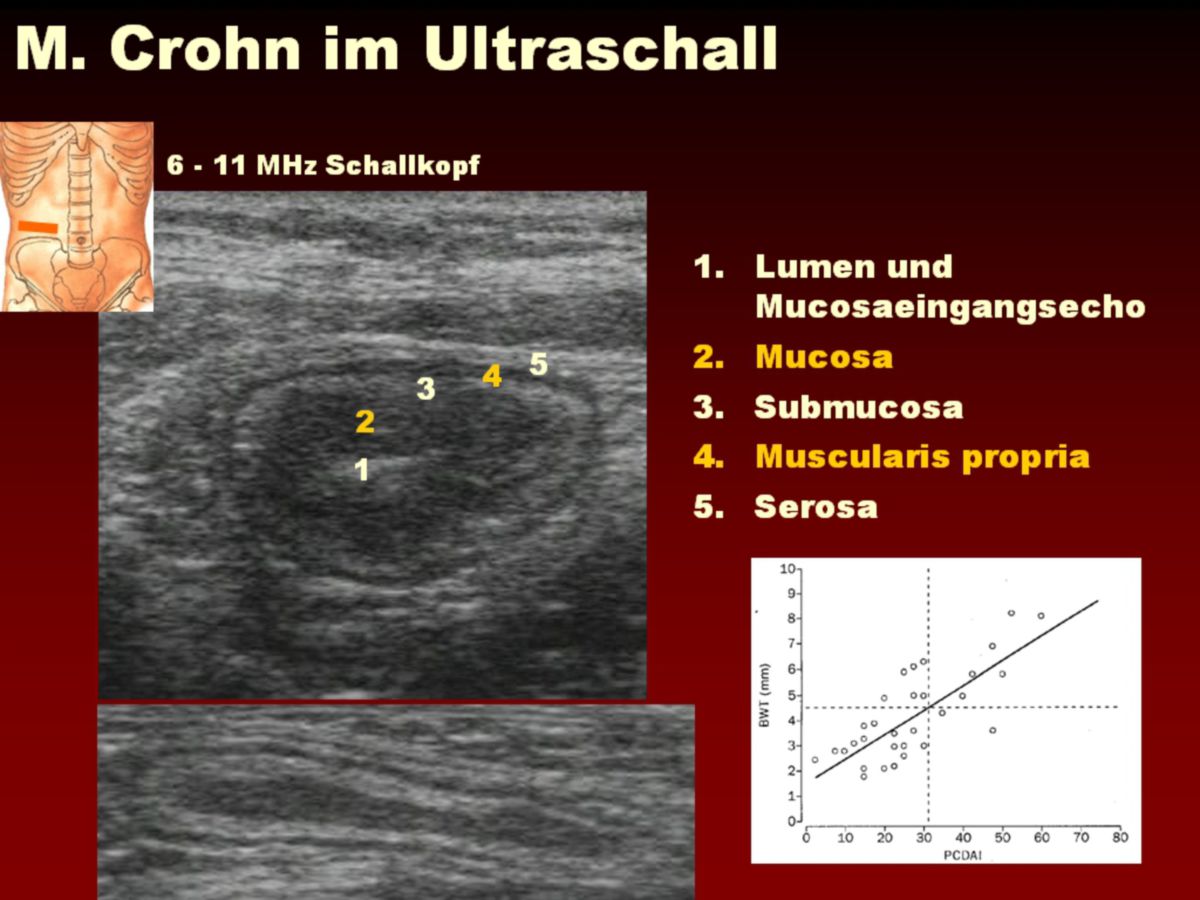
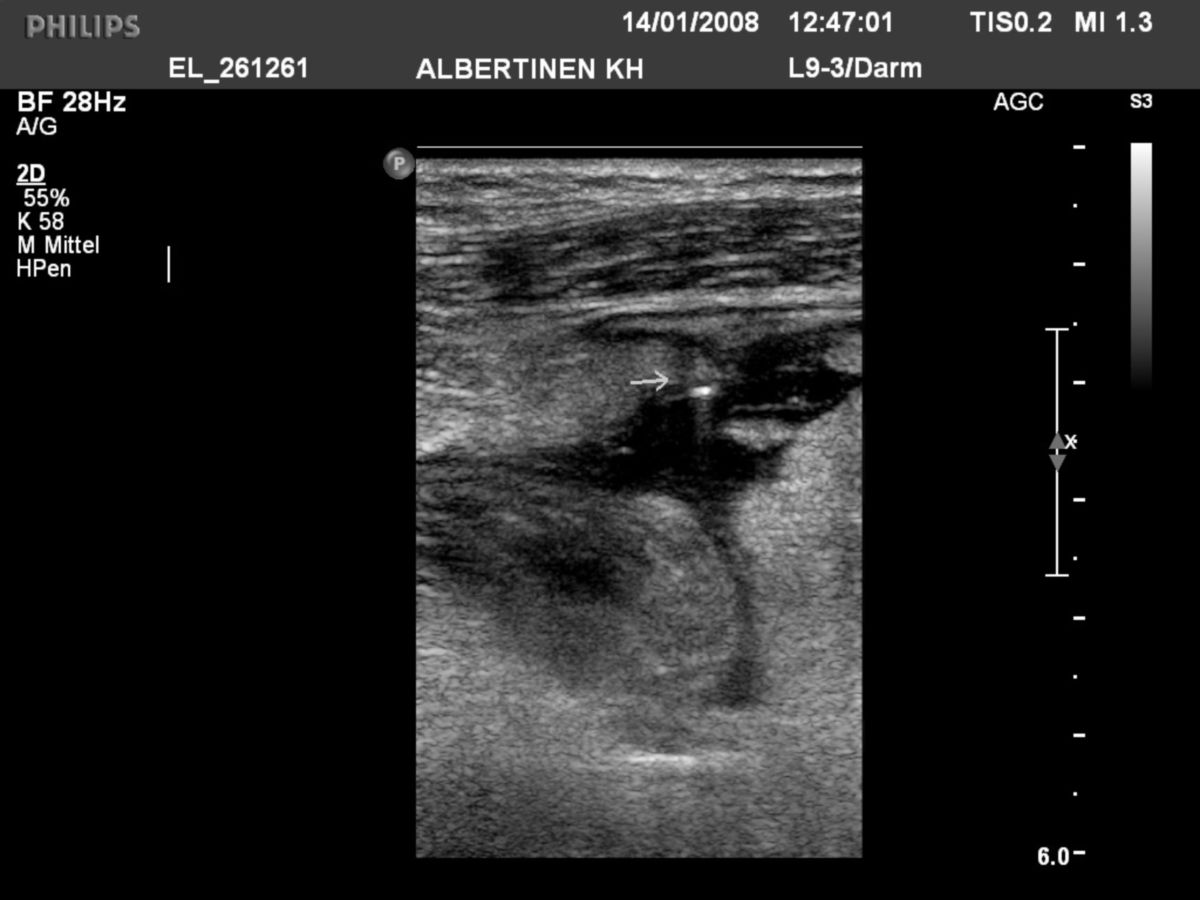
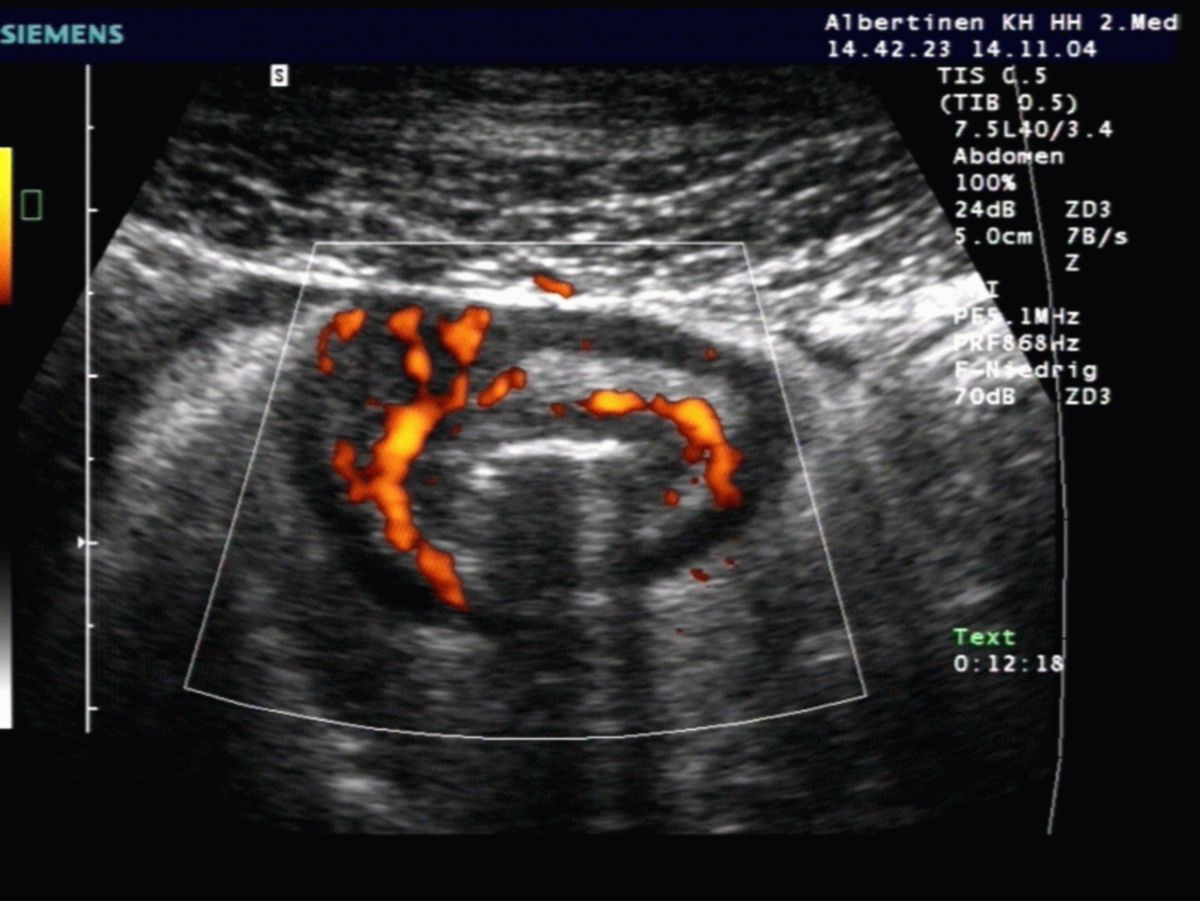
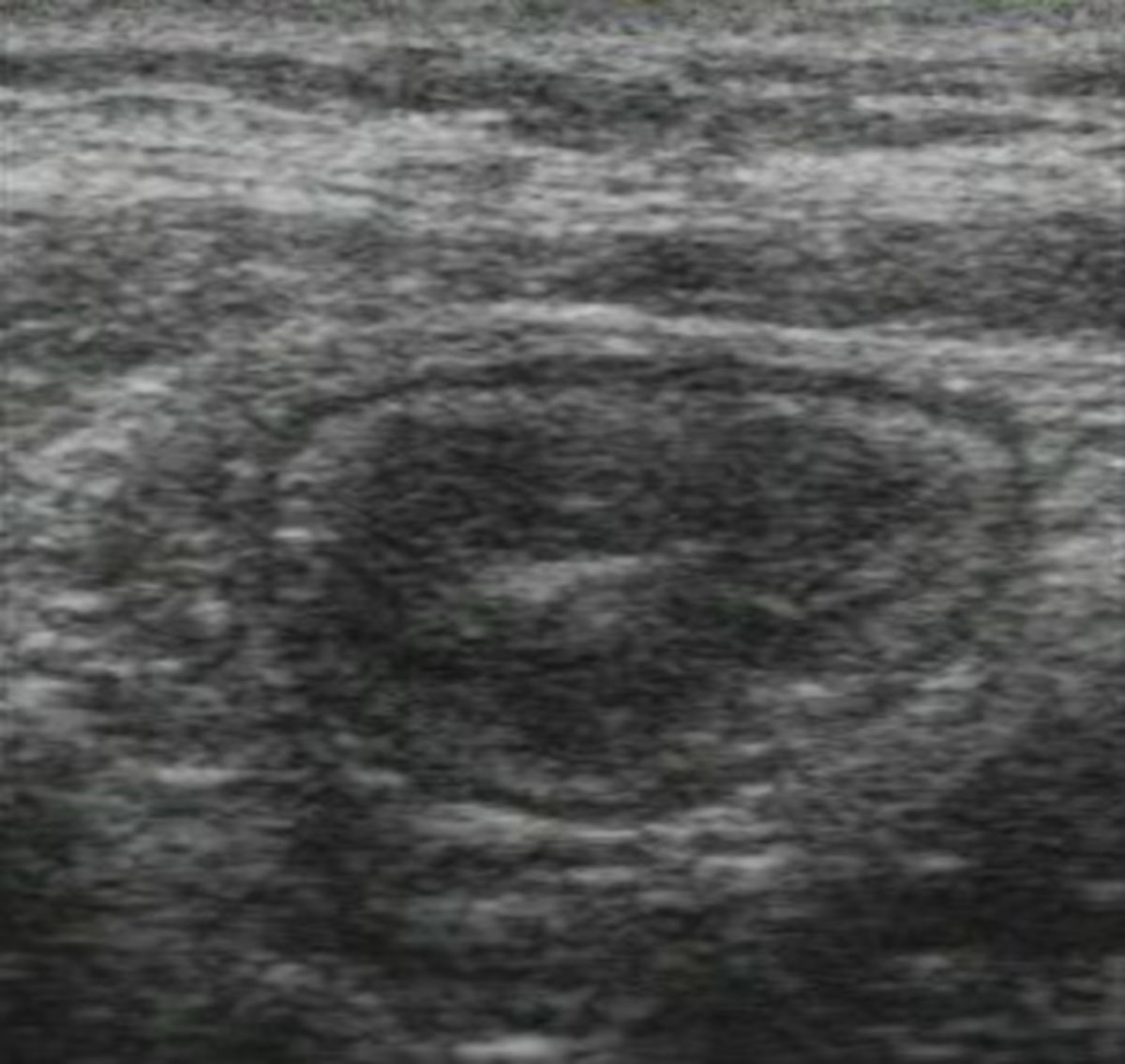
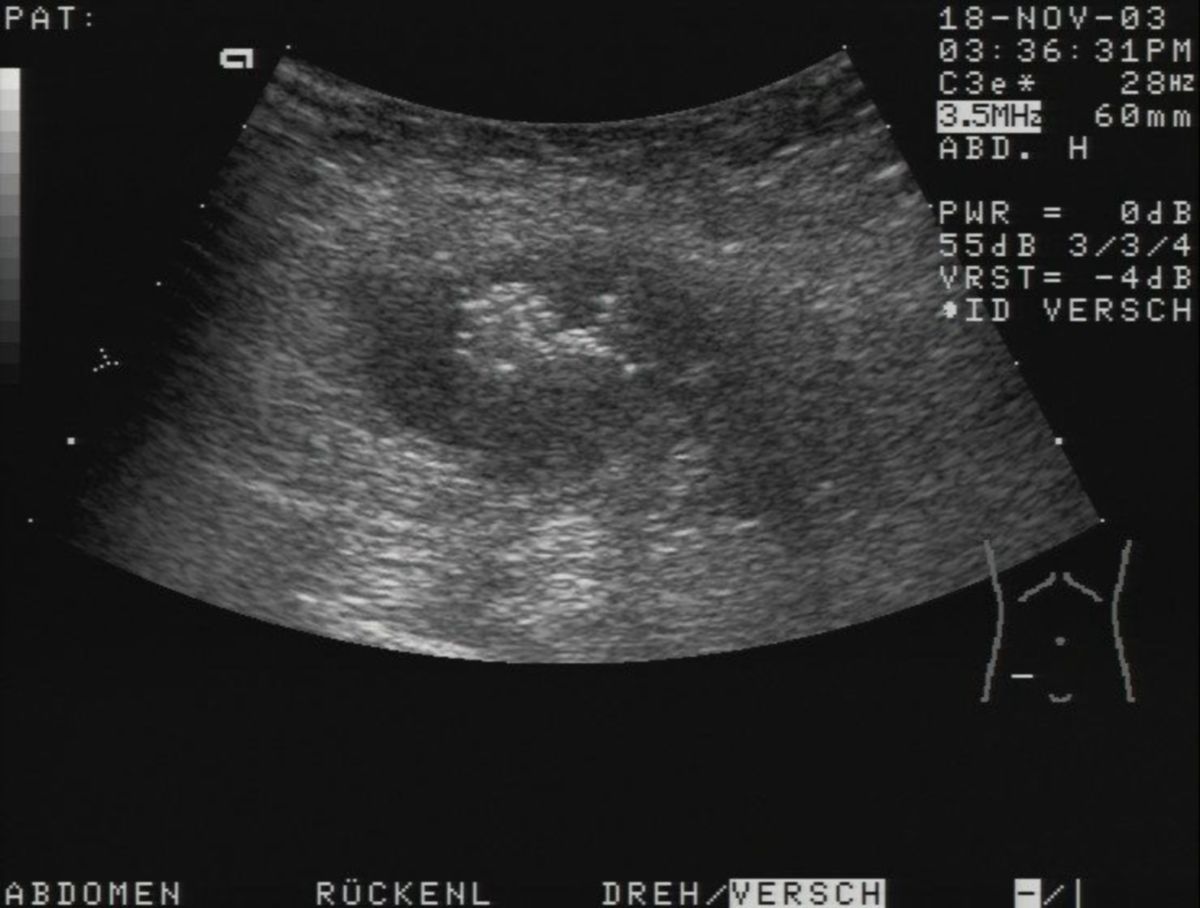
- Abdomensonographie: Die im Ultraschall erkennbare segmentale Verdickung von Abschnitten der Darmmukosa ist für Morbus Crohn charakteristisch.
- Röntgenuntersuchung nach Sellink: In der mit Kontrastmittel durchgeführten Röntgenuntersuchung imponiert besonders ein sogenanntes "Pflastersteinrelief". Gelegentlich lassen sich Fisteln und segmentale Stenosen erkennen.
Differentialdiagnostik
Da die Symptomatik des Morbus Crohn besonders zu Beginn der Erkrankung unspezifisch ist, ist eine umfassende Differentialdiagnose unumgänglich. Dabei muss besonders an die folgenden Erkrankungen gedacht werden.
- Appendizitis
- Divertikulitis
- Yersiniose
- Darmtuberkulose
- Colitis ulcerosa
- Idiopathische myointimale Hyperplasie mesenterialer Venen (IMHMV)
Differentialdiagnose Colitis ulcerosa vs. Morbus Crohn
Bei 10 % der Betroffenen ist eine sichere Differenzierung nicht möglich ("indeterminierte Colitis") oder die anfängliche Diagnose muss später revidiert werden ("Konversionsfälle").
| Colitis ulcerosa | M. Crohn | |
|---|---|---|
| Lokalisation | Kolon | Gesamter Verdauungstrakt |
| Rektumbeteiligung | Immer | 20 % |
| Ileumbeteiligung | Selten ("backwash ileitis") | bis 80 % |
| Ausbreitung | Retikulär-kontinuierlich, von distal (Rektum) nach proximal | Diskontinuierlich von proximal (terminales Ileum) nach distal (Kolon) |
| Niveau | Schleimhaut | Transmural |
| Klinik | Blutig-schleimige Durchfälle | Abdominalschmerzen und Durchfälle meist ohne Blut, evtl. tastbare Resistenz im rechten Unterbauch |
| Extraintestinale Symptome | Selten | Häufig |
| Typische Komplikationen | Toxisches Megakolon, Blutungen | Fisteln, Fissuren, Abszesse, Stenosen, Konglomerattumoren |
| Röntgen | Zähnelung, Pseudopolyposis, Haustren-Schwund → langes glattes Rohr ("Fahrradschlauch") | Fissuren, Pflastersteinrelief, segmentäre kurze Darmstenosen |
| Endoskopie | Diffuse Rötung, Vulnerabilität, Kontaktblutung, unscharf begrenzte Ulzerationen, Pseudopolypen | Aphthöse Läsionen, scharf begrenzte landkartenartige Ulzerationen mit "snail tracks", Stenosen, Fisteln, Pflastersteinrelief |
| Histologie | Mukosa, Submukosa: Kryptenabszesse, Becherzellverlust Spätstadium: Schleimhautatrophie, Epitheldysplasien |
Gesamte Darmwand und mesenteriale Lymphknoten: Epitheloidzellgranulome (40 %) Spätstadium: Fibrose |
Stadieneinteilung
Um den Morbus Crohn in aktive und chronische Stadien einzuteilen, benutzt man den sogenannten Crohn's Disease Acivity Index (CDAI) nach Best, bei dem für bestimmte Kriterien Punkte vergeben werden. Ist der CDAI >150, handelt es sich um einen akuten behandlungsbedürftigen Schub.
Therapie
Ziel der Therapie ist in erster Linie die Linderung der Symptome und die Verringerung der Anzahl akuter Schübe. Dabei unterscheidet sich die Behandlung eines akuten Anfalls (Schubtherapie) grundsätzlich von einer Langzeittherapie.
Akuter Schub
Die Behandlung eines akuten Schubes erfolgt nach der Schwere des Schubs. Basismaßnahme ist eine Diät, eventuell kombiniert mit parenteraler Ernährung oder voll resorbierbarer, ballaststoffarmer Flüssignahrung (z.B. Modulen®).
Bei milden Schüben kann ein Therapieversuch mit Mesalazin erfolgen, schwere Schübe erfordern in der Regel eine Therapie mit Glukokortikoiden. Mit Budesonid p.o. kann eine vorwiegend lokale Wirkung im Darm erreicht werden, da es einem hohen First-Pass-Effekt unterliegt. Liegt eine Erfolglosigkeit vor, werden systemisch wirksame Präparate gegeben, z.B. Prednison.
Ist der Schub dennoch nicht zu durchbrechen, kommen Zytostatika wie Azathioprin und Methotrexat zum Einsatz. Ziel der akuten Therapie ist die Remission.
Langzeittherapie
In der Langzeittherapie gilt es, eine bereits erreichte Remission oder Besserung zu erhalten. Erstrebenswert ist eine Langzeittherapie mit dem antiphlogistisch wirkenden Mesalazin (5-ASA), welches jedoch nicht immer zur Rezidivfreiheit führt.
Immunsuppressiva
Zur Immunsuppression werden Glukokortikoide (z.B. Prednison) in möglichst niedriger Erhaltungsdosis verwendet. Alternativen sind Immunsuppressiva wie Azathioprin, 6-Mercaptopurin oder Methotrexat. Die potenziellen Nebenwirkungen dieser Arzneistoffe machen jedoch ein engmaschiges Monitoring der Patienten notwendig.
TNF-alpha-Blocker
Vor allem bei jüngeren, steroidsensiblen Crohn-Patienten kommt eine Therapie mit TNF-α-Blockern in Betracht. Dabei handelt es sich um monoklonale Antikörper wie Infliximab, Adalimumab oder Certolizumab. Ein Nachteil der Therapie mit TNF-α-Blockern ist, dass durch ihre Anwendung eine ruhende Tuberkulose reaktiviert werden kann. Vor Beginn der Therapie muss daher eine Infektion mit Tuberkelbakterien ausgeschlossen werden.
Integrin-Antagonisten
Integrin-Antagonisten wie Vedolizumab blockieren selektiv bestimmte Adhäsionsmoleküle (Integrine) auf der Oberfläche von aktivierten Lymphozyten. Dadurch wird verhindert, dass die Lymphozyten ins Gewebe einwandern - der Entzündungsprozess wird unterdrückt.
Interleukin-Inhibitoren
Interleukin-Inhibitoren wirken entzündungshemmend. Ustekinumab ist ein monoklonaler Antikörper der an die gemeinsame p40-Untereinheit der Zytokine Interleukin-12 und Interleukin-23 bindet und deren Wirkung blockiert. Darüber hinaus sind die spezifischen Interleukin-23-Inhibitoren Guselkumab, Risankizumab und Mirikizumab zur Behandlung des Morbus Crohn zugelassen.
Interleukin-Inhibitoren werden bei mittelschwerem bis schwerem aktivem Morbus Crohn eingesetzt, wenn konventionelle Therapien oder andere Biologika nicht ausreichend wirksam waren oder nicht vertragen wurden.
Januskinase-Inhibitoren
Upadacitinib ist ein selektiver Januskinase-Inhibitor, der seit April 2023 in Deutschland für die Behandlung von Erwachsenen mit mittelschwerem bis schwerem aktivem Morbus Crohn zugelassen ist. Die Zulassung gilt für Patienten, die auf eine konventionelle Therapie oder ein Biologikum unzureichend angesprochen haben, nicht mehr darauf ansprechen oder diese nicht vertragen haben.
Ausschließliche enterale Ernährung
Die ausschließliche enterale Ernährung (exclusive enteral nutrition, EEN) wird häufig bei Kindern mit Morbus Crohn eingesetzt. Sie ist eine Flüssigdiät mit Oligopeptiden oder ganzen Proteinen, die oral oder per Sonde verabreicht wird. Sie kann TGF-β2 enthalten. TGF-β2 kontrolliert die Differenzierung und Aktivierung von Lymphozyten, Makrophagen und dendritischen Zellen. Die Therapiedauer beträgt etwa 8 Wochen.
Chirurgische Therapie
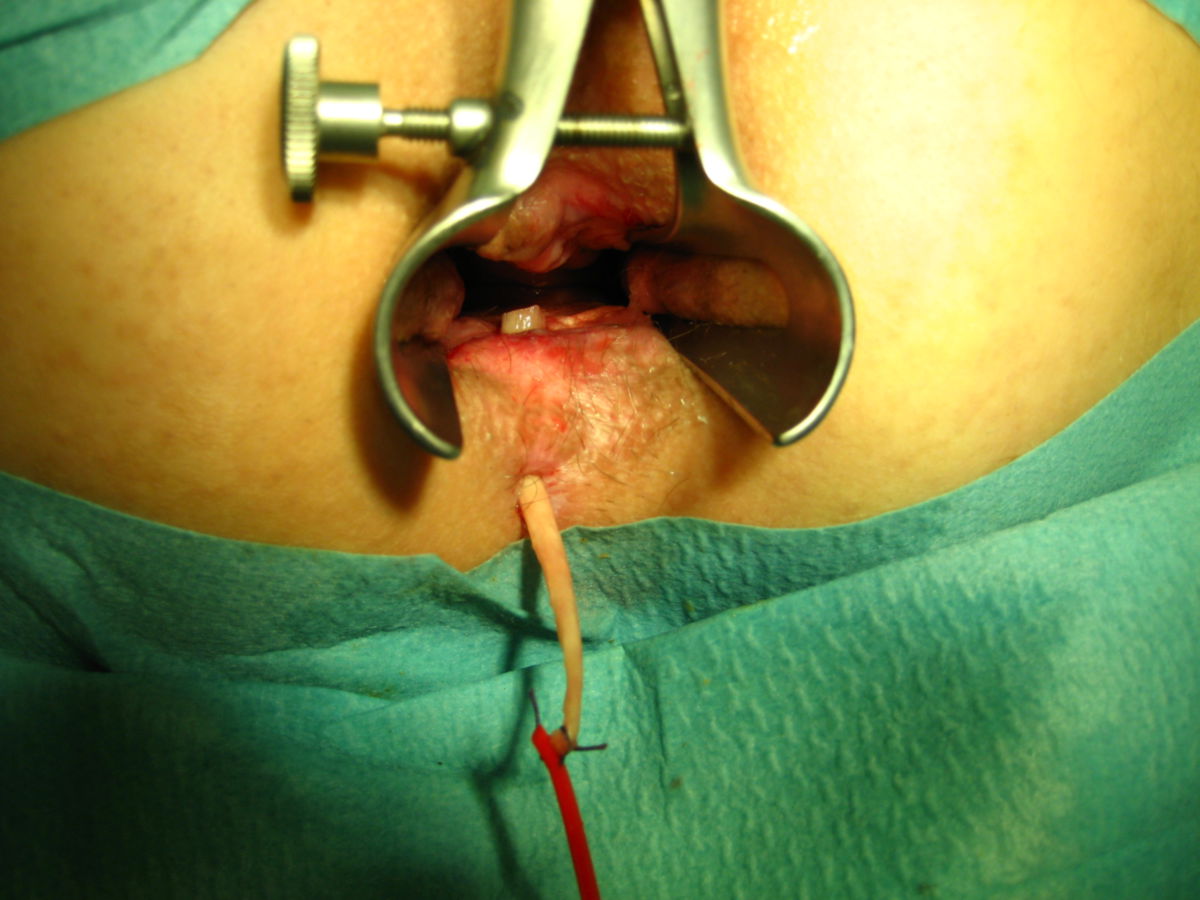
Eine Entfernung befallener Darmabschnitte führt zu keiner definitiven Heilung, ist aber bei schwereren Fällen unter Umständen unerlässlich, um schwere Komplikationen wie Stenosen, Fisteln, Abszesse oder Perforationen zu vermeiden. Dabei muss so gewebeschonend wie möglich vorgegangen werden. Im Dünndarm kann eventuell eine Strikturoplastik das Darmlumen erweitern, ohne dass Darmteile enfernt werden müssen.
Prognose
Beim Morbus Crohn handelt es sich um eine chronische Erkrankung mit hoher Rezidivrate. Komplikationen machen in etwa 90 % aller Fälle eine operative Therapie erforderlich, die aber zu keiner definitiven Heilung führt, sondern nur die Komplikationen behebt. Unter adäquater Therapie ist die Lebenserwartung der Betroffenen kaum eingeschränkt.
Quiz
Weblinks
Leitlinie
- Preiß et al.: Aktualisierte S3-Leitlinie–„Diagnostik und Therapie des Morbus Crohn“ 2014
Bildquelle
- Bildquelle für Flexikon-Quiz: ©Andrea Piacquadio / Pexels
Quelle
- ↑ Caruso R, et al.. NOD1 and NOD2: signaling, host defense, and inflammatory disease. Immunity. 2014