Megaloblastäre Anämie
Synonym: Megaloblastenanämie
Englisch: megaloblastic an(a)emia
Definition
Megaloblastäre Anämie ist ein Sammelbegriff für Anämieformen, bei der die DNA-Synthese der blutbildenden Zellen im Knochenmark beeinträchtigt ist. Dabei kommt es zu einer Entwicklungs- und Reifungsstörung der Erythrozyten. Sie geht mit dem Auftauchen von Megaloblasten im Knochenmark, sowie mit einer Vergrößerung der Erythrozyten im peripheren Blut (Megalozyten) einher.
Hintergrund
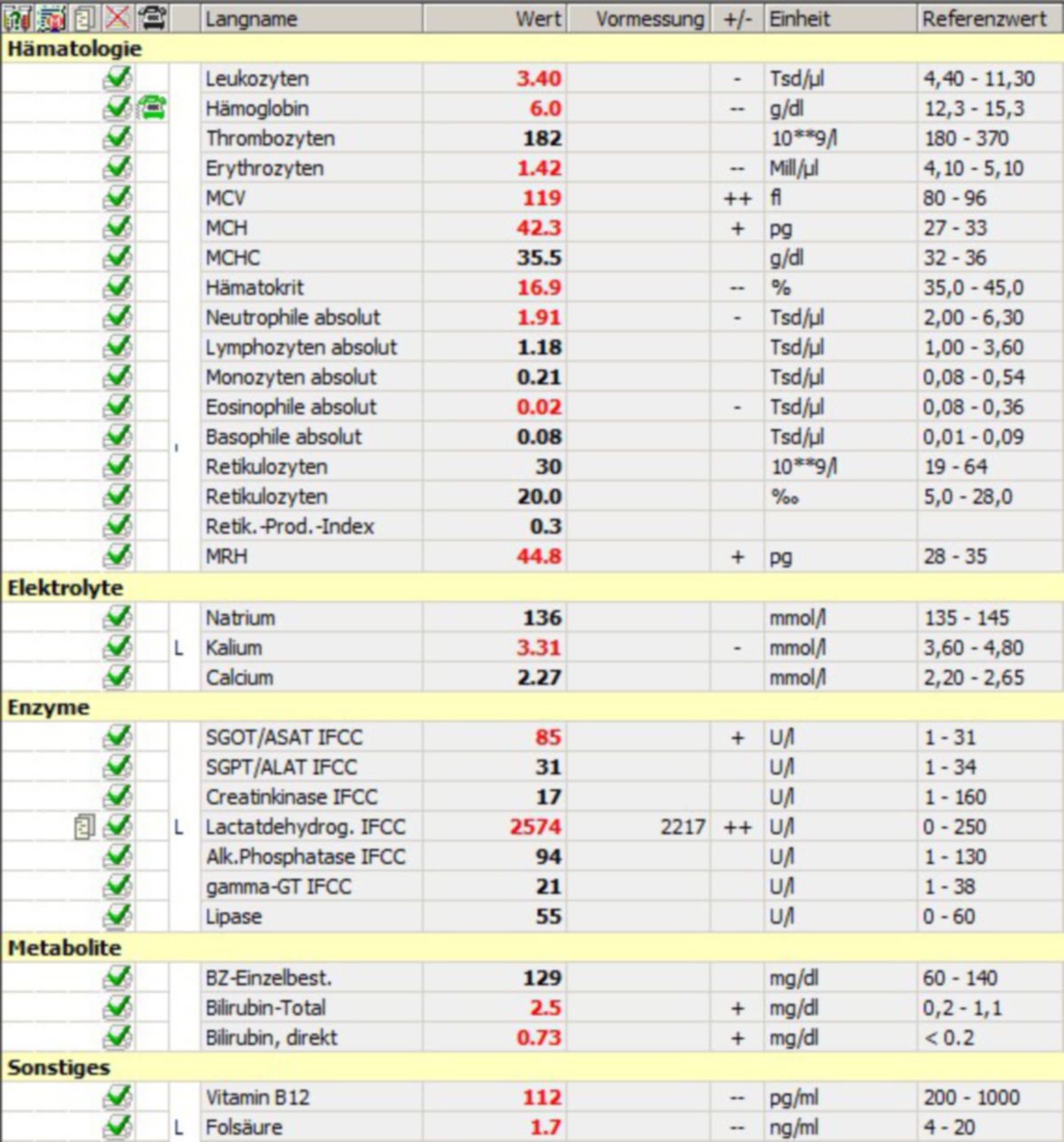
Bei den Megaloblasten handelt es sich überwiegend um Vorläuferzellen der Erythropoese, die eine anomale Kernstruktur aufweisen. Darüber hinaus können aber auch andere Zelllinien, wie die Zellen der Granulopoese und die Megakaryozyten verändert sein. Die megaloblastäre Anämie zeigt sich im Blutbild als hyperchrome makrozytäre Anämie, d.h. MCH und MCV sind erhöht. Außerdem finden sich übersegmentierte Granulozyten mit 6-7 Segmenten. Im fortgeschrittenen Stadium zeigt sich eine Panzytopenie.
Ursachen
Die häufigsten Ursachen einer megaloblastären Anämie sind ein Folsäuremangel (Folsäuremangelanämie) oder ein Vitamin-B12-Mangel (Vitamin-B12-Mangelanämie). Die detaillierte Besprechung dieser beiden Hypovitaminosen erfolgt in den entsprechenden Artikeln.
Folsäuremangel
Bei den meisten Patienten mit Folsäuremangel findet sich ein nutritiver Grund, insbesondere im hohen Alter oder bei Alkoholismus und psychiatrischen Beeinträchtigungen. Eine Malabsorption von Folsäure tritt insbesondere bei Zöliakie auf. Weiterhin kann dem Mangel ein erhöhter Bedarf oder Verlust zu Grunde liegen. Dies kann sowohl physiologische (Schwangerschaft, Stillzeit, Frühgeborene) als auch pathologische Ursachen haben (Sichelzellanämie, autoimmunhämolytische Anämie, chronische Entzündungen, langjährige Dialyse, Herzinsuffizienz, Lebererkrankungen). Außerdem können Medikamente einen Folsäuremangel bedingen, insbesondere Folsäureantagonisten (Methotrexat, Trimethoprim, Cotrimoxazol) und Antikonvulsiva (Phenytoin, Primidon).
Vitamin-B12-Mangel
Ein Vitamin-B12-Mangel kann bei striktem Veganismus auftreten, wenn auf Fleisch, Fisch, Eier, Käse und andere tierische Produkte verzichtet wird, sowie bei inadäquater Ernährung aufgrund von Armut oder psychiatrischen Erkrankungen. Weiterhin kann eine Malabsorption zu einem Mangel führen, der jedoch oft nicht so ausgeprägt und anhaltend ist, um eine megaloblastäre Anämie zu verursachen. Zu den wichtigsten Ursachen einer Malabsorption zählen:
- Fehlen des Intrinsic Factors, z.B. im Rahmen einer atrophische Gastritis (perniziöse Anämie) oder nach Gastrektomie
- Blindsack-Syndrom mit bakterieller Fehlbesiedlung im Dünndarm (Intestinal Stagnant Loop Syndrome)
- Zöliakie
- Morbus Crohn
Weitere Ursachen
Weitere Ursachen einer megaloblastären Anämie können sein:
- akute myeloische Leukämie (AML) oder myelodysplastische Syndrome (MDS), der genaue Pathomechanismus ist unklar
- Purinanaloga (z.B. Azathioprin, 6-Mercaptopurin)
- Pyrimidinanaloga (z.B. Cytosinarabinosid, 5-Fluoruracil)
- Weitere Antimetabolite, die in die DNA-Replikation eingreifen, z.B. Hydroxyurea
- antivirale Nukleosidanaloga
- hereditäre Orotazidurie
- genetischer Defekt im Thiamintransportgen SLC19A2
- Alkoholismus
Pathophysiologie
Alle megaloblastären Anämie basieren auf einen Defekt der DNA-Synthese, der insbesondere die hämatopoetischen Zellen im Knochenmark betrifft. Das Gleichgewicht zwischen der erforderlichen Syntheserate und Verfügbarkeit der Purine (Adenin, Guanin) und Pyrimidine (Thymidin und Cytosin) ist gestört. Bei einem Folsäure- oder Vitamin-B12-Mangel kann Desoxyuridinmonophosphat (dUMP) nicht zu Desoxythymidinmonophosphat (dTMP) umgewandelt werden. DTMP wird jedoch für die Bildung von Desoxythymidintriphosphat (dTTP) benötigt. Außerdem häuft sich Desoxyuridintriphosphat (dUTP) an, sodass Uracil in die DNA eingebaut wird.
Epidemiologie
Die megaloblastäre Anämie durch Vitamin-B12-Mangel tritt mit einer Inzidenz von etwa 9 Fällen pro 100.000 Einwohner pro Jahr auf. Das Erkrankungsalter weist einen Gipfel bei rund 60 Jahren auf.
Symptome
Anämiebedingte Symptome
Asymptomatische Patienten werden zufällig im Rahmen einer einer Blutuntersuchung durch ein erhöhtes MCV entdeckt. Bei schwereren Verläufen fallen die typischen Anämiesymptome auf (Abgeschlagenheit, verminderte Leistungsfähigkeit, Müdigkeit, Kopfschmerz, Belastungsdyspnoe, Tachykardie, Schwindel). Weitere möglichen Symptome sind:
- Anorexie
- Gewichtsverlust
- Diarrhö oder Obstipation
- Glossitis
- Mundwinkelrhagaden
- Subfebrile Temperaturen
- Ikterus
- Reversible melaninbedingte Hyperpigmentierung der Haut
Weiterhin kann eine Thrombozytopenie zu Einblutungen führen, die vor allem bei gleichzeitigem Vitamin-C-Mangel oder mangelernährten Alkoholikern auftreten. Die Anämie, geringe Leukozytopenie sowie die verminderte Funktion der Phagozyten bei Vitamin-B12-Mangel prädisponieren für Infektionen des Respirations- und Urogenitaltrakts.
Weitere Symptome
Ein Mangel an Vitamin-B12 oder Folsäure führt zu einem Verlust der Fertilität und kann in der Schwangerschaft Fehlgeburten und Neuralrohrdefekten hervorrufen. Außerdem verursacht ein Vitamin-B12-Mangel neurologische Manifestationen, wie z.B. eine Polyneuropathie oder eine funikuläre Myelose.
Beim genetischen Defekt des Thiamintransportgens SLC19A2 können außer der megaloblastären Anämie ein Diabetes mellitus, Gehörlosigkeit und Ringsideroblasten im Knochenmark auftreten.
Diagnose
Überblick
- Anamnese: zur Eingrenzung einer zugrundeliegenden Ursache
- Klinische Untersuchung (Anämiezeichen)
- Labor
- Blutbild
- Bestimmung von Vitamin B12, Holo-Transcobalamin, Folsäure, LDH, Haptoglobin, Bilirubin und Ferritin im Serum
- Bei unklarer Ursache gegebenenfalls Knochenmarksbiopsie
Hämatologische Veränderungen
Im peripheren Blut fallen ovale Makrozyten (Ovalozyten) sowie eine ausgeprägte Anisozytose und Poikilozytose auf. Die Erythrozyten können eine basophile Tüpfelung zeigen. Gelegentlich finden sich kernhaltige rote Vorläuferzellen im peripheren Blut. Das MCV ist (außer bei begleitendem Eisenmangel oder Thalassämie) erhöht. Einige neutrophile Granulozyten sind hypersegmentiert (über 5 Segmente). Durch Verminderung der Granulozyten und Lymphozyten liegt meist eine Leukozytopenie vor. Die Thrombozytenzahl ist nur leicht reduziert.
Bei schwerer Anämie wird das Knochenmark hyperzellulär und unreife Zellen akkumulieren. In der Eisenfärbung kann viel Eisen nachgewiesen werden. Die Erythroblasten besitzen einen unreifen Zellkern bei normaler Reifung des Zytoplasmas (Kernplasmareifungsdissoziation). Dabei sind die Zellen größer als Normoblasten (Makroblasten) und viele zeigen einen exzentrischen, lobulierten Zellkern sowie Kernfragmente. Außerdem kommen riesige Metamyelozyten und vergrößerte Megakaryozyten vor. In schweren Fällen kann die Akkumulation unreifer Zellen eine AML vortäuschen.
Knochenmarkzellen und andere proliferierende Körperzellen zeigen bei der megaloblastären Anämie chromosomale Veränderungen (z.B. Chromosomenbrüche). Weiterhin führt das Absterben erythrozytärer Knochenmarkzellen aufgrund der ineffektiven Erythropoese zur Akkumulation von unkonjugiertem Bilirubin im Plasma. Aufgrund dessen findet sich auch ein erhöhtes Urobilinogen und vermindertes Haptoglobin. Im Urin lässt sich Hämosiderin nachweisen während LDH im Serum leicht ansteigt. Ein schwach positiver Coombs-Test kann zur Fehldiagnose einer autoimmunhämolytischen Anämie führen.
Therapie
...bei Vitamin-B12-Mangel
Falls eine kausale Therapie nicht möglich ist, sollte lebenslang regelmäßig Cobalamin substitutiert werden. Indikationen einer Substitution sind eine megaloblastäre Anämie, andere hämatologische Auffälligkeiten oder eine Neuropathie. Es existieren verschiedene Strategien zur Substitution. In Deutschland wird meist initial 1.000 µg/d Hydroxycobalamin über 5 Tage intramuskulär injiziert. Dies dient der Auffüllung der Körperspeicher. Anschließend wird bis zur Normalisierung des Blutbildes und der LDH einmal wöchentlich 500 µg intramuskulär injiziert. Die lebenslange Erhaltungstherapie erfolgt mit 500 µg intramuskulär alle 6 Monate, sofern die kausale Therapie nicht möglich ist. In gewissen Situationen, z.B. bei perniziöser Anämie, können auch höhere Dosierungen notwendig sein. In den USA wird meist Cyanocobalamin oral verabreicht.
...bei Folsäuremangel
Bei einem Folsäuremangel wird neben der Beseitigung der ursächlichen Störung meist Folsäure in einer Dosierung von 5 mg/d oral verabreicht. Die Therapiedauer beträgt meist 4 Monate und sollte bis zur Normalisierung des Blutbildes fortgeführt werden. Bevor die Folsäure-Substitution begonnen wird, muss ein Vitamin-B12-Mangel ausgeschlossen und korrigiert werden, da sich sonst trotz Ansprechen der Anämie auf die Folsäuregabe eine Vitamin-B12-induzierte Neuropathie entwickeln kann. Falls die Ursache nicht behoben werden kann oder der Mangel mit hoher Wahrscheinlichkeit wiederkehren wird, kann Folsäure langfristig substitutiert werden.
...bei anderen Ursachen
Eine hereditäre Orotazidurie spricht auf Uridin an. Bei einem genetischen Defekt im Thiamintransprotgen SLC19A2 kann Thiamin verabreicht werden.
Supportive Therapie
Bluttransfusionen sind meist nicht nötig. Falls doch, sollten nur 1 bis 2 Erythrozytenkonzentrate gegeben werden. Gelegentlich zeigt sich ein bis zwei Wochen nach Therapiebeginn eine starke Thrombozytose. Bei sehr hohen Werten kann ASS erwogen werden.
Prophylaxe
Bei Gabe von Methotrexat und anderen Dihydrofolatreduktase-Hemmern (Trimethoprim, Cotrimoxazol) kann zur Therapie oder Prävention eines Folsäuremangels Folinsäure (5-Formyl-Tetrahydrofolat) eingesetzt werden.
Bei Patienten mit chronischer Dialyse und unter parenteraler Ernährung wird eine Folsäureprophylaxe empfohlen. Auch vor und während einer Schwangerschaft wird Folsäure (400 µg/d) empfohlen, um eine megaloblastäre Anämie zu verhindern und die Inzidenz von Neuralrohrdefekten zu senken. Bei Frauen, die bereits einen Fetus mit Neuralrohrdefekt zur Welt brachten, wird vor und während der nächsten Schwangerschaft eine Substitution mit 5 mg/d durchgeführt.
Bei frühgeborenen Säuglingen mit einem Geburtsgewicht unter 1.500 g wird während der ersten 6 Lebenswochen routinemäßig Folsäure gegeben. Dies gilt auch für Frühgeborene, die eine Austauschtransfusion benötigen, Schwierigkeiten beim Füttern haben sowie Zeichen einer Infektion, Erbrechen oder Diarrhö aufweisen.