Myokardinfarkt
Synonyme: Herzinfarkt (HI), Herzmuskelinfarkt
Englisch: myocardial infarction
Definition
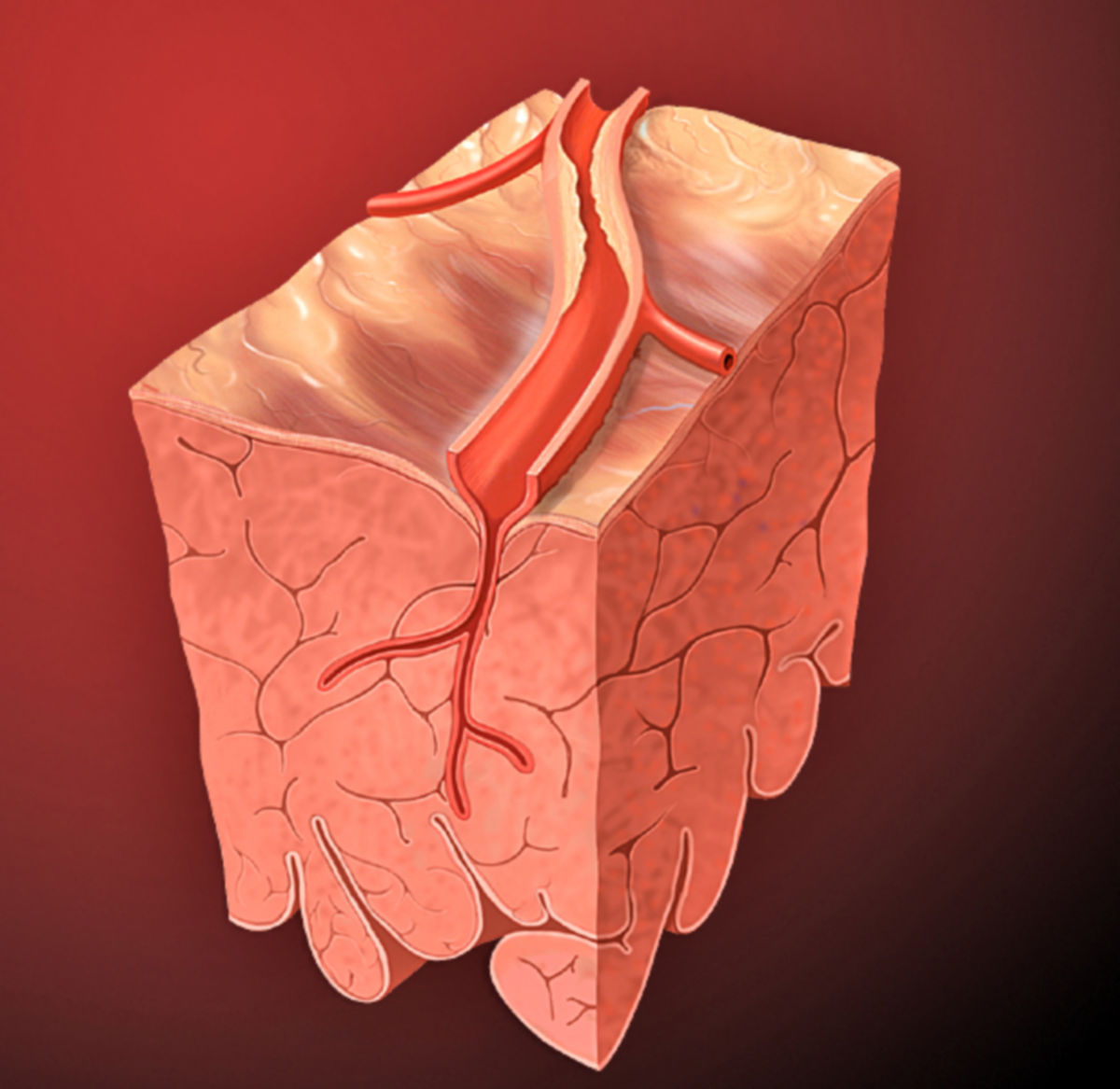
Der Begriff Myokardinfarkt, kurz MI, bezeichnet den regionalen Untergang von Herzmuskelgewebe (Myokard) aufgrund einer lokalen Durchblutungsstörung. Ursächlich ist dabei häufig die Verengung des Lumens eines Astes der Koronargefäße.
ICD10-Code
- I21.0 Akuter transmuraler Myokardinfarkt der Vorderwand
- I21.1 Akuter transmuraler Myokardinfarkt der Hinterwand
- I21.4 Akuter subendokardialer Myokardinfarkt
Epidemiologie
Der Myokardinfarkt ist eine der häufigsten Todesursachen in den reichen Ländern: In Deutschland erleiden rund 280.000 Menschen jährlich einen Herzinfarkt, 90.000 von ihnen überleben ihn nicht.
Die Mortalität nach einem Myokardinfarkt nimmt seit den 1990er Jahren kontinuierlich ab. Dabei bestehen allerdings geschlechtsspezifische Unterschiede: Bei Frauen sinkt die Sterblichkeit langsamer als bei Männern.[1]
Ursachen
Ein Myokardinfarkt entsteht in der Regel auf dem Boden einer koronaren Herzkrankheit (KHK). Atheromatöse Plaques verengen das Gefäßlumen. Kleine Einrisse der Fibrinschicht an der Oberfläche instabiler, "vulnerabler" Plaques können zu einer Aktivierung der Thrombozyten führen. Es kommt zur intravasalen Gerinnung mit Bildung eines Thrombus, der das Gefäß verlegt und die Durchblutung der abhängigen Gewebebereiche zum Erliegen bringt (Koronarthrombose). Nach einer Zeitspanne von nur 15 bis 30 Minuten stirbt das betroffene Myokard ab. Abhängig von der Lokalisation und Dauer des Koronarverschlusses kommt es zur typischen Infarktsymptomatik.
Seltener entstehen Myokardinfarkte durch Spasmen der Koronargefäße (Prinzmetal-Angina), allergische Reaktionen (Kounis-Syndrom) oder Embolien. Manche Drogen führen zu einem Spasmus der Koronargefäße und damit zu einem Herzinfarkt, z.B. ist in der ersten Stunde nach der Einnahme von Kokain das Risiko für einen Infarkt um das 24-fache erhöht.
Risikofaktoren
Klassische Risikofaktoren für die Entstehung des Myokardinfarkts und der Arteriosklerose sind insbesondere Rauchen, Bluthochdruck, erhöhte Cholesterinwerte, Diabetes sowie falsche Ernährung, erhöhter Alkoholkonsum, Bewegungsmangel, chronische Entzündungsherde (z.B. Parodontitis) und Stress. Als Mitverursacher vieler Herz-Kreislauf-Erkrankungen treten zunehmend auch erbliche Faktoren in den Fokus.
Einteilung
... nach Ausbreitung in den Wandschichten
- Transmuraler Infarkt (Nekrose betrifft alle Wandschichten)
- Intramuraler Infarkt (Nekrose ist auf Teilschichten begrenzt)
- Subendokardialer Infarkt (Nekrose unter der Innenschicht)
siehe auch: Prinzip der letzten Wiese
... nach betroffenem Myokardareal
Das Infarktareal entspricht dem Versorgungsgebiet der stenosierten Koronararterie, wobei fast immer das linke Herz betroffen ist.
- Vorderwandinfarkt (ca. 50 %): Verschluss des Ramus interventricularis anterior der Arteria coronaria sinistra (RIVA) oder ihrer Äste
- Vorderwandspitzeninfarkt: Verschluss des RIVA im mittleren oder distalen Drittel
- Anteroseptalinfarkt (ASI): Verschluss eines septalen RIVA-Astes
- Anterolateralinfarkt (ALI): Verschluss eines lateralen RIVA-Astes
- Hinterwandinfarkt (ca. 20 bis 25%): Verschluss der Arteria coronaria dextra (RCA) oder des Ramus interventricularis posterior der Arteria coronaria dextra (RIVP)
- Seitenwandinfarkt (ca. 15 bis 20%): Verschluss des Ramus circumflexus der Arteria coronaria sinistra (RCX)
Von den o.a. Infarktformen werden teilweise noch weitere Krankheitsbilder abgegrenzt, wie z.B. der Myokardinfarkt mit rechtsventrikulärer Beteiligung (vulgo: Rechtherzinfarkt).
... nach EKG-Veränderungen
Im Hinblick auf ST-Streckenveränderungen im Elektrokardiogramm wird unterschieden in:
... nach Okklusion
Alternativ zur STEMI/NSTEMI-Einteilung wird von einigen Autoren folgende Unterscheidung, das OMI/NOMI-Konzept, vorgeschlagen:[2]
- Okklusiver Myokardinfarkt ("occlusion myocardial infarction", OMI)
- Nicht-okklusiver Myokardinfarkt (non-occlusion myocardial infarction", NOMI)
... nach Pathogenese
Anhand von pathogenetischen Mechanismen können fünf Typen unterschieden werden:[3][4][5]
- Myokardinfarkt Typ 1: Spontaner Infarkt durch Ruptur, Ulzeration, Einriss, Erosion oder Dissektion einer arteriosklerotischen Plaque mit Ausbildung eines intraluminalen Thrombus
- Myokardinfarkt Typ 2: KHK-unabhängiger Infarkt aufgrund einer Erkrankung oder Situation, die zu einem Missverhältnis von Sauerstoffverbrauch und -angebot führt, z.B. endotheliale Dysfunktion, Koronarspasmus, Koronarembolie, Tachyarrhythmie oder Bradyarrhythmie bei Vorhofflimmern, Anämie, Thyreotoxikose, respiratorische Insuffizienz, Hypotension oder Hypertension
- Myokardinfarkt Typ 3: Herztod mit vorangegangenen Symptomen, die auf eine Myokardischämie hinweisen
- Myokardinfarkt Typ 4a: Akuter Infarkt in Zusammenhang mit einer PCI
- Myokardinfarkt Typ 4b: Akuter Infarkt aufgrund einer Stent/Scaffold-Thrombose
- Myokardinfarkt Typ 4c: Infarkt aufgrund einer In-Stent-Restenose oder Restenose nach Ballonangioplastie im Infarktareal
- Myokardinfarkt Typ 5: Akuter Infarkt in Zusammenhang mit einer CABG-OP
Neben diesen Typen wird von einigen Autoren als weitere pathogenetische Variante der Myokardinfarkt mit nichtobstruktiven Herzkranzgefäßen (MINOCA) unterschieden.
Symptome
Etwa 20 % der Infarkte sind asymptomatisch (stummer Infarkt). Das Ausmaß und die Qualität der Symptomatik sind interindividuell sehr variabel.
Klassische Symptomatik
Klassisches Leitsymptom ist die Angina pectoris mit akut auftretendem retrosternalem Schmerz, unter Umständen als "referred pain" ausstrahlend in den linken Arm, Hals, Unterkiefer, Rücken oder Oberbauch. Der Schmerz kann als sehr bedrohlich empfunden werden (Vernichtungsschmerz) und mit Todesangst einhergehen. Er ist nicht atem- oder lageabhängig. Im Gegensatz zum Angina-pectoris-Anfall bessern sich die Beschwerden oft nicht durch Anwendung von Nitroglycerin.
Betroffene empfinden Dyspnoe, sind häufig kaltschweissig und blass. Die Akren können als Ausdruck eines Blutdruckabfalls bei versagender Pumpleistung zyanotisch sein. Häufig bestehen Arrhythmien, meistens tachykard, bei Hinterwandinfarkten häufiger bradykard. Weiterhin bestehen häufig Schwindel (auch Bewusstlosigkeit) und Übelkeit (u.U. mit Erbrechen).
Symptome bei Frauen
Bei Frauen sind die Symptome oft weniger eindeutig als bei Männern. Gerade der typische Brustschmerz, der zur Diagnose eines Herzinfarkts führt, kann fehlen oder nur schwach ausgeprägt sein. Bei Frauen kommt es häufiger zu Druck- oder Engegefühl in der Brust. Weitere Symptome für einen Herzinfarkt bei Frauen können Dyspnoe, Schweißausbrüche, Rückenschmerzen, Übelkeit, Erbrechen, Schmerzen im Oberbauch, Ziehen in den Armen, unerklärliche Müdigkeit und Depressionen sein.
Symptome bei Diabetikern
Menschen mit Diabetes mellitus haben häufig ein reduziertes Schmerzempfinden. Sie nehmen aufgrund von Nervenschädigungen erste Symptome wie Angina pectoris kaum wahr, so dass die Diagnosestellung erschwert ist.
Pathohistologie
Bereits 4 bis 6 Stunden nach dem Infarkt zeigen sich mikroskopisch Koagulationsnekrosen der Kardiomyozyten mit Hypereosinophilie der Zellen. In den Gefäßen reichern sich neutrophile Granulozyten an. Ein weiteres Zeichen der Myozytenschädigung sind Kontraktionsbandnekrosen mit hyperkontrahierten Sarkomeren sowie gewellte Muskelfasern ("wavy fibers"). Im Zeitraum von 6 bis 24 Stunden nimmt die Infiltration durch neutrophile Granulozyten zu und es kommt zur Bildung eines hyperämischen Randsaums.
3 bis 7 Tage nach dem Infarkt beginnt die Bildung von Granulationsgewebe. Vom Rand der Nekrose sprossen Kapillaren ein. Nekrotische Gewebsreste werden durch einwandernde Makrophagen entfernt. Parallel beginnen Fibroblasten damit, durch Produktion von Kollagenfasern eine Narbe zu bilden. Nach etwa 6 Wochen ist der Ersatz der Nekrose durch Narbengewebe abgeschlossen.
Komplikationen
Die Komplikationen nach einem Myokardinfarkt lassen sich in Früh- und Spätkomplikationen einteilen. Die frühen Komplikationen treten i.d.R. innerhalb der ersten Woche nach dem Infarktgeschehen auf.
Frühkomplikationen
- Herzrhythmusstörungen
- Linksherzinsuffizienz
- Myokardruptur mit Perikardtamponade
- Papillarmuskelabriss
- Sehnenfadenruptur
- Pericarditis epistenocardica (Frühperikarditis)
Spätkomplikationen
- Herzwandaneurysma
- Dressler-Syndrom (Spätperikarditis)
- Mitralklappeninsuffizienz
- Perimyokarditis
Durch akinetische Wandbezirke erhöht sich die Gefahr einer intrakardialen Thrombenbildung mit nachfolgenden kardiogenen Embolien.
Risikostratifizierung
Das Mortalitätrisiko einer akuten Herzinsuffizienz nach Herzinfarkt wird anhand der klinischen Symptome mit Hilfe der Killip-Klassifikation eingeschätzt.
Diagnostik
Basisdiagnostik
Die Basisdiagnostik umfasst die Anamnese und die körperliche Untersuchung sowie das Anfertigen eines EKGs. Als patientennahe Sofortdiagnostik (POCT) sollte ein Troponin-Schnelltest durchgeführt werden. Mit ensprechenden Testgeräten lassen sich auch weitere kardiale Marker sofort bestimmen.
EKG-Diagnose
Bei Verdacht auf einen Myokardinfarkt sollte sofort ein Ruhe-EKG abgeleitet werden, bei Verdacht auf einen Hinterwandinfarkt können die Ableitungen nach Nehb hilfreiche Zusatzinformation geben. Als Infarktzeichen gelten unter anderem ST-Hebungen, ein R-Verlust und das sogenannte Erstickungs-T.
siehe Hauptartikel: EKG-Infarktzeichen
Labordiagnostik
Beim Myokardinfarkt gelangen vermehrt Enzyme und Strukturproteine aus den geschädigten Herzmuskelzellen in das Blut und sind dort in erhöhter Konzentration nachweisbar.
Dabei muss zwischen herzmuskelspezifischen Laborwerten (Troponin T, Troponin I, CK-MB und GPBB) und herzmuskelunspezifischen Laborwerten (Myoglobin, Gesamt-CK, AST, ALT, LDH unterschieden werden. Am frühesten (2 bis 3 h) sind Myoglobin und Troponin T nachweisbar, erhöhte Werte für CK-MB, AST und ALT sind 4 bis 8 Stunden nach Infarkt nachweisbar, ein LDH-Anstieg nach 24 bis 60 Stunden. Bei Verwendung hochsensitiver Troponintests (hsTnT, hsTnI) werden die Enzymanstiege früher detektiert als mit älteren Verfahren.
siehe auch: Labordiagnostik beim Herzinfarkt
Zusatzdiagnostik
Therapie
Akuttherapie
Ein akuter Myokardinfarkt erfordert die umgehende stationäre Aufnahme in ein Krankenhaus und eine intensivmedizinische Betreuung. Durch den Rettungsdienst bzw. in der Notaufnahme eines Krankenhauses wird zur Antikoagulation in aller Regel zunächst Heparin i.v. (70 IE/kgKG, meist ca. 5.000 IE) und ASS (empfohlen 150 bis 300 mg p.o. bzw. 75 bis 250 mg i.v.) zur Thrombozytenaggregationshemmung verabreicht. Sofern kein Heparin verfügbar ist, oder bei bekannter HIT, kann auch Bivalirudin (seltener auch Enoxaparin) zum Einsatz kommen.
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Bei gesichertem STEMI soll zusätzlich die Gabe eines P2Y12-Antagonisten wie Prasugrel oder Ticagrelor vor oder spätestens zu Beginn der PTCA erfolgen.[6]
Die Akuttherapie umfasst des Weiteren:
- strikte Bettruhe mit Oberkörperhochlagerung (zur Vorlastsenkung)
- Sauerstoffgabe (nur wenn SaO2 < 90%)
- Analgetika, oft Morphin wegen der gleichzeitigen Vorlastsenkung
- Sedativa bei sehr aufgeregten bzw. ängstlichen Patienten
- Nitroglycerin, wobei der Einsatz insbesondere bei STEMI aufgrund mangelnder Evidenz umstritten ist[7]
- Beatmung bei kardiogenem Schock
Ein Teil dieser Maßnahmen ist im MONA-Schema zusammengefasst.
Revaskularisierende Therapie
Als revaskularisierende Therapie bezeichnet man Maßnahmen, die darauf ausgerichtet sind, die Perfusion des Herzmuskels wieder zu verbessern. Dazu zählen:
- Aufdehnung eines Kranzgefäßes mittels PTCA und Anlage eines Stents
- Systemische Fibrinolyse (nur beim STEMI und Dauer bis zur PTCA > 120 min)
- Koronararterienbypass
Bei Infarktpatienten, die sich einer PTCA unterziehen, ist in der Akutphase der Einsatz von i.v.-Betablockern eine weitere Behandlungsoption, wenn die Patienten hämodynamisch stabil sind.[8]
Reinfarktprophylaxe
Die Reinfarktprophylaxe dient der Verhinderung eines erneuten Myokardinfarkts und besteht je nach Indikation aus:
- dualer Thrombozytenaggregationshemmung (DAPT), z.B. Acetylsalicylsäure plus Prasugrel, Ticagrelor oder ggf. Clopidogrel
- Statin
- Betablocker
- ACE-Hemmer
- Antikoagulation
- Aldosteronantagonist
- Einstellen des Nikotinabusus
- Normalisierung des Körpergewichtes
- Rehabilitation
- Teilnahme an einer Herzsportgruppe
Die routinemäßige Anwendung von Betablockern nach Myokardinfarkt wird nicht mehr generell empfohlen.[9] Individuelle Faktoren müssen bei der Verordnung abgewogen werden. Bei eingeschränkter linksventrikulärer Pumpfunktion (LVEF < 40 %) ist der Nutzen klar belegt und die Einnahme gerechtfertigt.[9][10] Ob die langfristige Gabe bei Patienten mit erhaltener Pumpfunktion einen positiven Einfluss auf die Prognose hat, ist bisher (2025) nicht eindeutig belegt.[9] Die Datenlage ist heterogen. Eine aktuelle (2025) Untersuchung zeigte sogar ein erhöhtes Risiko (insbesondere für Frauen) nach Herzinfarkt mit einer LVEF > 50 %,[11] während die Ergebnisse für Patienten mit nur leicht eingeschränkter Pumpfunktion (LVEF 40 - 50 %) widersprüchlich sind.[12]
tl;dr
Weiterführende Informationen
Quellen
- ↑ DGK: Gendermedizin: Frauen überleben schwere Herzinfarkte seltener als Männer 2017
- ↑ Dr. Smith’s ECG Blog: The OMI Manifesto, abgerufen am 23.2.2022
- ↑ Thygesen K et al. Third universal definition of myocardial infarction, ESC Committee for Practice Guidelines (CPG), Eur Heart J. 2012 Oct;33(20):2551-67, abgerufen am 22.07.2019
- ↑ Allgemeine Definition des Myokardinfarkts, Pocket-Leitlinie der Deutschen Gesellschaft für Kardiologie auf Grundlage der ESC Pocket Guideline, Version 2012, abgerufen am 22.07.2019
- ↑ Vierte Definition des Myokardinfarkts, Pocket-Leitlinie der Deutschen Gesellschaft für Kardiologie auf Grundlage der ESC Pocket Guideline, Version 2018, abgerufen am 22.07.2019
- ↑ Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018;39(2):119-177. doi:10.1093/eurheartj/ehx393
- ↑ Divakaran S, Loscalzo J. The Role of Nitroglycerin and Other Nitrogen Oxides in Cardiovascular Therapeutics. J Am Coll Cardiol. 2017;70(19):2393-2410. doi:10.1016/j.jacc.2017.09.1064
- ↑ 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. European Heart Journal, Volume 39, Issue 2, 07 January 2018, Pages 119–177, https://doi.org/10.1093/eurheartj/ehx393 Published: 26 August 2017
- ↑ 9,0 9,1 9,2 Vrints et al.: 2024 ESC Guidelines for the management of chronic coronary syndromes: Developed by the task force for the management of chronic coronary syndromes of the European Society of Cardiology (ESC) Endorsed by the European Association for Cardio-Thoracic Surgery (EACTS). European Heart Journal, 2024
- ↑ Overbeck, P.: Betablocker nach Herzinfarkt: Was die neuen kontroversen Ergebnisse bedeuten. Ärztezeitung, 09/2025
- ↑ Deutsches Ärzteblatt: Frauen nach Herzinfarkt: Betablockertherapie mit schlechterer Prognose verbunden. 04.09.2025
- ↑ Ibanez et al.: Beta-Blockers after Myocardial Infarction without Reduced Ejection Fraction. New England Journal of Medicine, 2025