Osteomyelitis
von altgriechisch: ὀστέον ("ostéon") - Knochen und μυελός ("myelós") - Mark
Synonym: Knochenmarkentzündung
Englisch: osteomyelitis
Definition
Eine Osteomyelitis, kurz OM, ist eine akute oder chronische Entzündung des Knochens und Knochenmarks, die meist durch eine bakterielle Infektion verursacht wird.
Nomenklatur
Der Begriff "Osteomyelitis" bezeichnet eine ossäre Entzündung, die primär oder sekundär das Knochenmark betrifft. Wenn der Infekt auf den Knochen oder auf das Periost beschränkt bleibt, spricht man auch von einer Ostitis bzw. Periostitis. Diese stellen jedoch Ausnahmen dar.
Einteilung
...nach Verlauf
- akute Osteomyelitis
- subakute Osteomyelitis
- chronische Osteomyelitis (bei Erregerpersistenz und Verlauf > 6 Wochen)
...nach Ätiologie
- exogene Osteomyelitis
- posttraumatische Osteomyelitis
- postoperative Osteomyelitis
- hämatogene Osteomyelitis
- fortgeleitete Osteomyelitis
- spezifische Osteomyelitis
- chronisch nicht-bakterielle Osteomyelitis
...nach Zeitpunkt des Auftretens
Postoperative Osteomyelitiden werden nach ihrem zeitlichen Auftreten unterteilt in
- Frühinfektionen (innerhalb dreier Monate nach OP) und
- Spätinfektionen (später als drei Monate nach OP auftretende Infektion).
Formen
Exogene Osteomyelitis
Die exogene Osteomyelitis entsteht posttraumatisch oder postoperativ durch Kontamination des Knochengewebes über die Haut des Patienten mit verschiedenen Erregern. Bei der postoperativen Osteomyelitis spielen Hospitalkeime eine große Rolle.
Die Einteilung der posttraumatischen Osteomyelitis erfolgt meist nach Cierny-Mader[1], deren Klassifizierung sich nach der anatomischen Lokalisation im Knochen und dem klinischen Zustand des Patienten richtet.
| Stadium | Merkmal |
|---|---|
| Pathologische Veränderung | |
| 1 | Markraumosteomyelitis |
| 2 | Oberflächliche Osteomyelitis |
| 3 | Begrenzte kortikale Osteomyelitis |
| 4 | Diffuse Osteomyelitis |
| Klinischer Zustand | |
| A | Keine Risikofaktoren |
| B | Lokale Risikofaktoren (z.B. Lymphödem) |
| Systemische Risikofaktoren (z.B. Immundefizienz) | |
| Lokale und systemische Risikofaktoren | |
| C | Therapie wäre belastender als Erkrankung |
Die Knochendestruktion verläuft chronisch-progredient. Eine septische Streuung der Erreger ist möglich. Die Therapie besteht in der lokalen Sanierung des befallenen Knochens durch chirurgische Ausräumung der nekrotischen Knochensubstanz und hoch dosierter Antibiotikagabe nach Resistenzprüfung.
Erregerspektrum
Eine exogene Osteomyelitis entsteht in der Regel durch eine Infektion mit Bakterien. Typische Erreger sind:
- Staphylococcus aureus als Hauptkeim, allein und in Mischinfektionen
- Koagulase-negative Staphylokokken (häufiger bei der postoperativen Osteomyelitis)
- bei Osteomyelitis nach offener Fraktur auch gramnegative Keime wie Pseudomonas oder Anaerobier (z.B. Serratia marcescens)
Hämatogene Osteomyelitis
Die hämatogene Osteomyelitis entsteht durch eine Verschleppung von Bakterien auf dem Blutweg (hämatogene Absiedelung) im Rahmen einer Sepsis - z.B. bei Wundinfektionen, Tonsillitis, Atemwegsinfektionen und anderen bakteriellen Erkrankungen.
Betroffen sind vorwiegend Patienten im Kindes- und Jugendalter, bei denen die Knochen sehr gut durchblutet sind. Prädilektionsstellen sind die Metaphysen langer Röhrenknochen wie Femur, Tibia und Humerus. Bei Säuglingen und Kleinkindern kann die Infektion auf benachbarte Gelenke übergreifen. Im Erwachsenenalter manifestiert sich eine hämatogene Osteomyelitis v.a. als Spondylodiszitis.
Die akute Erkrankung kann in eine chronische Osteomyelitis übergehen und hat unbehandelt eine hohe Letalität. Die Therapie besteht in einer hoch dosierten Antibiotikagabe nach Resistenzprüfung über mindestens 6 Wochen. Meist ist nur eine Defektheilung möglich.
Erregerspektrum
- Akute Form: meist Staphylococcus aureus
- Chronische Infektion: zusätzlich unter anderem Staphylococcus epidermidis, Pseudomonas aeruginosa, Escherichia coli, Salmonella Typhi und Salmonella paratyphi
- Bei Immunsupprimierten Pilze wie Candida albicans, Blastomyces dermatitidis, Coccidioides immitis oder Aspergillus.
Fortgeleitete Osteomyelitis
Erreger gelangen aus einer Infektion des umgebenden Weichteilgewebes (z.B. über ein Panaritium oder ein Gangrän) per continuitatem in den Markraum.
Erregerspektrum
- Häufig Mischinfektionen (z.B. Staphylokokken, beta-hämolysierende Streptokokken)
Spezifische Osteomyelitis
Die so genannte spezifische Osteomyelitis entsteht im Rahmen einer Tuberkulose, hervorgerufen durch Mycobacterium tuberculosis. Der Erreger gelangt hämatogen in das Skelettsystem.
Risikofaktoren
Zur Entstehung einer Osteomyelitis können lokale, systemische und mikrobielle Faktoren beitragen:
- Lokale Risikofaktoren: Durchblutungsstörungen, offene Frakturen, Ausgedehnte Weichteilverletzungen
- Systemische Risikofaktoren: Immundefizienz (z.B. HIV, Neoplasien), Systemerkrankungen (Diabetes mellitus, pAVK), Medikamente (Immunmodulatoren), i.v.-Drogen
- Mikrobielle Risikofaktoren: Ausbildung bestimmter Virulenzfaktoren
Epidemiologie
Zur Prävalenz der Osteomyelitis in Deutschland sind nur wenige Daten verfügbar. Die Häufigkeit postoperativer Osteomyelitiden nach aseptischer Versorgung geschlossener Frakturen wird mit 1 bis 5 % geschätzt. Bei offenen Frakturen kann die Häufigkeit auf bis zu 25 % ansteigen. Bei 10 bis 30 % der Patienten geht die akute Osteomyelitis in ein chronisches Stadium über.[2]
Die exogene Osteomyelitis tritt häufiger bei Erwachsenen auf, die endogene Osteomyelitis betrifft überwiegend Kinder und Jugendliche (ca. 85 %).
Pathophysiologie
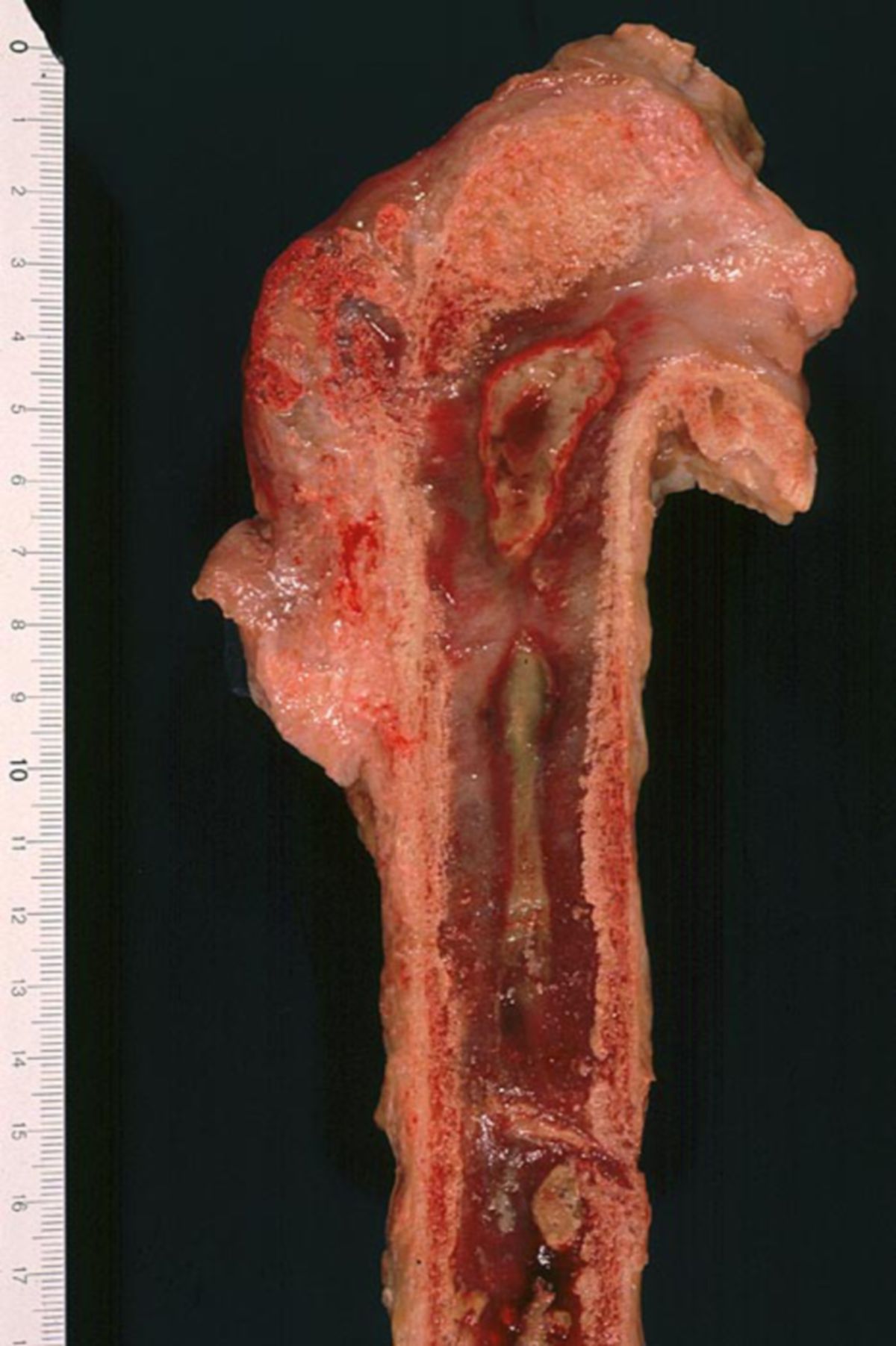
Nach der Infektion des Knochengewebes wandern Leukozyten in den infizierten Bereich ein, um eine weitere Ausbreitung der Erreger zu verhindern. Durch die Sekretion lytischer Enzyme kommt es zu einer Auflösung der Knochensubstanz. Dabei werden Knochenbezirke vom Blutstrom isoliert und nekrotisch. Erfolg der Knochenabbau unvollständig, bleibt ein Sequester zurück. Die Knochendestruktion ist stets von einer reaktiven Knochenneubildung (Osteosklerose) begleitet. Um einen Sequester wird das neugebildete Knochengewebe als Involucrum oder Totenlade bezeichnet.
Für die Persistenz der Erreger werden mehrere Mechanismen verantwortlich gemacht.
- Im Rahmen einer chronischen Osteomyelitis bilden die beteiligten Erreger auf den abgestorbenen Knochenanteilen Biofilme aus Muzinen, die sie vor den Angriffen des Immunsystems schützen und als Diffusionsbarriere wirken. Innerhalb dieser Biofilme verlangsamen die Mikroorganismen ihr Wachstum und sind nur mit extrem hohen Antibiotikadosen angreifbar, die allenfalls durch eine lokale Gabe erreicht werden können.
- Einige Erreger entziehen sich dem Immunsystem, indem sie Knochenzellen penetrieren und intrazelluläre Formen bilden.[3]
Symptome
Die Klinik der Osteomyelitis ist individuell verschieden und u.a. vom Verlauf und der Virulenz des Erregers abhängig.
Akute Osteomyelitis
Eine akut verlaufende Osteomyelitis führt meist zu typischen Entzündungszeichen. Die betroffene Stelle ist gerötet, warm und geschwollen. Es kommt zu einem ausgeprägten Belastungsschmerz und damit einer eingeschränkten Funktionstüchtigkeit. Als Allgemeinsymptome bestehen meist Fieber und ausgeprägtes Krankheitsgefühl. Es kommen aber auch blande Verläufe mit geringen Beschwerden und subfebrilen Temperaturen vor. Je nach Lokalisation können zusätzliche Symptome auftreten, z.B. Zahnlockerung bei Osteomyelitis des Unterkiefers.
Chronische Osteomyelitis
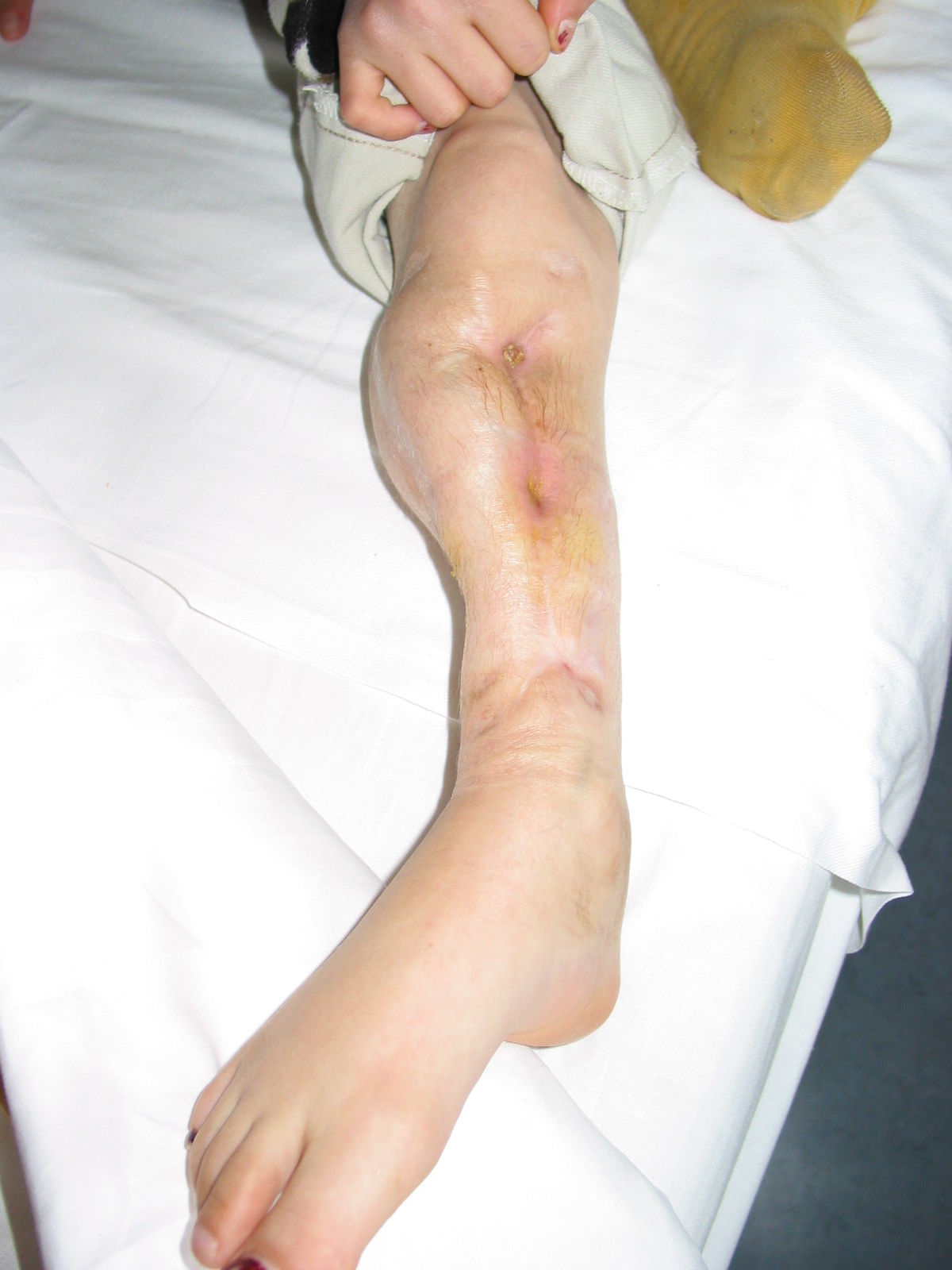
Die chronische Osteomyelitis verursacht geringere Allgemeinbeschwerden als die akute Form. Es kann aber durch die eingeschränkte Belastbarkeit des Knochens zu einer starken Behinderung der Beweglichkeit kommen. Häufig sind dumpfe, rezidivierende Schmerzen. Vom Infektionsherd können Fisteln ausgehen, aus deren Öffnung sich Eiter und Knochensequester entleeren. Als Reaktion auf die chronische Entzündung kommt es zu einer Verdickung der benachbarten Knochenareale. Wichtige Komplikationen sind pathologische Frakturen, die nur schwer bis gar nicht ausheilen und die Entwicklung von Pseudoarthrosen. Eine seltene Langzeitkomplikation der chronisch fistelnden Osteomyelitis ist die maligne Transformation in ein Plattenepithelkarzinom.[4]
Diagnostik
Anamnese und klinische Untersuchung
Bei der Anamnese sind vorangegangene Traumata und Risikofaktoren (Systemerkrankungen, Immundefizienz) zu erfragen.
Unter Umständen zeigt der Patient eine Schonhaltung (z.B. Entlastungshinken). Lokale Entzündungszeichen können vorhanden sein. Nur bei begleitender Periostitis findet sich ein lokaler Druckschmerz.[5] Bei Abszessdurchbruch sind Fluktuationen tastbar.[5]
Labor
Das Blutbild zeigt oft eine Leukozytose mit Linksverschiebung. Begleitet wird sie von erhöhten Entzündungswerten (CRP↑, ESR↑). Eine Ausnahme ist der Brodie-Abszess im Kindesalter. Der Erregernachweis kann per Blutkultur oder PCR erfolgen.
Biopsie
Eine Biopsie sowie eine Abstrichdiagnostik wird zur Erregeridentifizierung durchgeführt.
Bildgebung
Gesichert wird die Diagnose mit bildgebender Diagnostik:
Konventionelles Röntgen
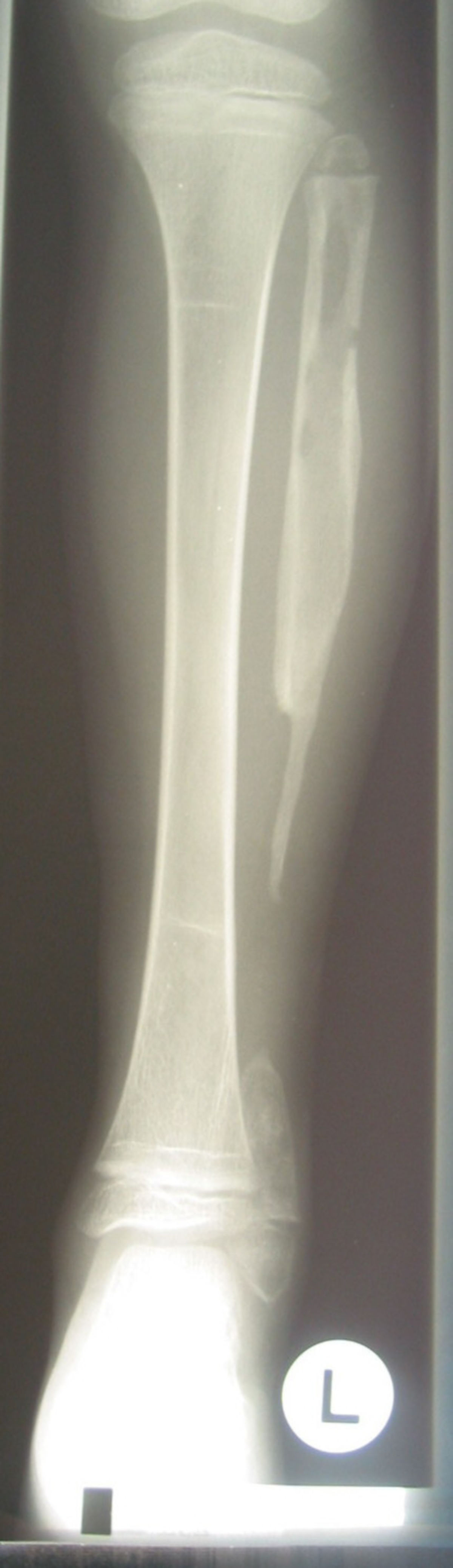
Frühestens am dritten Tag zeigt sich im Röntgenbild eine durch Zellulitis und Ödem bedingte Weichteilschwellung. Diese ist erkennbar an der Verlagerung und Konturunschärfe des perifaszialen Fettgewebes.
Gegen Ende der ersten Woche treten am Knochen die ersten sichtbaren Veränderungen in Form einer umschriebenen Osteopenie auf. Im Verlauf der zweiten und dritten Woche sind mottenfrassähnliche oder geographische Osteolysen erkennbar. Gleichzeitig kann eine solide oder lamelläre Periostreaktion vorliegen. Im späten Krankheitsstadien kann sich ein Sequester oder eine Totenlade entwickeln. Endostale und periostale Osteosklerosen führen im chronischen Stadium zu einer "paget-artigen" Veränderung des Knochens.
Magnetresonanztomographie
Die Magnetresonanztomographie (MRT) ist das sensitivste Verfahren (insbesondere im Frühstadium). Ein Knochenmarködem kann bereits 1 bis 2 Tage nach Erkrankungsbeginn nachgewiesen werden. Typische Zeichen im MRT sind:
- T1-Wichtung:
- intermediäres bis hypointenses Zentrum (Flüssigkeit)
- umgebendes Knochenmark mit geringerem Signal als normal aufgrund des Ödems
- Zerstörung der Kortikalis
- T2-Wichtung:
- Knochenmarködem
- hyperintenses Zentrum (Flüssigkeit)
- T1-Wichtung nach Kontrastmittelgabe:
- Enhancement von Knochenmark, Abszessrändern und Periost
Weitere Bildgebung
- Sonographie: Beurteilung der Weichteile und der angrenzenden Gelenke z.B. zum Nachweis eines Abszesses oder eines Gelenkergusses
- Skelettszintigraphie (Tc-99m): erhöhte Aufnahme im umgebenden Knochen
- Leukozytenszintigraphie (Indium-111), Gallium-67-Szintigraphie
- PET-CT: v.a. bei chronischer Osteomyelitis
Differentialdiagnosen
Die wichtigste Differentialdiagnose sind Knochentumoren (z.B. Ewing-Sarkom, Osteosarkom). Des Weiteren muss eine diabetische Osteoarthropathie (DNOAP) ausgeschlossen werden. Weitere Differenzialdiagnosen sind:
Therapie
Die Therapie ist abhängig von der auslösenden Ursache und meist langwierig.
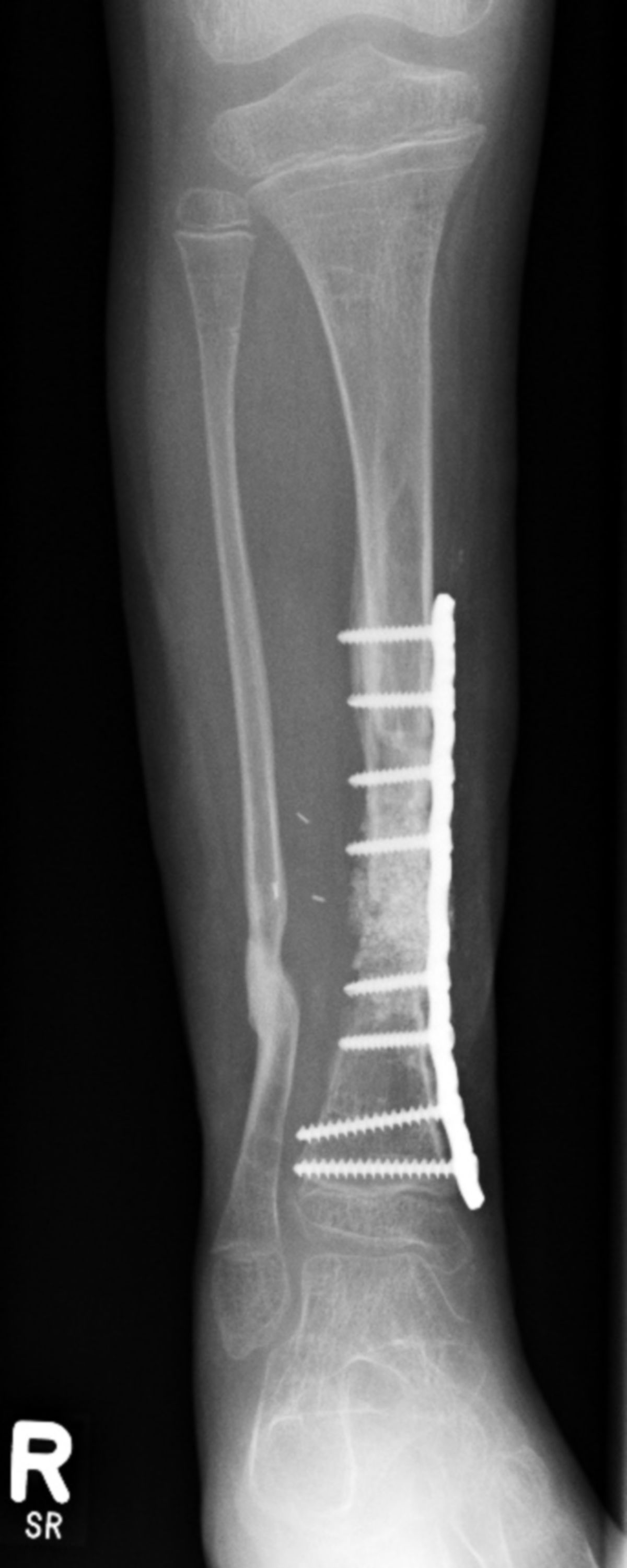
Mit Ausnahme hämatogener Osteomyelitiden ohne strukturelle Schäden muss jede Osteomyelitis chirurgisch therapiert werden.[5] Osteonekrosen sowie sequestrierte Knochenteile werden dabei ausgeräumt und Fisteln ausgeschnitten. Wenn vorhanden, erfolgt der Austausch des auslösenden Implantats. Durch die Einlage von Antibiotikaketten oder resorbierbaren Antibiotikaträgern wird versucht, die weitere bakterielle Besiedelung des Gewebes zu unterbinden.
Darüber hinaus ist eine längere intravenöse Antibiotikatherapie notwendig. Für die Dauer gibt es keine Evidenz, jedoch wird eine Behandlung über mindestens vier Wochen empfohlen. Die Wahl des Antibiotikums ist dabei von der Empfindlichkeit des Erregers abhängig. Bei Hospitalkeimen kann sie anspruchsvoll sein und die Verwendung von Reserveantibiotika erfordern, die schwere Nebenwirkungen verursachen können. Ergänzend kann eine hyperbare Sauerstofftherapie sinnvoll sein.
In therapieresistenten Fällen ist mitunter die Amputation des betroffenen Extremitätenabschnitts notwendig.
Quellen
- ↑ Cierny und Mader. Adult Chronic Osteomyelitis. Orthopedics, 7(10):1557-64. 2013
- ↑ Hofmann G. Chronische Osteitis. Infektionen der Knochen und Gelenke. München: Jena Urban & Fischer; 2004: 59–83.
- ↑ Sendi P, Proctor RA: Staphylococcus aureus as an intracellular pathogen: the role of small colony variants. Trends in Microbiology 2009; 17: 54–8.
- ↑ Die maligne Transformation einer chronisch fistelnden Osteomyelitis in ein Plattenepithelkarzinom – Kriterien zur Früherkennung und operativen Sanierung, DKOU, 2012
- ↑ 5,0 5,1 5,2 Suerbaum, Burchard, Kaufmann, Schulz (Hrsg.), Medizinische Mikrobiologie und Infektiologie. Springer Verlag, 9. Auflage, 2020. S. 1126