Eosinophile Granulomatose mit Polyangiitis
Synonyme: Churg-Strauss-Syndrom, Churg-Strauss-Vaskulitis, Churg-Strauss-Granulomatose
Englisch: eosinophilic granulomatosis with polyangiitis, Churg-Strauss syndrome, allergic angiitis and granulomatosis
Definition
Die eosinophile Granulomatose mit Polyangiitis, kurz EGPA, ist eine seltene Autoimmunkrankheit, die durch eine nekrotisierende granulomatöse Entzündung der kleinen und mittelgroßen Blutgefäße (Vaskulitis) sowie eine eosinophile Organinfiltration charakterisiert ist. Die Erkrankung ist mit allergischem Asthma und einer Eosinophilie assoziiert.
Nomenklatur
Die Erkrankung wurde ursprünglich als Churg-Strauss-Syndrom bezeichnet, nach den US-amerikanischen Pathologen Jakob Churg (1910-2005) und Lotte Strauss. 2012 wurde das Churg-Strauss-Syndrom in eosinophile Granulomatose mit Polyangiitis umbenannt.[1]
Epidemiologie
Die eosinophile Granulomatose mit Polyangiitis betrifft in der Regel 40- bis 60-jährige Erwachsene. Es besteht keine Geschlechtspräferenz. Die Inzidenz liegt zwischen 0,5 und 6,8 Erkrankungen pro 1 Million Einwohner und Jahr. Bei Asthmatikern beträgt die Inzidenz 34,6 bis 64,6 pro 1 Million Einwohner und Jahr. Die Prävalenz wird auf ca. 11 bis 13 Fälle pro 1 Millionen Einwohner geschätzt.
Ätiologie
Die Ätiologie der eosinophilen Granulomatose mit Polyangiitis ist derzeit (2023) nicht vollständig geklärt. Auffallend ist, dass die Schädigung der Blutgefäße durch IgE vermittelt ist und die Manifestation der Erkrankung zunächst an den Atemwegen erfolgt.
Dies legt den Schluss einer Immunkomplexerkrankung mit einer Überreaktion auf inhalative Noxen nahe. Eine abschliessende Bewertung steht jedoch noch aus. Als Triggerfaktoren gelten:
- Infektionen mit: Actinomyces, Aspergillus, Candida, Ascaris spp.
- Medikamente: Sulfonamide, Phenytoin, Leukotrienantagonisten
- Quarzstaub
- Impfungen
HLA-DRB1*04 und *07-Allele sowie HLA-DRB4-Gene sind mit einem erhöhten Risiko für die Entwicklung einer EGPA assoziiert.
Einordnung
Die eosinophile Granulomatose mit Polyangiitis wird – zusammen mit der Granulomatose mit Polyangiitis und der mikroskopischen Polyangiitis – in die Gruppe der ANCA-assoziierten Vaskulitiden (AAVs) der kleinen Gefäße eingeordnet.
Da die eosinophile Granulomatose mit Polyangiitis über die Gefäßläsionen hinaus durch eine eosinophilenreiche, granulomatöse Entzündung des Respirationstraktes charakterisiert ist, spricht man auch gelegentlich von der "allergischen Granulomatose und Angiitis".
Symptomatik
Krankheitsmerkmale
Häufige Krankheitsmerkmale der EGPA sind:
- Lungenbeteiligung mit eosinophiler Alveolitis (61 - 91 %),
- periphe neurologische Symptomatik mit Polyneuropathie oder Mononeuritis multiplex (51 - 77 %)
- Hautbeteiligung mit Purpura, Petechien, knotigen Auftreibungen und Ulzera (41 - 49 %)
- kardiale Beteiligung mit Myokarditis und/oder Kardiomyopathie, meist begleitet von Tachyarrhythmien (47 %)
Eine gastrointestinale Beteiligung mit Schleimhautulzera und Symptomen wie Diarrhöe, Erbrechen und kolikartigen Beschwerden findet sich dagegen seltener. Das gleiche gilt für die bei anderen Vaskulitiden häufige Nierenbeteiligung (Rapid progressive Glomerulonephritis).
Verlauf
Der Verlauf der Erkrankung ist mehrphasig. Die Faktoren, die für die Transformation des Krankheitsbildes in die verschiedenen Phasen verantwortlich sind, sind weitgehend unbekannt. Man unterscheidet modellhaft drei klinische Phasen:
- allergische Phase
- eosinophile Phase
- vaskulitische Phase
Allergische Phase
Die allergische Phase kann als Prodromalstadium der Erkrankung verstanden werden. 95 % der EGPA-Patienten sind Asthmatiker und weisen meist einen schweren, Glukokortikoid-abhängigen Verlauf auf. Weiterhin fallen eine chronische Rhinosinusitis, Nasenpoylpen und eine Otitis media auf.
Eosinophile Phase
Die eosinophile Phase ist gekennzeichnet durch:
- periphere Eosinophilie (> 1.500/mm3) oder alveoläre Eosinophilie (> 25 %)
- eosinophile Infiltrate von Lunge, Herz oder Gastrointestinalsystem (z.B. endomyokardiale Infiltrate, koronare Vaskulitis, Perikarditis, Klappenvitien, Bauchschmerzen, GI-Blutung)
Vaskulitische Phase
In der vaskulitischen Phase sind ca. 70 % der Patienten von einer peripheren Neuropathie mit Axonschaden und Mononeuritis multiplex betroffen. Weitere Befunde sind:
- Purpura: 25 % der Patienten. Insbesondere untere Extremität
- Allgemeinsymptome: Fieber, Müdigkeit, Gewichtsverlust
- Renale Manifestationen: Mikrohämaturie und Proteinurie bis hin zu rasch progredienter Glomerulonephritis
Phänotypen
Bei der Organbeteiligung der EGPA lassen sich zwei Phänotypen mit unterschiedlicher Genetik beschreiben:[2]
- prädominant vaskulitischer Typ (40 %): ANCA-positiv, meist p-ANCA gegen Myeloperoxidase (MPO-ANCA). Typischerweise mit Nierenbeteiligung, peripherer Neuropathie, Purpura und Vaskulitis. Die Klinik ähnelt der mikroskopischen Polyangiitis.
- prädominant eosinophiler Phänotyp (60 %): ANCA-negativ. Typischerweise mit kardialer Beteiligung (Endomyokarditis), eosinophiler Pneumonie und Fieber.
Der vaskulitische Phänotyp zeigt eine Assoziation zum humanen Leukozytenantigen HLA-DQ, während dieser Zusammenhang bei dem eosinophilen Phänotyp nicht gefunden wurde.
Diagnostik
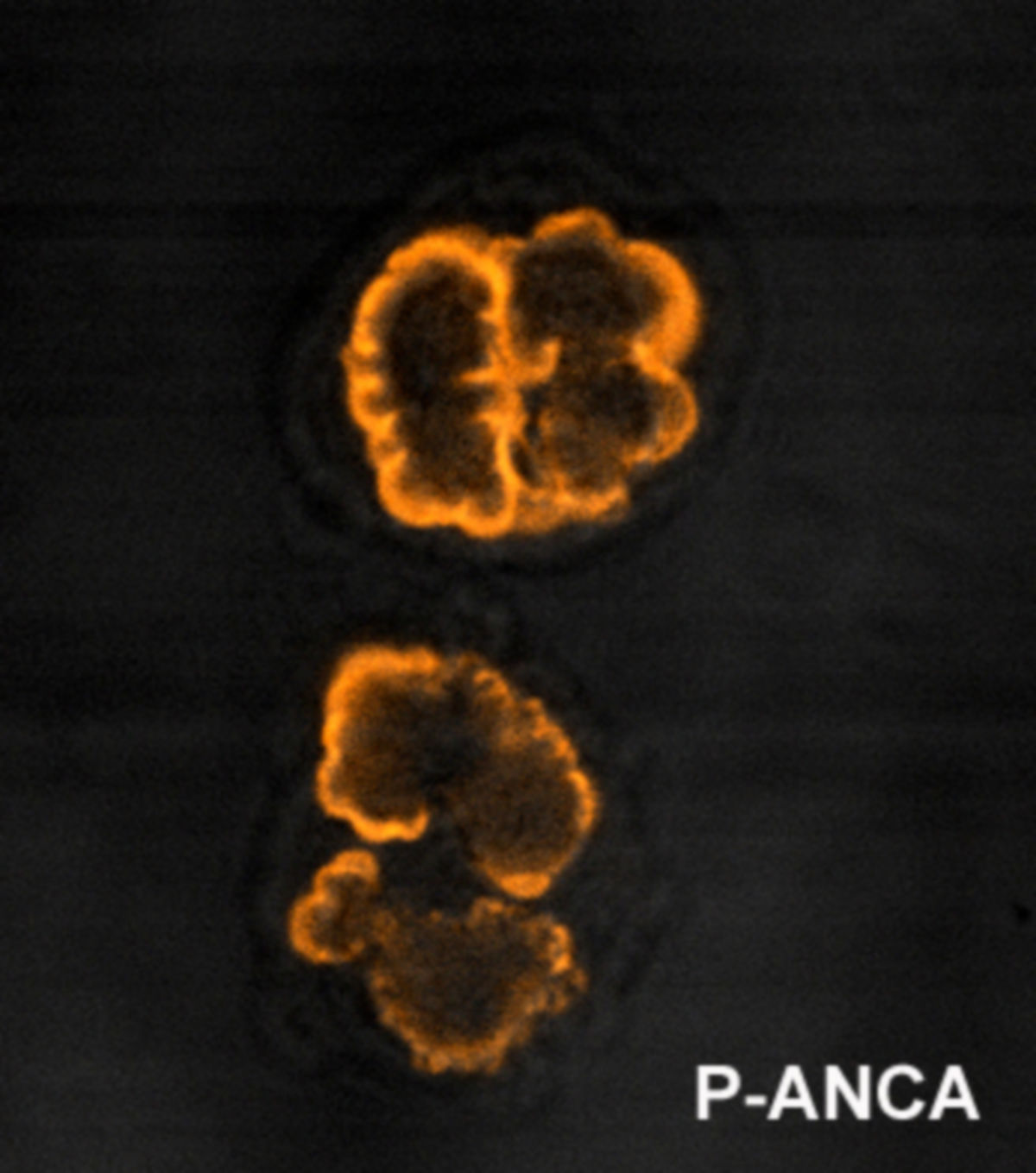
Ein erster Hinweis ist die erhöhte BSG. Im Blutbild fällt eine mäßige Leukozytose mit einer relativen Eosinophilie auf. Das Gesamt-IgE im Serum ist erhöht. Typisch für die EGPN ist der Nachweis von p-ANCA in der Immunfluoreszenz bzw. nach neuerer Empfehlung von MPO-ANCA im ELISA. Diese Antikörper werden allerdings in einem hohen Prozentsatz nicht gefunden, sodass ihr fehlender Nachweis eine EGPA nicht sicher ausschließt.
Als bildgebende Verfahren eignen sich Nasennebenhöhlen-CT (Schleimhautschwellung, Polypen) und ein Röntgen-Thorax (pulmonale Herde) zur Stärkung des Verdachts.
Da sich in bis zu 50% der Fälle eine kardiale Beteiligung zeigt, die subklinisch verlaufen kann, sollte eine erweiterte kardiale Diagnostik mit Bestimmung von NT-proBNP, EKG, Langzeit-EKG, Echokardiographie und Kardio-MRT in Erwägung gezogen werden. Die weitere Diagnostik richtet sich nach der individuellen Symptomatik (z.B. neurologische Diagnostik).
Zur Diagnoseklärung kann nach Risikoabschätzung die pathohistologische Untersuchung einer Biopsie aus betroffenen Organen erfolgen. Diese zeigt noduläre Veränderungen und eine Infiltration der Gefäßwände von Arteriolen und Venolen durch Makrophagen und eosinophile Granulozyten. In den Läsionen sind IgE-haltige Immunkomplexe nachweisbar.
Bei typischer Klinik und Nachweis von p-ANCA bzw. MPO-ANCA kann unter Umständen auch auf eine Biopsie verzichtet werden. Dabei ist zu berücksichtigen, dass ANCA auch im Rahmen anderer Krankheitsbilder auftreten können, z.B. bei einer bakteriellen Endokarditis.
Radiologie
Im Röntgen-Thorax finden sich oft nicht-segmentale, multifokale Verschattungen, diffuse retikulonoduläre Verschattungen, Bronchialwandverdickungen und seltener Lungenrundherde.
In der CT sind die typische Zeichen der EGPA migratorische, zufällig verteilte, fleckige Milchglastrübungen und Konsolidierungen, die der eosinophilen Infiltration der Alveolen und Alveolarwänden entsprechen. Auch eine Verdickung der Interlobulärsepten (durch eosinophile Infiltrate und/oder interstitielles Lungenödem bei kardialer Beteiligung) sowie Bronchialwandverdickungen (durch eosinophile und lymphozytäre Infiltration) liegen oft vor. Weitere mögliche Befunde sind:
- Lungenrundherde: 1 bis 3 cm, entsprechen Arealen von pulmonaler Hämorrhagie, nekrotisierender Granulome oder eosinophiler Infiltration.
- Crazy Paving
- Zentrilobuläre Mikronoduli, ggf. mit Tree-in-Bud-Muster: entsprechen eosinophilen und lymphozytären Infiltrationen der Wände der Bronchiolen
- Bronchiektasen
- Mosaikmuster
- pulmonale Raumforderungen (> 3 cm)
- Halo-Zeichen
- Atoll-Zeichen
- mediastinale Lymphadenopathie
- Pleuraergüsse, Perikardergüsse
Bei V.a. kardiale Beteiligung kann eine Kardio-MRT durchgeführt werden. Neben Wandbewegungsstörungen finden sich eine fokale Fibrose und/oder eine Obliteration des rechten Ventrikels. Bei Endomyokarditis kommt es zu einem myokardialen, subepikardialen und/oder subendokardialen Late Enhancement.
Diagnosekriterien
Nach den 2022 überarbeiteten ACR/EULAR-Kriterien sind mindestens 6 Punkte in der folgenden Matrix notwendig, um die Diagnose einer eosinophilen Granulomatose mit Polyangiitis zu stellen:
| Kriterien | Punkte |
|---|---|
| Asthma | + 3 |
| Nasale Polypen / chronische Rhinosinusitis | + 3 |
| Mononeuritis multiplex oder periphere Neuropathie | +1 |
| Pulmonale Infiltrate in der Bildgebung (nicht durch andere Ursache erklärt) | +2 |
| Eosinophilie ≥ 1 × 10⁹/l (oder ≥ 10 % der Leukozyten) | + 5 |
| Histopathologisch eosinophile Infiltrate extravaskulär | + 2 |
| ANCA negativ (c- oder p-ANCA) | + 3 |
| ANCA positiv (MPO, PR3) | - 3 |
In den älteren Diagnosekritierien der American College of Rheumatology (ACR) von 1990 war das Hauptkriterium der pathohistologische Nachweis einer Vaskulitis in einer Biopsie. Zusätzlich mussten mindestens vier der folgenden sechs Kriterien vorliegen:[3]
- Asthma
- Eosinophilie ( >10 % im Blut)
- Mononeuropathie oder Polyneuropathie
- Pulmonale Infiltrate (zum Teil nur vorübergehend)
- Sinusitis der Nasennebenhöhlen
- Extravaskuläre eosinophile Gewebeinfiltration
Differenzialdiagnosen
- Allergische bronchopulmonale Aspergillose (ABPA): periphere Eosinophilie (> 1.000/mm3) und erhöhtes IgE, Asthma bronchiale, Aspergillus-spezifische Antikörper, Bronchiektasen, Bronchialwandverdickungen und Mukusimpaktionen
- Chronische eosinophile Pneumonie: periphere Hypereosinophilie (20 - 30 % der Leukozyten), Asthma bronchiale (75 % der Fälle), keine extrapulmonalen Manifestationen, ANCA meist negativ, subpleurale Milchglastrübungen oder Konsolidierungen, betont im Oberlappen
- Granulomatose mit Polyangiitis (GPA): gelegentlich signifikante Eosinophilie, kein Asthma, cANCA positiv, Beteiligung der Nasennebenhöhlen, Lungenrundherde ggf. mit Kavität
- Hypereosinophiles Syndrom (HES): periphere Eosinophilie (> 1.500/mm3) für mindestens 6 Monate, Organdysfunktion durch eosinophile Infiltration, typischerweise ANCA-negativ, keine Vaskulitis in der Biopsie, fleckige Milchglastrübungen oder Konsolidierungen und Mikronoduli
- IgG4-assoziierte Erkrankung: allergische Manifestationen, periphere Eosinophilie, storiforme Fibrose in der Biopsie, keine Vaskulitis, Verdickung der Trachealwand und Bronchialwand (ggf. mit Stenose), Rundherde, Konsolidierungen und fleckige Milchglastrübungen
Therapie
Die Therapie von EGPA-Patienten sollte an einem spezialisierten Zentrum durchgeführt werden, das über ausreichende Erfahrung verfügt. Die medikamentöse Behandlung basiert auf der Gabe von Immunsuppressiva. Bei einer aktiven Erkrankung wird zunächst eine Induktionstherapie durchgeführt, um eine Remission zu erreichen. Danach erhält der Patient eine remissionserhaltende Therapie.
Induktionstherapie
Die Remissionsinduktion stützt sich zunächst auf die hochdosierte Gabe von Glukokortikoiden (z.B. Prednisolon) zur Reduktion der Entzündung. Bei organbedrohendem Verlauf (z.B. Nierenversagen) ist die Gabe des Zytostatikums Cyclophosphamid indiziert.
Bei nicht organbedrohendem Verlauf werden Azathioprin oder Methotrexat in Kombination mit Glukokortikoiden empfohlen.
Eine weitere Therapieoption ist die Behandlung mit dem humanisierten monoklonalen Antikörper Mepolizumab. Mepolizumab ist ein monoklonaler Anti-Interleukin-5-Antikörper.[4]
Erhaltungstherapie
Da die EGPA auch nach einer initial erfolgreichen Therapie zu Rezidiven neigt, wird nach Erreichen einer Remission eine Erhaltungstherapie angeschlossen. Dafür werden niedrigdosierte Glukokortikoide und ein zusätzliches Immunsuppressivum (z.B. Azathioprin oder Methotrexat) verabreicht.
Prognose
Die Prognose der EGPA ist grundsätzlich gut. Das 5-Jahres-Überleben beträgt etwa 97 %. Negative prognostische Faktoren sind Alter > 65 Jahre, kardiale und gastrointestinale Beteiligungen sowie eine Niereninsuffizienz.
Literatur
- Moosig: ANCA-assoziierte Vaskulitiden: Eosinophile Granulomatose mit Polyangiitis (EGPA, Churg-Strauss-Syndrom) Springer Medizin, e.Medpedia, 2014
- Cottin V. Eosinophilic Lung Diseases. Clin Chest Med. 2016
- Cottin V et al; GERM“O”P. Respiratory manifestations of eosinophilic granulomatosis with polyangiitis (Churg-Strauss). Eur Respir J. 2016
- Price M et al. Imaging of Eosinophilic Lung Diseases. Radiol Clin North Am. 2016
- Greco A et al. Churg-Strauss syndrome. Autoimmun Rev. 2015
- Dennert RM et al. Cardiac involvement in Churg-Strauss syndrome. Arthritis Rheum. 2010
- Silva CI et al. Churg-Strauss syndrome: high resolution CT and pathologic findings. J Thorac Imaging. 2005
Quellen
- ↑ Jennette et al. Overview of the 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides, Clin Exp Nephrol, 2014
- ↑ Krasselt et al. ANCA-assoziierte Vaskulitis, Die Innere Medizin, Band 63, Heft 9, September 2022, S. 947 ff
- ↑ Arzneimitteltherapie - Eosinophile Granulomatose und Polyangiitis (Churg-Strauss-Syndrom), abgerufen am 25.01.2022
- ↑ EMA - Nucala, abgerufen am 26.01.2022