CAR-T-Zell-Therapie
Englisch: CAR T cell therapy
Definition
Die CAR-T-Zell-Therapie ist eine Krebsimmuntherapie, die auf gentechnisch veränderten T-Zellen mit synthetischen antigenspezifischen Rezeptoren basiert. CAR steht für "chimärer Antigenrezeptor" bzw. "chimeric antigen receptor".
Biochemie
Chimäre Antigenrezeptoren vereinigen verschiedene Aspekte der T-Zell-Aktivierung in einem Protein. Sie bestehen aus einer extrazellulären Antigen-bindenden Domäne, bei der es sich in der Regel um ein von Antikörpern abgeleitetes scFv ("single-chain variable fragment") handelt. Außerdem besitzen sie eine Transmembrandomäne und eine Endodomäne aus aktivierenden Bestandteilen des T-Zell-Rezeptor-Komplexes.
Von den CAR-T-Zellen abgegrenzt werden T-Zellen mit antigen-spezifischen chimären Autoantikörper-Rezeptoren (CAARs), die CAAR-T-Zellen.
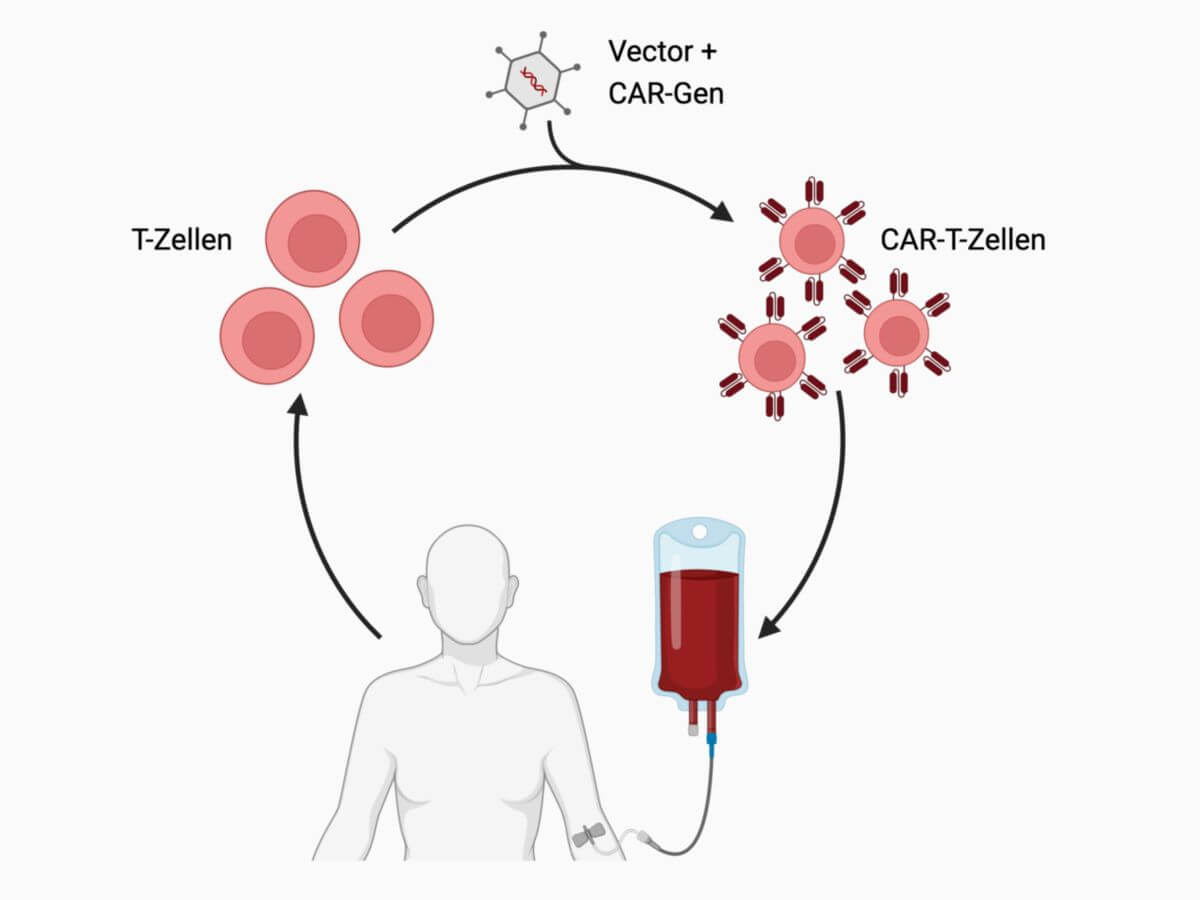
Herstellung
Die CAR-T-Zell-Therapie ist eine Individualtherapie. Dem Patienten werden zunächst durch eine Leukozytapherese T-Zellen aus dem Blut entnommen ("Harvesting"). Die T-Zellen werden im Labor selektiert und durch Einsatz von Zytokinen (Interleukin-2) klonal vermehrt. Anschließend werden sie durch Transduktion gentechnisch so verändert, dass sie chimäre Antigenrezeptoren auf der Zelloberfläche bilden, die gegen krebsspezifische Oberflächenproteine gerichtet sind. Dazu verwendet man Gammaretroviren (RV) oder Lentiviren (LV). Die veränderten Zellen werden dem Patienten reinfundiert.
Indikationen
Grundsätzlich lässt sich das Prinzip der CAR-T-Zell-Therapie auf alle Tumoren anwenden, die gut abgrenzbare Antigeneigenschaften zu gesunden Geweben haben. Eine Voraussetzung ist, dass passende Antikörper gegen dieses Antigen entwickelt werden können. CAR-T-Zell-Therapie ist gegenwärtig (2026) die Standard-Salvagetherapie bei refraktären B-Zell-Lymphomen und beim multiplen Myelom.
Solide Tumoren sind aus verschiedenen Gründen schwieriger durch CAR-T-Zellen zu erreichen. Es gibt nur wenige Zielmoleküle, die zuverlässig und spezifisch von soliden Tumoren exprimiert werden. Darüber hinaus müssen CAR-T-Zellen histologische Barrieren überwinden, um die Tumorzellen zu erreichen.
Behandlungsvorbereitung
Vor Beginn der CAR-T-Zell-Therapie muss mit Hilfe einer Chemotherapie eine Lymphozytendepletion durchgeführt werden. Diese Maßnahme reduziert die Anzahl zirkulierender Leukozyten, was die Zytokinproduktion anregt und die Expansion der CAR-T-Zellen unterstützt. Häufig verwendete Arzneistoffe sind Fludarabin und Cyclophosphamid.
Video: CAR-T-Zell-Therapie
Wirkmechanismus
Die Wirkung einer CAR-T-Zell-Therapie beruht darauf, dass die CAR-T-Zellen bestimmte Antigene (z.B. CD19) auf den Tumorzellen erkennen und die entsprechenden Zellen durch ihre zytotoxische Aktivität zerstören. Ein wesentlicher Vorteil von CARs gegenüber nativen T-Zell-Rezeptoren ist ihre Fähigkeit, Antigene unabhängig von der Peptidpräsentation über MHC-Klasse-I-Moleküle zu erkennen. Daher können Tumorzellen auch dann noch wirksam von CAR-T-Zellen angegriffen werden, wenn sie die MHC-I-Expression im Rahmen der Immunevasion herunterregulieren. So kann eine Antitumorimmunität gegen schwach immunogene Tumoren aufgebaut werden, die sonst einer Immuntherapie nicht zugänglich wären.
Die Effektivität der zytotoxischen Wirkung der CAR-T-Zellen wird wahrscheinlich durch das intestinale Mikrobiom beeinflusst. Im Tierexperiment konnte gezeigt werden, dass Metabolite von Akkermansia-Bakterien den Aryl-Hydrocarbon-Rezeptor (Ah-Rezeptor) von T-Zellen aktivieren, was sie in die Lage versetzt, besser in das Knochenmark u.a. Organe einzudringen und verstärkt Interferon-gamma zu bilden.[1]
Nebenwirkungen
Immuntoxizität
CAR-T-Zell-Therapien stellen in der Onkologie einen therapeutischen Fortschritt dar, sind aber oft mit schweren Nebenwirkungen verbunden. Die bedeutendste Nebenwirkung ist das Zytokin-Freisetzungssyndrom (CRS), bei dem es zu einer Überaktivierung des Immunsystems mit massiver Freisetzung proinflammatorischer Zytokine kommt. Das CRS manifestiert sich u.a. durch Fieber, Exanthem, Myalgie und Tachykardie, bei schwereren Verläufen durch eine Leber- und Niereninsuffizienz. Ein CRS tritt bei fast allen Patienten auf und ist auch ein Zeichen dafür, dass die Therapie anschlägt. Ab einem bestimmten Schweregrad (CRS Grad 4) ist diese Reaktion jedoch lebensbedrohlich. Patienten mit CRS können z.B. mit Tocilizumab behandelt werden.
Neurotoxizität
Darüber hinaus wirkt eine CAR-T-Zell-Therapie potentiell neurotoxisch, was unter dem klinischen Bild des Immuneffektorzell-assoziiertes Neurotoxizitätssyndroms (ICANS) zusammengefasst wird. Der Auslösemechanismus dieser Nebenwirkung ist noch nicht geklärt. Symptome sind u.a. Kopfschmerzen, Schwindel, Tremor, periphere Neuropathie, Sprachstörungen, Krampfanfälle, Neuralgien, ischämische Hirninfarkte, Delirium, Angst und Schlafstörungen. Die Symptome treten gewöhnlich eine Woche nach der Infusion auf. Die Enzephalopathie bzw. das zerebrale Ödem kann potentiell tödlich verlaufen. Daher müssen Patienten nach der Behandlung noch bis zu 2 Wochen im Krankenhaus überwacht werden. Weiterhin kann ein klinischer Score hilfreich sein, um Patienten mit geringem Risiko für neurologische Nebenwirkungen zu identifizieren, die schon früher entlassen werden können:[2][3]
| Faktor | Punkt |
|---|---|
| Alter ≥ 52 J | 1 |
| CRP-Spitzenwert ≥ 8,95 mg/dl | 1 |
| Serum-Ferritin-Spitzenwert ≥ 641 ng/ml | 1 |
| Leukozytenzahl ≤ 790/µl | 1 |
| Auftreten eines CRS vor Tag 3 der Therapie | 1 |
| aggressiver histologischer Subtyp | 2 |
| Höchsttemperatur ≥ 38,3 °C | 2 |
| Auftreten eines CRS bis Tag 5 der Therapie | 2 |
| Behandlung mit Tocilizumab vor Tag 5 | 3 |
Der Score reicht von 0 bis 14 Punkte. Der Cut-off-Wert liegt bei 6 Punkten und sagt das Auftreten von neurologischen Nebenwirkungen mit einer Sensitivität von 82 % und einer Spezifität von 70 % vorher. Patienten mit einem Score ≤ 2 könnten frühzeitig entlassen werden.
Hämatotoxizität
Ab dem zweiten Monat nach der Behandlung kann es unabhängig von der Art des Antigens, gegen das der CAR gerichtet ist (CD19, BCMA, GD2, Claudin 18.2), zu einer Schädigung der Hämatopoese kommen. CAR-T-Zellen exprimieren den CXCR4-Rezeptor, der es ihnen erlaubt, sich im Knochenmark an hämatopoetische Stamm- und Vorläuferzellen zu binden. Es kommt zur Ausschüttung von Zytokinen, welche die Hämatopoese, vor allem die Megakaryopoese schädigen, sodass es zur Thrombozytopenie kommt.[4]
Parallel dazu werden verstärkt mutierte Vorläuferzellen (z.B. mit TET2-, DNMT3A-, ASXL1- oder PPM1D-Mutationen) freigesetzt, die als frühe Vorläufer einer myeloproliferativen Erkrankung gelten.
Kanzerogenität
Unter einer Therapie mit CAR-T-Zellen ist durch Insertionsmutagenese die Entstehung von Sekundärmalignomen möglich. Das geschieht, wenn sich CAR-Gene an der falschen Stelle in das Genom der T-Zellen integrieren. In der Folge kann es zur verstärkten Expression eines in der Nähe befindlichen Onkogens oder zur Suppression eines Tumorsuppressorgens kommen.[5] Diese Abläufe können dann CAR-T-Zell-Lymphome oder eine CAR-T-Zell-Leukämie triggern.
Diese Gefahr wurde schon in den ersten klinischen Studien erkannt. Deshalb wurden von der FDA alle Hersteller von CAR-T-Zell-Präparaten zu einer Nachbeobachtung der Patienten über 15 Jahre nach der Behandlung verpflichtet.[6] Das Risiko wird bisher als gering erachtet.[7] In den USA wurden seit 2017 ca. 27.000 CAR-T-Zelltherapien durchgeführt. Der FDA wurden bis Ende 2023 insgesamt 22 Fälle von T-Zell-Malignomen bekannt, von denen in 3 Fällen das CAR-Transgen im bösartigen Zellklon durch genetische Sequenzierung nachgewiesen werden konnte.[8]
Die EMA hat im Januar 2024 ein Signalverfahren zu CAR-T-Zell-Therapien ausgelöst und 38 Fälle von T-Zell-Malignomen bewertet, die nach der Behandlung mit CAR-T-Zell-Therapien bis April 2024 gemeldet wurden. Diese Fälle sind innerhalb von Wochen bis zu mehreren Jahren nach einer Therapie mit CAR-T-Zellen aufgetreten. Einige Fälle hatten einen tödlichen Verlauf. In 7 Fälle wird von einer Insertionsmutagenese der sekundären Malignome ausgegangen.[9][10][11]
Todesursachen
Die häufigste Todesursache unter einer CAR-T-Cell-Therapie sind nicht beherrschbare Infektionen (50,9 %), gefolgt von Todesfällen durch sekundäre Tumoren (7,8 %) sowie kardiovaskuläre und/oder respiratorische Komplikationen (7,3 %). Das Immuneffektorzell-assoziierte Neurotoxizitätssyndrom oder das Zytokin-Freisetzungssyndrom führen in 11,5 % der Behandlungsfälle zum Tod. Die nicht-rückfallbedingte Sterblichkeit hängt sowohl vom Primärtumor als auch vom eingesetzten Präparat ab.[12]
Neue Ansätze
Tandem CAR
Neben einer z.T. begrenzten Tumorinfiltration können auch eine nachlassende Antitumoraktivität sowie ein Antigenverlust (CAR-T-Zell-Escape) vorkommen. So schreitet bei über 50 % der Patienten mit DLBCL, die mit gegen CD19 gerichteten chimären Antigenrezeptor-T-Zellen (CAR19) behandelt werden, die Erkrankung aggressiv fort. Um das Rezidivrisiko zu senken, wurden bispezifische Ansätze entwickelt, die sowohl gegen CD19 als auch gegen CD22 gerichtet sind. Diese dualen CAR-T-Zellen (Tandem CAR) werden derzeit (2023) im Rahmen von klinischen Studien bei rezidivierter oder refraktärer akuter lymphatischer B-Zell-Leukämie und beim großzelligem B-Zell-Lymphom eingesetzt.
Allogene CAR-T-Zellen
Der Einsatz von allogenen T-Zellen von gesunden Spendern zur Gewinnung von CAR-T-Zellen wird derzeit erforscht. Dadurch könnten insgesamt mehr Zellen zur Verfügung stehen, die auch kryokonserviert aufbewahrt werden können. Weiterhin wäre eine standardisierte Herstellung und eine Reduktion der Kosten möglich. Denkbare Komplikationen sind die schnelle Elimination der allogenen CAR-T-Zellen durch das Immunsystem des Empfängers oder eine Graft-versus-Host-Reaktion des Empfängers gegen die Spenderzellen.
Adapter-CAR-T-Zellen
Bei Adapter-CAR-T-Zellen werden klassische CAR-T-Zellen mit rekombinanten Antikörpern kombiniert:
- Fc-bindend: spezielle Tumorbindungsdomäne
- TAG-bindend: extrazelluläre Domäne, die chemisch, enzymatisch oder genetisch gebundene Signale auf tumorspezifischen Adaptermolekülen erkennt
- Bispezifisch Antikörper-bindend: duale Spezifität gegen tumorspezifisches Antigen und Immunrezeptor (z.B. CD3)
TCR-Ts
Einen möglichen komplementären Ansatz zur CAR-T-Zell-Therapie bilden T-Zellen mit tumorspezifischen T-Zellrezeptoren (TCR-Ts). Sie richten sich nicht gegen Oberflächenproteine, sondern gegen Peptide, die vom MHC-Klasse-I-Komplex der Tumorzelle präsentiert werden. Mit TCR-Ts lässt sich ggf. auch eine T-Zell-Reaktion gegen intrazelluläre Tumorantigene triggern.
TRUCKs
Bei TRUCKs ("T cells redirected for universal cytokine-mediated killing") handelt es sich um die 4. Generation der CAR-T-Zellen. Der wesentliche Unterschied ist, dass die Spezifität von CAR-T-Zellen mit dem zusätzlichen Potenzial einer aktivierungsabhängigen Zytokinfreisetzung kombiniert wird. Durch die Zytokine werden andere zirkulierende Immunzellen aktiviert, migrieren in die Tumorumgebung und verstärken so lokal die Tumorbekämpfung. Die modifizierten CAR-T-Zellen sezernieren hierzu nach Antigenbindung Zytokine wie Interleukin-12 und Interleukin-18, aber auch Enzyme und kostimulatorische Liganden.
Arzneistoffe
Bereits zugelassene CAR-T-Zell-Therapien sind (Stand 2023):
- Tisagenlecleucel (Kymriah®): bei akuter lymphatischer Leukämie (ALL) der B-Zellreihe und diffus großzelligem B-Zell-Lymphom (DLBCL)
- Axicabtagen-Ciloleucel (Yescarta®): bei primär mediastinalem B-Zell-Lymphom (PMBCL) sowie DLBCL
- Brexucabtagen-Autoleucel (Tecartus®): bei erwachsenen Patienten mit rezidiviertem oder refraktärem Mantelzell-Lymphom (MCL)
- Idecabtagen-Vicleucel (Abecma®): Bei Patienten mit multiplem Myelom, die zuvor mindestens drei Therapien erhalten haben, einschließlich eines Immunmodulators, eines Proteasominhibitors und eines Anti-CD38-Antikörpers (Daratumumab, Isatuximab) und deren Zustand sich seit der letzten Behandlung verschlechtert hat.
- Ciltacabtagen-Autoleucel (Carvykti®): Therapie des multiplen Myeloms
- Lisocabtagen-Maraleucel (Breyanzi®): bei DLBCL, PMBCL und follikulärem Lymphom
In klinischer Forschung befinden sich Anti-BCMA-CAR-T-Zellen bei Patienten mit Multiplem Myelom sowie die Anwendung von CAR-T-Zellen beim systemischen Lupus erythematodes (Rapcabtagen-Autoleucel).
Quellen
- ↑ Marcos-Kovandzic L et al. Gut microbiota composition is predictive of CAR-T cells response and its modulation enhances CAR-T cells activity. European Society for Medical Oncology (ESMO) Barcelona 2024, Abstract 804MO, abgerufen am 30.09.2024
- ↑ Rubin DB et al. Neurological toxicities associated with chimeric antigen receptor T-cell therapy, Brain. 2019
- ↑ Rubin DB et al. Clinical Predictors of Neurotoxicity After Chimeric Antigen Receptor T-Cell Therapy, JAMA Neurol. 2020
- ↑ Khelil MB. et al. CAR T cells reside in the bone marrow and inhibits healthy hematopoiesis. European Society for Medical Oncology (ESMO) Barcelona 2024, Abstract 803MO, abgerufen am 30.09.2024
- ↑ Verdun N, Marks P. Secondary Cancers after Chimeric Antigen Receptor T-Cell Therapy. N Engl J Med. 2024
- ↑ FDA Investigating Serious Risk of T-cell Malignancy Following BCMA-Directed or CD19-Directed Autologous Chimeric Antigen Receptor (CAR) T cell Immunotherapies. FDA 28.11.2023, abgerufen am 26.11.2024
- ↑ Ghilardi G et al. T-cell Lymphoma and Secondary Primary Malignancy Risk After Commercial CAR T-cell Therapy. Nat Med. 2024
- ↑ Verdun N, Marks P. Secondary Cancers after Chimeric Antigen Receptor T-Cell Therapy. N Engl J Med. 2024
- ↑ Start of safety review of CAR T-cell medicines. EMA PRAC Meeting 08.-11.01.2024, abgerufen am 26.01.2024
- ↑ Signalbewertungsverfahren zu CAR-T-Zell-Therapien gestartet. PEI 26.01.2024, abgerufen am 22.02.2024
- ↑ CD19- oder BCMA-gerichtete CAR-T-Zelltherapien (Abecma, Breyanzi, Carvykti, Kymriah, Tecartus und Yescarta): Risiko von sekundären Malignomen mit T-Zell-Ursprung. Rote Hand Brief am 18.07.2024, abgerufen am 18.07.2024
- ↑ Cordas Dos Santos DM et al. A systematic review and meta-analysis of nonrelapse mortality after CAR T cell therapy. Nat Med. 2024