Unspezifisches Immunsystem
Synonyme: angeborenes Immunsystem, unspezifische Immunantwort, unspezifische Immunabwehr, unspezifische Immunreaktion, angeborene Immunreaktion
Englisch: innate immune system
Definition
Das unspezifische Immunsystem ist der Teil des körpereigenen Immunsystems, der von Geburt an vorhanden ist. Die unspezifische Immunantwort setzt ein, sobald der Körper auf Pathogene trifft und umfasst physikalische und chemische Barrieren sowie bestimmte Proteine und Immunzellen.
Hintergrund
Die unspezifische Immunreaktion basiert auf einem phylogenetisch sehr alten System der Abwehrmechanismen, welches man bei fast allen vielzelligen Organismen wiederfindet. Der phylogenetisch jüngere Anteil der Immunabwehr, das erworbene Immunsystem, basiert hingegen auf einer spezifischen Erkennung von Antigenen durch T- und B-Lymphozyten über klonale Rezeptoren. Die beiden Systeme interagieren zusammen und bedingen sich gegenseitig.
Funktionen
Zu den wichtigsten Funktionen des unspezifischen Immunsystems zählen:
- Aufbau einer physikalischen und chemischen Barriere gegenüber Fremdkörpern
- Auslösung einer Entzündungsreaktion beim Durchbrechen der Barriere
- Rekrutierung von Immunzellen an den Ort einer Infektion durch Zytokine
- Aktivierung der Kaskadenabläufe des Komplementsystems, um Erreger zu opsonisieren und Immunzellen zu aktivieren
- Identifizierung und Phagozytose von Fremdsubstanzen durch Leukozyten
- Aktivierung der adaptiven Immunantwort
Barriereelemente
Die Barriereelemente des Körpers bilden eine erste Verteidigungslinie des Immunsystems, die das Eindringen körperfremder Stoffe durch seine äußeren und inneren Oberflächen verhindert.
Haut
Das Stratum corneum der Haut ist eine dichte Barriere aus Keratin, welche die darunter liegenden Zellen vor chemischen, physikalischen und biologischen Noxen abschirmt. Das Epithelgewebe ist durch Tight Junctions fest verbunden. Die Talgdrüsen produzieren ein Sekret, das diese Hornschicht durch Lipide gegenüber Quellung schützt und antimikrobielle Peptide enthält. Zusätzlich sezernieren ekkrine Schweißdrüsen ein saures Sekret, das Immunglobuline enthält. Die residente Hautflora stellt sich auf diese Faktoren ein und bildet ein Mikrobiom, das in Konkurrenz zu pathogenen Mikroorganismen steht. Durch Desquamation der oberen Hautschichten wird diese bakterielle Besiedelung weitgehend konstant gehalten. Eine Schädigung dieser Barriere ist ein häufiger Ausgangspunkt für Infektionen, z.B. bei einer Superinfektion nach Verbrennungen oder bei Neurodermitis.
Respirationstrakt
Im Respirationstrakt sorgen die Muzine der Becherzellen für ein Trapping der Erreger. Durch die mukoziliäre Clearance und Husten werden Mikroorganismen und Fremdkörper vom respiratorischen Epithel aus den Atemwegen entfernt. Zusätzlich sorgen antimikrobielle Substanzen wie Lysozyme, Defensine und Surfactant für eine Erregerabwehr. Beim seltenen Kartagener-Syndrom bestehe eine Dysfunktion der Zilien. Dies führt zu rezidivierenden Bronchitiden und Sinusitiden.
Gastrointestinaltrakt
Im Gastrointestinaltrakt werden Mikroorganismen durch die Salzsäure im Magensaft sowie aggressive Enzyme (Pepsin, Lipasen) und Gallensäuren deaktiviert. Zusätzlich töten Immunglobuline (IgA, IgE) und Laktoferrin Fremdorganismen ab. Große Erregermengen können durch eine beschleunigte Peristaltik eliminiert werden. Das Darmmikrobiom im Colon ist ein komplexes Ökosystem, das pathogenen Erregern die Ansiedelung erschwert.
Humorale Elemente
Humorale Faktoren des unspezifischen Immunsystems sind im Blut zirkulierende Proteine, die der direkten Abwehr von Pathogenen sowie der Einleitung der spezifischen Immunreaktion dienen. Sie sind Teil des humoralen Immunsystems.
Komplementsystem
Sind Erreger trotz der Barriereelemente in den Organismus eingedrungen, werden sie vom Komplementsystem attackiert. Eine Kaskade enzymatischer Spaltungen der einzelnen Komplementkomponenten führt zur Bildung des Membranangriffskomplex (MAC), der die Zielzelle unter anderem durch Porenbildung in der Zellmembran attackiert und zu ihrer Lyse führt. Außerdem werden Erreger markiert (Opsonierung) und Immunzellen an den Ort der Entzündung gelockt (Chemotaxis).
Zytokine
Zytokine sind Proteine, die vor allem die Proliferation und Differenzierung von Zellen regulieren sowie eine wichtige Rolle als immunologische Mediatoren einnehmen. Fast alle Körperzellen schütten Zytokine auf besondere Reize hin aus. Zu den Zytokinen zählen auch die sogenannten Chemokine, welche die Wanderung der Leukozyten (Chemotaxis) steuern. Interferone haben meist eine immunstimulierende, antivirale und antitumorale Wirkung. Interleukine dienen vor allem der Kommunikation der Leukozyten untereinander.
Akute-Phase-Reaktion
Die Akute-Phase-Reaktion ist eine durch Gewebeschädigung ausgelöste Entzündungsreaktion. Zytokine und Cortisol stimulieren in der Leber die Synthese von ungefähr 30 verschiedenen Akute-Phase-Proteinen. Ihre Konzentration nimmt innerhalb weniger Stunden um ein Vielfaches zu. Fibrinogen steigert die Gerinnungsneigung, sodass eine lokale Thrombusbildung eine weitere Ausbreitung von Erregern über die Blutbahn verhindert. C-reaktives Protein dient der Opsonierung der Erreger und der Aktivierung des Komplementsystem. Diagnostisch wird es als unspezifischer Entzündungsparameter bestimmt. Weitere Beispiele sind Alpha-1-Antitrypsin, ein Proteaseninhibitor, der eine übermäßige Gewebsschädigung verhindern kann, und Ferritin, das Bakterien Eisen entzieht. Proteine, deren Serumkonzentration während einer akuten Entzündung sinkt, nennt man Anti-Akute-Phase-Proteine, z.B. Albumin oder Transferrin. Insgesamt sorgt die Akute-Phase-Reaktion dafür, dass die Entzündung lokal begrenzt bleibt, Erreger bekämpft und Reparaturprozesse initiiert werden. Zusammen mit den Zytokinen kommt es zu einem Anstieg der Körpertemperatur und der Leukozytenzahl sowie zur Verstärkung der Glukoneogenese und Proteolyse.
Zelluläre Elemente
Die Zellen des unspezifischen Immunsystems erkennen evolutionär konservierte Strukturen der Erreger, sogenannte Pathogen Associated Molecular Patterns (PAMPs) über spezielle keimbahnkodierte Rezeptoren, die Pattern-Recognition-Rezeptoren (PRRs). Sie unterscheiden dabei zwischen "fremd" und "körpereigen". Beispiele für PAMPs sind Lipopolysaccharide (LPS) oder bakterielle DNA. Zu den PRRs gehören u.a. Toll-like-, Scavenger- und NOD-like-Rezeptoren. Letztere erkennen intrazelluläre Erreger und induzieren das Inflammasom. Mutationen von Proteinen des Inflammasoms sind die Ursache von autoinflammatorischen Syndromen. Dazu zählen u.a. das Familiäre Mittelmeerfieber, das Hyperimmunglobulin-D-Syndrom oder das Muckle-Wells-Syndrom.
Die Stärke der Immunantwort wird durch einen zuvor stattgefundenen Kontakt von PPRs mit bestimmtem PAMPs epigenetisch moduliert, sodass bei einem nächsten Kontakt eine effektivere Immunantwort erfolgt ("trained immunity"). Desweiteren werden die Zellen des unspezifischen Immunsystems auch durch Alarmine aktiviert, z.B. viele Hitzeschockproteine und HMGB1. Das sind normalerweise intrazellulär vorkommende Proteine, die bei nekrotischem Zelltod in den Extrazellularraum gelangen. Entsprechend werden sie auch Damage Associated Molecular Patterns (DAMPs) genannt.
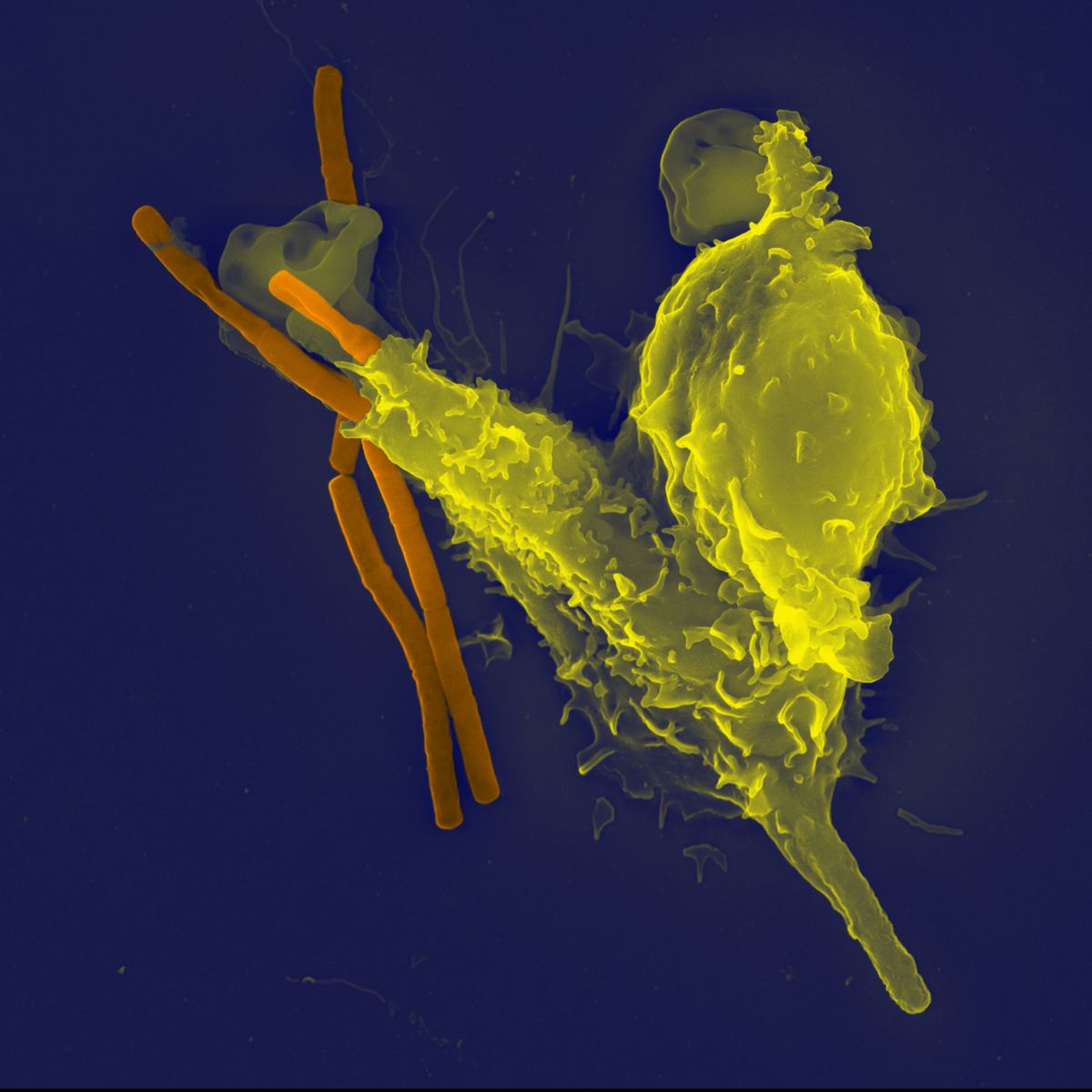
Neutrophile Granulozyten
Neutrophile Granulozyten sind mit einem Anteil von 65% die häufigste Form der Leukozyten. Sie zirkulieren im Blut und wandern im Falle einer Infektion zytokingesteuert in das Gewebe aus. Sie sind die ersten Immunzellen am Ort der Entzündung. Durch Phagozytose nehmen sie Pathogene auf und verdauen sie durch intrazelluläre Granula, die bakterizide Peptide und Enzyme enthalten. Desweiteren sind sie zur Netose befähigt: Hierbei handelt es sich um eine Art des eigenen Zelltods, bei dem sich Erreger in Neutrophil Extracellular Traps (NETs) festsetzen. Außerdem können neutrophile Granulozyten durch Freisetzung zytotoxischer Sauerstoffradikale (Oxidativer Burst) Erreger bekämpfen.
Mononukleäres Phagozytensystem
Das mononukleäres Phagozytensystem (MPS) wird auch als retikuloendotheliales (RES) oder retikulohistiozytäres System (RHS) bezeichnet. Dazu gehören Monozyten und Makrophagen incl. Alveolarmakrophagen, Kupffer-Zellen, Osteoklasten und Mikroglia. Monozyten verlassen nach 12 bis 24 Stunden die Blutbahn und reifen im Gewebe zu Makrophagen. Sie stellen nach der initialen Einwanderung von neutrophilen Granulozyten die dominierende Zellpopulation im entzündeten Gewebe dar. Nach Aktivierung durch PAMPs, DAMPs und Zytokine bekämpfen sie Erreger durch Phagozytose und oxidativen Burst. Bei chronischen Infektionen mit intrazellulären Erregern, können sie zu Epitheloidzellen transformieren oder sie werden durch Synzytiumbildung zu mehrkernigen Riesenzellen. Desweiteren präsentieren Makrophagen Antigene und regulieren so die weitere Immunreaktion.
Eosinophile Granulozyten
Eosinophile Granulozyten sind eine anteilsmäßig kleine Subgruppe der Leukozyten. Sie dienen vor allem der Abtötung von Parasiten. Pathophysiologisch sind sie an allergischen Reaktionen und am Asthma bronchiale beteiligt.
Basophile Granulozyten
Basophile Granulozyten bilden eine relativ kleine Untergruppe der Leukozyten, die nur begrenzt zur Phagozytose fähig ist. Sie migrieren nur bei Entzündungsprozessen (z.B. bei atopischer Dermatitis) in das Gewebe, können dort wochenlang überleben sowie Histamin und Zytokine freisetzten.
Natürliche lymphoide Zellen
In der Gruppe der natürlichen lymphoiden Zellen (Innate Lymphoid Cells, ILC) werden verschiedene Lymphozytentypen zusammengefasst. Die erste Gruppe (ILC1) bilden Natürliche Killerzellen, die auch als Large Granular Lymphocytes (LGL) bezeichnet werden. Sie dienen in erster Linie der Erkennung und Abtötung von virusinfizierten sowie entarteten Zellen. Man unterscheidet zytotoxischen NK-Zellen, die vor allem im Blut vorkommen und in entzündete und infizierte Gewebe migrieren, von immunregulatorischen NK-Zellen, die vor allem im Lymphknoten vorkommen. ILC2 spielen bei parasitären und allergischen Erkrankungen sowie beim eosinophilen Asthma eine Rolle, ILC3 bei der Abwehr in Schleimhäuten.
Mastzellen
Mastzellen ähneln den basophilen Granulozyten und sind für die Abwehr von Parasiten sowie für allergische Reaktionen relevant. Sie enthalten in ihren Granula viel Histamin und Heparin. Mastzellen sind vor allem im interstitiellen Bindegewebe lokalisiert und können Antigene durch ihre membranständigen IgE-Antikörper erkennen. Zusätzlich werden sie durch das Komplementsystem und physikalische Faktoren (z.B. Hitze, Kälte) aktiviert.
Dendritische Zellen
Als dendritische Zellen werden professionelle antigenpräsentierende Zellen (APC) bezeichnet. Sie befinden sich in Oberflächengeweben (Haut, Schleimhäute) und nehmen eine Vielzahl von Antigenen auf. Anschließend wandern sie zu den lymphatischen Organen und präsentieren die prozessierten Antigene vor allem naiven T-Lymphozyten, die dadurch zu Effektorzellen reifen (Priming). Durch Präsentation von körpereigenen Antigenen tragen sie außerdem entscheidend zur Vermeidung von Autoimmunreaktionen bei. Je nach Herkunft, Vorkommen und genauer Funktion werden unterschiedliche Formen unterschieden, z.B. Langerhans-Zellen oder plasmazytoide dendritische Zellen.
Antigenpräsentierende Zellen
Zu den (professionellen) antigenpräsentierende Zellen gehören neben den dendritischen Zellen die B-Lymphozyten sowie die Zellen des mononukleär-phagozytären Systems. Zwar können fast alle Körperzellen Antigene präsentieren, jedoch keine Reifung von naiven T-Lymphozyten auslösen.
Phagozyten
Als Phagozyten, auch Fresszellen genannt, werden die zur Phagozytose befähigten Zellen zusammengefasst. Dazu zählen die dendritischen Zellen, die Granulozyten sowie Zellen des mononukleär-phagozytären Systems.
Klinik
Angeborene oder erworbene Defekte des unspezifischen Immunsystem führen zu einer Immundefizienz. Beispiele sind:
- Primäre Immundefekte (PID), z.B. Komplementdefekte
- Erworbene Immundefekte, z.B. Agranulozytose
Bildquellen
- "Neutrophil engulfing Bacillus anthracis". PLoS Pathogens 2005, Nov. 1(3): Cover page; Volker Brinkmann with a Leo 1550 scanning electron microscope. DOI:10.1371, CC BY 2.5
Literatur
- Suttorp N et al., Harrisons Innere Medizin. 19. Auflage. Berlin. ABW Wissenschaftsverlag; 2016
- Blum H et al., Klinische Pathophysiologie. 10. Auflage. Stuttgart. Thieme; 2018