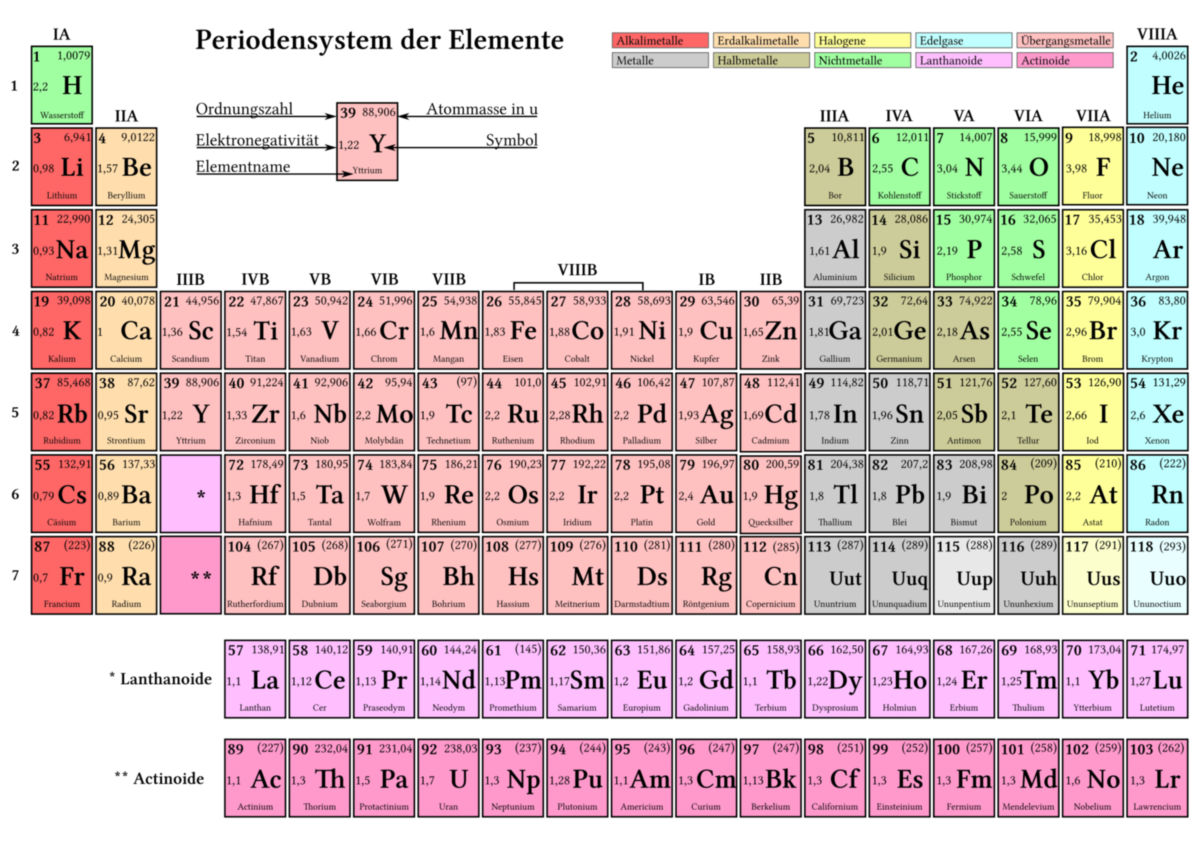
Periodensystem
Abkürzung: PSE
Synonyme: Periodensystem der Elemente, PSE
Englisch: table of the elements, periodic table, periodic table of the elements
Definition
Das Periodensystem ist eine Übersicht aller bekannten chemischen Elemente. Die Elemente werden mit steigender Ordnungszahl entsprechend ihrer chemischen Eigenschaften in 7 Perioden (dargestellt als Zeilen) sowie in 8 Hauptgruppen und zahlreiche Nebengruppen (dargestellt als Spalten) eingeteilt.
Die für die Lebensprozesse relevanten Elemente werden im so genannten Periodensystem des Lebens zusammengefasst.
Einteilung
Im PSE unterscheidet man historisch zwischen Hauptgruppen und Nebengruppen. Eine international gültige Einteilung bietet die IUPAC-Klassifikation. Weiterhin unterscheidet man u.a. zwischen Metallen, Halbmetallen und Nichtmetallen.
Hauptgruppen
- Gruppe 1: Wasserstoff und Alkalimetalle
- Gruppe 2: Erdalkalimetalle
- Gruppe 3: Borgruppe
- Gruppe 4: Kohlenstoffgruppe
- Gruppe 5: Stickstoffgruppe
- Gruppe 6: Chalkogene (Sauerstoffgruppe)
- Gruppe 7: Halogene
- Gruppe 8: Edelgase
Nebengruppen
- äußere Übergangsmetalle
- innere Übergangsmetalle: Lanthanoide, Actinoide
IUPAC-Gruppen
Die aktuelle Einteilung nach IUPAC unterscheidet zwischen folgenden Gruppen:
- Gruppe 1 - Lithiumgruppe: Wasserstoff und Alkalimetalle (Lithium, Natrium, Kalium, Rubidium, Caesium, Francium)
- Gruppe 2 - Beryllium-Gruppe oder Erdalkalimetalle (Beryllium, Magnesium, Calcium, Strontium, Barium, Radium)
- Gruppe 3 - Scandiumgruppe (Scandium, Yttrium, Lutetium, Lawrencium)
- Gruppe 4 - Titangruppe (Titan, Zirconium, Hafnium, Rutherfordium)
- Gruppe 5 - Vanadiumgruppe (Vanadium, Niob, Tantal, Dubnium)
- Gruppe 6 - Chromgruppe (Chrom, Molybdän, Wolfram, Seaborgium)
- Gruppe 7 - Mangangruppe (Mangan, Technetium, Rhenium, Bohrium)
- Gruppe 8 - Eisengruppe (Eisen, Ruthenium, Osmium, Hassium)
- Gruppe 9 - Kobaltgruppe (Kobalt, Rhodium, Iridium, Meitnerium)
- Gruppe 10 - Nickelgruppe (Nickel, Palladium, Platin, Darmstadtium)
- Gruppe 11 - Kupfergruppe (Kupfer, Silber, Gold, Röntgenium)
- Gruppe 12 - Zinkgruppe (Zink, Cadmium, Quecksilber, Copernicium)
- Gruppe 13 - Borgruppe (Bor, Aluminium, Gallium, Indium, Thallium, Nihonium)
- Gruppe 14 - Kohlenstoffgruppe (Kohlenstoff, Silicium, Germanium, Zinn, Blei, Flerovium)
- Gruppe 15 - Stickstoffgruppe oder Pnictogene (Stickstoff, Phosphor, Arsen, Antimon, Bismut, Moscovium)
- Gruppe 16 - Sauerstoffgruppe oder Chalkogene (Sauerstoff, Schwefel, Selen, Tellur, Polonium, Livermorium)
- Gruppe 17 - Fluorgruppe oder Halogene (Fluor, Chlor, Brom, Iod, Astat, Tenness
- Gruppe 18 - Helium- oder Neongruppe oder Edelgase (Helium, Neon, Argon, Krypton, Xenon, Radon, Oganesson)
- Lanthanoide: Lanthan, Cerium, Praseodymium, Neodymium, Promethium, Samarium, Europium, Gadolinium, Terbium, Dysprosium, Holmium, Erbium, Thulium, Ytterbium, (Lutetium)
- Actinoide: Actinium, Thorium, Protactinium, Uran, Neptunium, Plutonium, Americium, Curium, Berkelium, Californium, Einsteinium, Fermium, Mendelevium, Nobelium, (Lawrencium)
Historie
Die Entdeckung von chemischen Elementen erfolgte ziemlich früh und wurde zahlreich dokumentiert. Im 18. Jahrhundert waren lediglich etwa 15 Elemente bekannt und wurde vor allem in die Großgruppen, Metalle und Nichtmetalle sortiert. Das 19. Jahrhundert war das Jahrhundert der Entdeckungen von Elementen. Im 20. Jahrhundert wurden nur noch wenige neue, vor allem radioaktive Elemente beschrieben.
Wichtige Eckdaten
- 19 Jahrhundert: J.W. Döbereiner erstellt erstmals einen Überblick der Elemente nach den Atommassen und definiert damit Eigenschaftstendenzen.
- Jahr 1863: A. Reina Newlands stelle eine nach der Atommasse u geordnetes System vor.
- Jahr 1869: L. Meyer stellt ein PSE auf nach aufsteigenden Atommassen, wobei auf die Anzahl der Valenzelektronen mit einbezogen wurde.
- 20. Jahrhundert: Aufbau der Atome wurde entdeckt und die Periodizität wurde darüber erklärt und definiert.
Grundlagen
Das Periodensystem ist in seiner heute bekannten Form als sogenanntes Langperiodensystem illustriert. Durch diese Darstellung sind folgende Grundlagen festzuhalten:
- Elemente sind durch spezielle Abkürzungen dargestellt.
- Jedes Element besitzt eine Ordnungszahl und Symbolik: Die Ordnungszahl ist entsprechend ihrer Anordnung im Periodensystem gleich der Anzahl der Protonen.
- Jedem Element ist eine Massenzahl in der Einheit u zugeordnet, berechnet durch den Bezug zu Kohlenstoff und der Zusammensetzung aus subatomaren Teilchen.
- Eine Periode ist eine waagerechte Zeile und entspricht einer Schale nach dem Schalenmodell nach Bohr
- Eine Gruppe ist eine senkrechte Spalte.
Tendenzen und Aussagemittel
Es sind folgende Tendenzen im Periodensystem festzuhalten und für Einschätzung bei unbekannten Werten zu verwenden:
- Die Elektronegativität nimmt von links nach rechts zu (bis auf die Edelgase) und von oben nach unten ab. Fluor ist das Element mit der höchsten Elektronegativität.
- Die Anzahl der Außenelektronen nehmen innerhalb einer Periode von links nach rechts zu.
- Die Neigung zur Ionisierung verhält sich wie folgt: Ziel ist das Erreichen der Edelgaskonfiguration durch Abgabe oder Aufnahme von Elektronen, was zur Bildung von Kationen oder Anionen führt. Von links nach rechts innerhalb einer Periode nimmt die Neigung, Elektronen aufzunehmen, zu und die Neigung, Elektronen abzugeben, ab.
- Innerhalb einer Gruppe nehmen die Schalen zu und damit die Anzahl der Elektronen im Atom
- Die Masse und der Atomradius nimmt von oben nach unten zu. Die Masse nimmt ebenfalls von links nach rechts zu - mit einigen Ausnahmen (z.B. Co -> Ni). Der Atomradius nimmt hier ab, weil die Elektronen stärker angezogen werden.
- Der Metallcharakter nimmt von oben nach unten innerhalb einer Gruppe zu, von links nach rechts innerhalb einer Periode ab.
- Die Basizität der Oxide nimmt innerhalb einer Gruppe zu, während von links nach rechts diese abnimmt.
- Des Weiteren unterscheidet man noch unter sogenannten Querverbindungen: Es gibt Ähnlichkeiten zwischen schräg zueinanderstehenden Elementen, wie zum Beispiel Lithium und Magnesium im Reaktionsverhalten.