Metall
von griechisch: metallon - Bergwerk
Englisch: metal
Definition
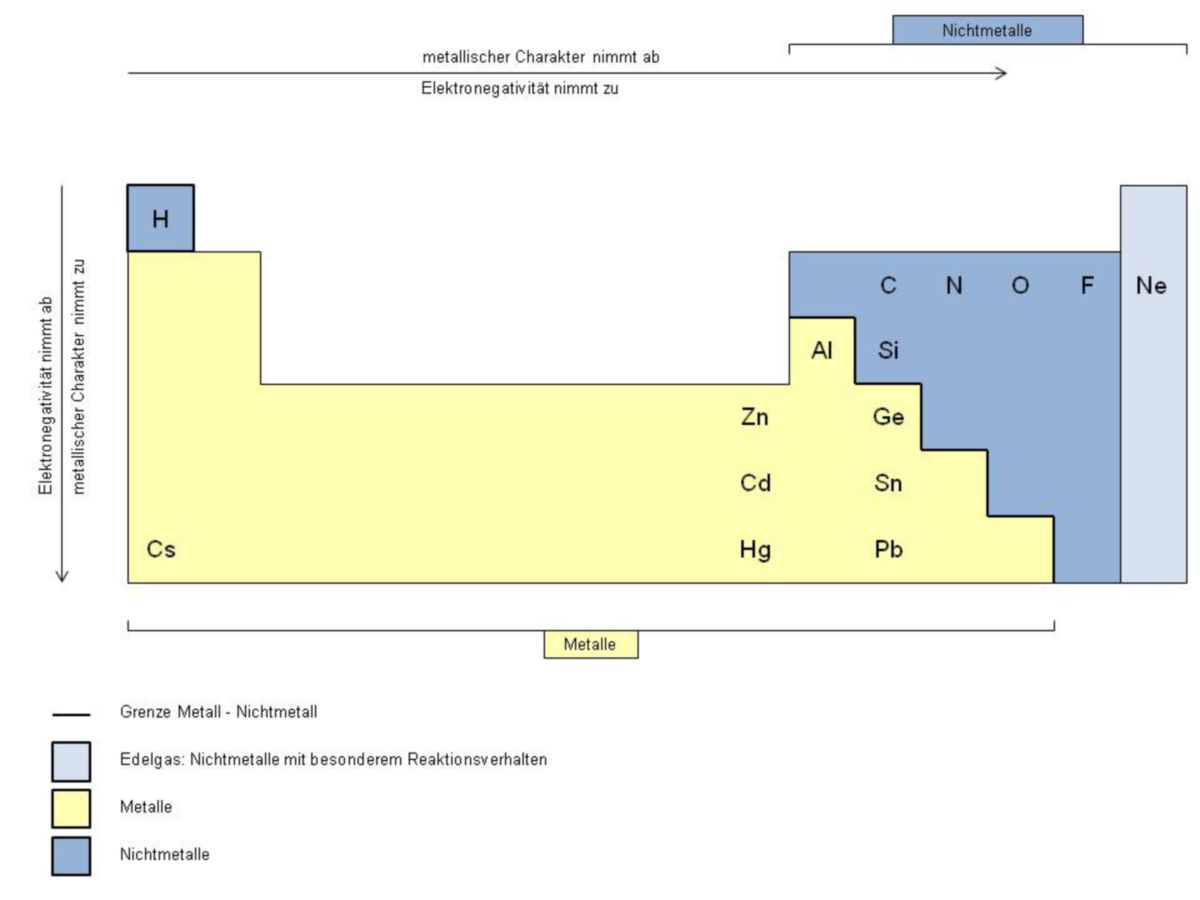
Metalle gehören zu den am häufigsten vorkommenden chemischen Elementen auf der Erde. Mehr als 70% der Elemente des Periodensystems sind Metalle. Alle Metalle findet man links von der diagonalen Grenze von Bor nach Astat. Der Übergang zwischen Metallen und Nichtmetallen findet kontinuierlich über die Halbmetalle statt. Diese können je nach Rahmenbedingung und Bindungspartner als Metall oder als Nichtmetall reagieren.
Chemische Eigenschaften
Um als Metall definiert, zu werden muss ein Element folgende Eigenschaften erfüllen:
- Geringe Elektronenzahl in der äußeren Schale (geringer als die Koordinationszahl)
- Metallischer Glanz
- Reflexionsvermögen
- Undurchsichtigkeit
- (hohe) elektrische Leitfähigkeit
- Thermische Leitfähigkeit
- Duktilität
Darüber hinaus sind zwei weitere Eigenschaften als Metalleigenschaften definiert, die aber nicht zwangsweise erfüllt sein müssen. Diese kommen allerdings in fast allen Metallen vor.
- Kristallinität in mehreren Gittertypen
- (hohe) Dichte
- Geringe Ionisierungsenergie ( in der Regel kleiner als 970 kJ/mol)
Ein einzelnes Atom aus einem Element besitzt keines der oben genannten Eigenschaften. Sie sind somit erst dann Metalle, wenn sie einen Atomverband bilden. Im Gegensatz zu den meist kovalent gebundenen, molekularen Nichtmetallen haben Metalle einen eigenen Bindungstyp; die Metallbindung.
Dieses Modell beruht auf der Tatsache, dass bei Zusammenlagerung der Atome die Elektronen der positiven Kerne über alle Kerne delokalisiert werden und somit das sog. Elektronengas bilden. Dieses "Gas" befindet sich verbindend zwischen allen Atomkernen, die auch Atomrümpfe genannt werden. Durch diese Denkweise wird deutlich, warum Metalle eine sehr hohe Verformbarkeit aufweisen. Die hohe Leitfähigkeit der Metalle kann ebenfalls mit diesem Modell erklärt werden. Je mehr freie Ladungsträger vorhanden sind, umso höher die Leitfähigkeit. Da im Elektronengas alle Elektronen beweglich sind,haben Metalle eine sehr hohe elektrische und thermische Leitfähigkeit.
Neben dem Elektronengasmodell existiert ein weiteres Modell für die Beschreibung von anderen Eigenschaften und Aspekte der Metalle. Dieses Modell wird das Bändermodell genannt.
Periodensystem
Im Periodensystem kann man die Metalle bevorzugt in den Hauptgruppen 1 und 2 finden. Zudem sind alle Elemente der Nebengruppen Metalle, was sich im Synonym Übergangsmetalle ausdrückt. Zwischen Metallen und Nichtmetallen befinden sich die sogenannten Halbmetalle. Hierzu zählt man zum Beispiel Silicium oder Germanium.
Es kann ein Wechsel der Eigenschaften innerhalb einzelner Hauptgruppen eintreten. Beispielsweise ist Kohlenstoff (Gruppe 14) ein Nichtmetall, Silicium und Germanium zählen zu den Halbmetallen, Zinn und Blei gehören zu den Metallen. Links stehen innerhalb einer Periode die Metalle (Alkali- und Erdalkalimetalle) und rechts die Nichtmetalle (Sauerstoff, Schwefel, Halogene, Edelgase). Einfach ausgedrückt: Links unten im Periodensystem sind typischerweiser Metalle anzufinden (z.B. Caesium), rechts oben befinden sich typische Nichtmetalle (z.B. Fluor).
| Innerhalb einer Hauptgruppe nimmt der metallische Charakter eines Elements von oben nach unten zu und innerhalb einer Periode von links nach rechts ab. |
|---|
Unterteilung
Metalle werden einmal nach ihrer Dichte und einmal nach ihrer Reaktivität unterteilt. Auf die Dichte bezogen unterscheidet man zwischen Leichtmetallen und Schwermetallen. Hierbei ist allerdings zu erwähnen, dass für beide Begriffe keine eindeutigen Definitionen existieren. IUPAC empfiehlt deshalb diese Begriffe nicht mehr zu benutzen, denn manche Schwermetalle, die mit toxischen Schwermetallen gleichgesetzt werden, sind für den menschlichen Körper als Spurenelement von großer Bedeutung.
Hinsichtlich der Reaktivität trennt man Metalle in Edelmetalle und unedle Metalle. Dabei sind Edelmetalle korrosionsbeständig und benötigen eine hohe Ionisationsenergie, wohingegen unedle Metalle sehr leicht reagieren, da ihre Ionisationsenergie niedrig ist. Deshalb werden unedle Metalle oft als Reduktionsmittel eingesetzt. Diese Eigenschaften der Metalle können nur mit Hilfe des Bändermodells nachvollzogen werden.
Allgemeine Reaktionen
Metalle treten im Allgemeinen in Verbindungen als Kationen auf. Eine Verbindung zwischen einem Metall und einem Nichtmetall wird als Salz bezeichnet. Dabei ist das Metall ein Kation und das Nichtmetall ein Anion. Diese ordnen sich als eine geordnete, feste Struktur an, welche als Kristallgitter bezeichnet wird. In einer Verbindung dieser Art werden die Ionen durch elektrostatische Kräfte zusammengehalten, welche man auch als Ionenbindung bezeichnet. Metalle der Nebengruppenelemente, die sog. Übergangsmetalle, bilden meist mit nichtmetallischen Liganden sog. Komplexverbindungen durch das Eingehen von koordinativen Bindungen. Metalle mit hohen Oxidationsstufen, wie z.B. Cr6+, können zu Komplexanionen aggregieren.
Natürliches Vorkommen
In der Natur kommen Metalle fast ausschließlich als Erze in unserer Erdkruste vor. Typische Erze sind Metallverbindungen mit Sauerstoff als Oxide, mit Schwefel als Sulfide und mit Kohlenstoff als Carbonate. Der Unterschied zwischen einem Gestein und einem Erz ist lediglich die Abbauwürdigkeit des gewünschten Elementes aus dem gewonnenen Rohstoff. Einige wenige Metalle wie Gold oder Platin kommen allerdings in ihrer natürlichen, atomaren Form vor. Diese werden als gediegene Metalle bezeichnet.
Medizinische und biologische Bedeutung
Im Körper werden einige Metalle bei lebenswichtigen Prozessen als Katalysator oder als Spurenelement benötigt. Andererseits können einige Metalle körpereigene Katalysatoren bzw. Enzyme blockieren und sogar in einigen Fällen den Tod des Organismus bedeuten. Meist entscheidet die Konzentration im Körper, ob ein Metall toxisch oder nützlich wirkt. Beispielsweise ist Mangan als Spurenelement bedeutend für die Umwandlung von Isocitrat über Oxalsuccinat zu alpha-Ketoglutarat im Citratzyklus. Ohne Mangan würde diese Reaktion nicht oder nur bedingt ablaufen, was zu Störungen in der Energieversorgung führen würde. Allerdings sind hohe Konzentrationen von manganhaltigen Staubpartikeln für den Körper schädlich. Es treten Krankheiten wie Bronchitis oder Pneumonitis auf, und darüber hinaus werden durch die Schädigung des Zentralnervensystems motorische Behinderungen ausgelöst. In der Photosynthese ist Mangan einer der Hauptakteure um Wasser in Sauerstoff zu oxidieren und ist somit eines der Metalle welches für uns aerobe Lebewesen das Leben ermöglicht. Besonders komplexchemische Medikamente spielen in der pharmazeutischen Chemie eine Rolle, wie zum Beispiel das Zytostatikum cis-Platin, welches als Metallzentrum, wie der Name schon sagt, ein Platinatom trägt. Diese beiden Beispiele sind nur ein sehr kleiner Bruchteil der Funktionen von Metallen bei biologischen Prozessen.