Dabrafenib
Handelsnamen: Finlee®, Tafinlar®
Synonym: GSK-2118436
Englisch: dabrafenib
Definition
Dabrafenib ist ein antineoplastischer Arzneistoff aus der Klasse der Proteinkinase-Inhibitoren. Es handelt sich um einen BRAF-Kinase-Inhibitor, der als Monotherapie oder in Kombination mit Trametinib zur Behandlung des malignen Melanoms, des nicht-kleinzelligen Bronchialkarzinoms (NSCLC) und des Glioms eingesetzt wird, wenn eine BRAF-V600E-Mutation der Tumorzellen nachgewiesen wurde.
Chemie
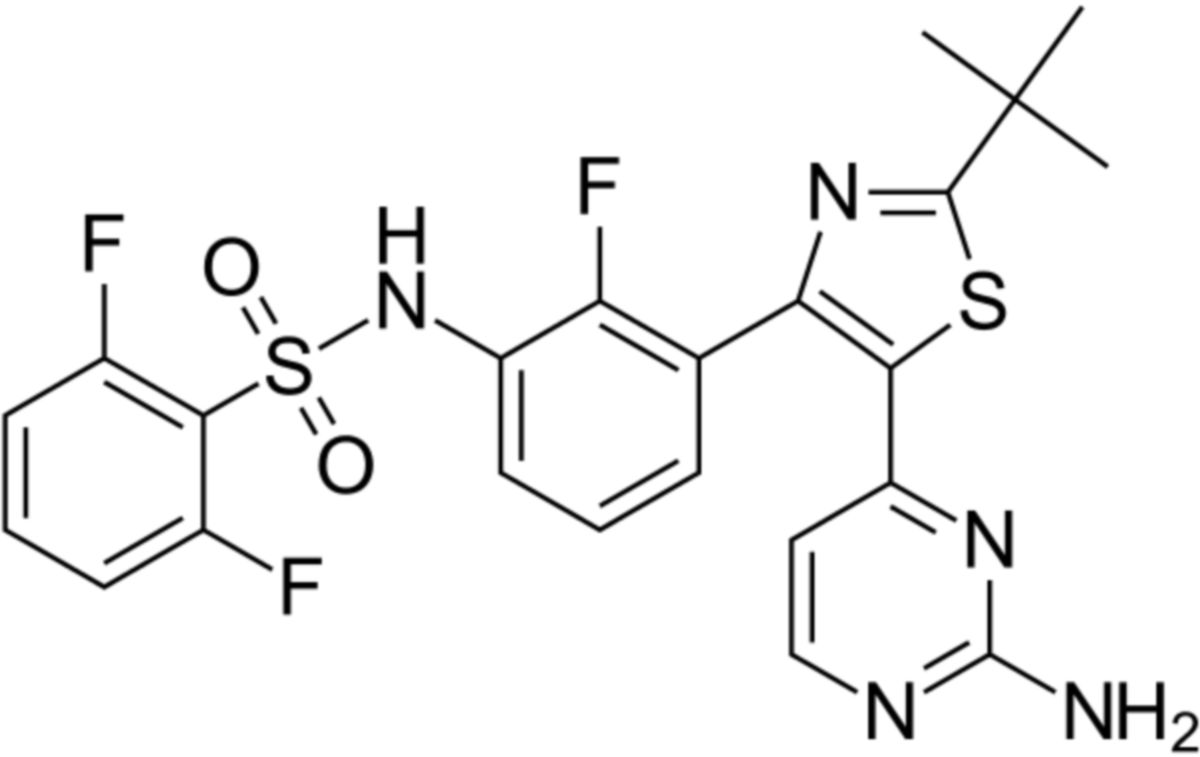
Dabrafenib ist ein Pyrimidin- und ein Thiazol-Derivat. Der Wirkstoff wird über mehrere Zwischenstufen aus 3-Brom-2-fluorbenzoesäure, Methanol und anderen organischen Verbindungen synthetisiert. Die Summenformel ist C23H20F3N5O2S2. Der chemische Name lautet
- N-[3-[5-(2-Aminopyrimidin-4-yl)-2-tert-butyl-1,3-thiazol-4-yl]-2-fluorophenyl]-2,6-difluorbenzensulfonamid (IUPAC)
Die molare Masse beträgt 519,6g/mol, der Oktanol-Wasser-Koeffizient (logP) 5,44. Die CAS-Nummer ist 1195765-45-7. Als Arzneistoff wird Dabrafenibmesilat verwendet, ein Salz der Methylsulfonsäure (MSS), ein weißes bis leicht gefärbtes Pulver, das in Wasser praktisch unlöslich ist.
Wirkmechanismus
Dabrafenib bindet selektiv an die Serin-Threonin-Kinase BRAF und blockiert dadurch die Aktivierung des RAS/RAF/MEK/ERK-Signalwegs, der an der Steuerung des Zellwachstums beteiligt ist. Onkogene Mutationen im BRAF-Gen können eine Überaktivität des Signalwegs hervorrufen, was zu unkontrolliertem Zellwachstum und damit zu Krebs führen kann. Dadurch werden von diesem Signalweg abhängige Transkriptionsfaktoren nicht mehr phosphoryliert und es kommt bei einer Vielzahl von Zielgenen zum Abbruch der Transkription, sodass die Proliferation der Tumorzellen blockiert und das Wachstum des Tumors gestoppt wird.[1][2]
Dabrafenib ist gegen die BRAF-Varianten V600E, V600K und V600D wirksam.
Pharmakokinetik
Dabrafenib wird nach oraler Aufnahme rasch resorbiert. Maximale Plasmaspiegel werden nach 1,5 bis 2 Stunden erreicht. Die Bioverfügbarkeit erreicht 95 %. Die Plasmaproteinbindung beträgt 100 %, das Verteilungsvolumen 46 Liter (ca. 0,7 l/kgKG). Die Biotransformation in der Leber erfolgt über die Cytochrom-P450-Isoenzyme CYP2C8 und CYP3A4. Die Elimination der Metaboliten erfolgt zu 71 % mit den Fäzes und zu 23 % mit dem Urin. Die Eliminationshalbwertszeit beträgt etwa 10 Stunden.[1]
Indikationen
- Monotherapie von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation[1]
- Kombinationstherapie mit Trametinib
- bei erwachsenen Patienten mit fortgeschrittenem nicht-kleinzelligem Bronchialkarzinom (NSCLC) mit einer BRAF-V600-Mutation[1]
- bei pädiatrischen Patienten ab einem Alter von einem Jahr mit einem niedriggradig malignem Gliom mit einer BRAF-V600E-Mutation, die eine systemische Therapie benötigen[3]
- bei pädiatrischen Patienten ab einem Alter von einem Jahr mit einem hochgradig malignem Gliom mit einer BRAF-V600E-Mutation, die zuvor mindestens eine Strahlen- und/oder Chemotherapie erhalten haben[3]
Besondere Hinweise
Vor der Anwendung von Dabrafenib muss beim Patienten die BRAF-V600E-Mutation mittels eines In-vitro-Diagnostikums (IVD) mit CE-Kennzeichnung mit der entsprechenden Zweckbestimmung bestätigt worden sein. Sollte ein IVD mit CE-Kennzeichnung nicht verfügbar sein, muss der BRAF-V600E-Nachweis durch einen alternativen validierten Test erbracht werden.[3]
Wirksamkeit und Sicherheit des Arzneistoffs bei Patienten mit einem nicht-mutierten BRAF-Protein sind nicht belegt.
Darreichungsform
Dabrafenib steht in Form von Hartkapseln und Tabletten zur Herstellung einer Suspension zur oralen Applikation zur Verfügung.
Dosierung
Die empfohlene Dosierung beträgt bei Erwachsenen zweimal täglich 150 mg Dabrafenib allein oder in Kombination mit einmal täglich 2 mg Trametinib. Die Einnahme soll mindestens eine Stunde vor einer Mahlzeit erfolgen. Im weiteren Verlauf der Behandlung erfolgt eine schrittweise Dosisreduktion.[1]
Bei pädiatrischen Patienten ist eine körpergewichtsbezogene Dosierung notwendig.[3]
Hinweis: Diese Dosierungsangaben können Fehler enthalten. Ausschlaggebend ist die Dosierungsempfehlung in der Herstellerinformation.
Nebenwirkungen
Die häufigsten unerwünschten Wirkungen (≥ 20 %) von Dabrafenib sind:[3]
- Pyrexie (nicht-infektiös) mit Rigor, Dehydration, Hypotonie und/oder akuter prärenaler Niereninsuffizienz
- Exanthem, akneiforme Dermatitis
- Kopfschmerzen
- Übelkeit, Erbrechen, Diarrhö, Abdominalschmerz
- Fatigue
- Hauttrockenheit
- Blutungen
- Neutropenie
- Husten
- Anstieg der Transaminasen
Unter der Therapie mit Dabrafenib wurde die Entstehung neuer gutartiger und bösartiger Neubildungen beobachtet, darunter kutane Malignome (z.B. Plattenepithelkarzinome (cuSCC), Keratoakanthome, neue primäre Melanome). Maligne Tumoren anderer Organe betreffen die Blutbildung (chronische myelomonozytäre Leukämie), nicht-kutane Plattenepithelkarzinome des Kopf- und Halsbereichs, die Bauchspeicheldrüse (Pankreaskarzinom bei Monotherapie und in Kombination mit Trametinib), die Gallenwege (Adenokarzinom) und das Kolon (in Kombination mit Trametinib (kolorektales Karzinom).
Durch eine Schädigung der Augen (z.B. Uveitis, Iritis, Iridozyklitis) kann es zu Sehstörungen, Photophobie und Augenschmerzen kommen.
Innerhalb von 2 und 5 Monaten nach Behandlungsbeginn kann sich eine linksventrikuläre Dysfunktion bis hin zur Herzinsuffizienz ausprägen.
Weitere schwerwiegende Nebenwirkungen (z.B. Stevens-Johnson-Syndrom, DRESS-Syndrom, Rhabdomyolyse, Pankreatitis, Kolitis, gastrointestinale Perforation, tiefe Venenthrombose, Lungenembolie, Sarkoidose, hämophagozytische Lymphohistiozytose) können tödlich verlaufen.[3]
Wechselwirkungen
Da Dabrafenib ein Substrat von CYP2C8 und CYP3A4 ist, sollte die gleichzeitige Einnahme mit starken Induktoren dieser Enzyme vermieden werden, da sonst mit einem Wirkungsverlust zu rechnen ist. Mittel, die den pH-Wert des Magens erhöhen, wie zum Beispiel Protonenpumpenhemmer, können die Bioverfügbarkeit von Dabrafenib verringern. Dabrafenib ist ein Induktor der Enzyme bzw. Enzymgruppen CYP3A4, CYP2C und CYP2B6 und kann zu einem Wirkverlust zahlreicher Arzneimittel führen. Die Fachinformation enthält detaillierte Angaben zu möglichen weiteren Interaktionen.[1]
Kontraindikationen
- Überempfindlichkeit gegen Dabrafenib oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft und Stillzeit
Bei männlichen Patienten kann es durch die Behandlung mit Dabrafenib zu einer irreversiblen Schädigung der Spermatogenese mit Infertilität kommen.
Bei tierexperimentellen Untersuchungen wurden reproduktionstoxische und teratogene Wirkungen festgestellt. Dabrafenib kann die Wirksamkeit von oralen oder systemischen hormonellen Kontrazeptiva verringern, daher sollte eine andere zuverlässige Verhütungsmethode angewendet werden. Frauen im gebärfähigen Alter müssen während der Therapie und 2 Wochen nach dem Absetzen von Dabrafenib sowie 16 Wochen nach Beendigung der Behandlung mit Trametinib eine zuverlässige Verhütungsmethode anwenden.[3]
Es ist nicht bekannt, ob Dabrafenib in die Muttermilch übertritt. Ob das Stillen zu unterbrechen ist oder auf die Behandlung während der Stillzeit verzichtet werden soll, ist im Einzelfall zu entscheiden.
Toxizität
Es liegen aktuell (2024) keine Erfahrungen zur Symptomatik einer Überdosierung oder Vergiftung mit Dabrafenib vor. Es ist davon auszugehen, dass es im Zusammenhang mit einer Pyrexie zu akut lebensbedrohlichen Verläufen kommen kann. Eine primäre Giftentfernung durch Verabreichung von Aktivkohle kann innerhalb einer Stunde nach der Ingestion erfolgen. Die weitere Behandlung erfolgt in jedem Fall symptomatisch. Ein spezifisches Antidot steht bisher (2024) nicht zur Verfügung. Aufgrund seiner pharmakokinetischen Eigenschaften (hohe Plasmaproteinbindung) ist eine sekundäre Giftentfernung durch Hämodialyse nicht effektiv.
Zulassung
Nutzenbewertung
Ein Zusatznutzen einer Therapie mit Dabrafenib wird vom G-BA auf der Basis der vom IQWiG ausgewerteten Studienergebnisse wie folgt eingeordnet:[6]
- nicht belegter Zusatznutzen gegenüber einer zweckmäßigen Vergleichstherapie.
Kosten
Die Jahrestherapiekosten betragen pro Patient rund 140.000 €.[6]
ATC-Code
- L01EC02 - Antineoplastische und immunmodulierende Mittel - Antineoplastische Mittel - Proteinkinase-Inhibitoren - BRAF-Serin-Threoninkinase-Inhibitoren
Quellen
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Fachinformation Tafinlar, Novartis Pharma, abgerufen am 02.05.2024
- ↑ Pharmazeutische Zeitung Online Arzneistoffe | Dabrafenib abgerufen am 29.11.18
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Zusammenfassung der Merkmale des Arzneimittels Finlee, EMA, abgerufen am 02.05.2024
- ↑ Tafinlar. EMA, abgerufen am 02.05.2024
- ↑ Finlee, EMA, abgerufen am 02.05.204
- ↑ 6,0 6,1 IQWIG-Berichte-Nr.524 Dabrafenib (nicht kleinzelliges Lungenkarzinom) – Nutzenbewertung gemäß § 35a SGB V abgerufen am 29.11.2018
Weblinks
- Drugbank - Dabrafenib, abgerufen am 02.05.2024
- Pharmazeutische Zeitung Arzneistoffe - Dabrafenib, abgerufen am 02.05.2024
- Gelbe Liste Wirkstoffe - Dabrafenib, abgerufen am 02.05.2024
- PharmaWiki - Dabrafenib, abgerufen am 02.05.2024
- PubChem: 44462760
- MeSH: 67561627